В течение ряда лет в России, как и во всем мире, активно изучается взаимосвязь между низким потреблением фолатов с пищей, гипергомоцистеинемией у беременных женщин и риском возникновения акушерских и перинатальных осложнений[1, 2, 13, 16, 17, 23, 24]. Для снижения риска аномалий развития плода и осложнений гестации таким женщинам рекомендован профилактический прием препаратов фолиевой кислоты (ФК)[19].
Особый интерес представляет вопрос о причастности полиморфизмов генов фолатного обмена, дефицита фолатов и обусловленной им гипергомоцистеинемии к невынашиванию беременности, фетоплацентарной недостаточности (ФПН), преэклампсии, преждевременным родам, задержке роста плода и формированию врожденных пороков[2, 11, 12, 22]. В России каждая вторая женщина является носительницей мутаций гена, кодирующего фермент 5-метилентетрагидрофолатредуктазу (MTHFR), что затрудняет образование активного фолата — метафолина, или [6S]-5-метилтетрагидрофолата (5-МТГФ)[1]. В США популяционная распространенность гетерозиготной формы полиморфизма гена фермента MTHFR достигает 60%, а носителями гомозиготной формы этих генетических вариаций являются около 25% определенных групп населения[15, 20]. В результате генетического полиморфизма функция фермента MTHFR снижается на 70% при гомозиготной и примерно на 35% при гетерозиготной форме[15].
К основным генам фолатного цикла относятся также гены метионинредуктазы (MTR) и метионинсинтазаредуктазы (MTRR). Полиморфизмы генов MTHFR-677C>T, MTHFR-1298A>C, MTRR-66A>G повышают риски гипергомоцистеинемии и ассоциированы с различными осложнениями беременности.
Для профилактики и коррекции гипергомоцистеинемии, обусловленной дефектами генов фолатного цикла, до настоящего времени применяют достаточно высокие дозировки (3–5 мг) препаратов синтетической ФК, что сопровождается нормализацией уровня гомоцистеина в крови женщин и снижением риска ряда акушерских осложнений[4, 7]. Однако в литературе последних лет появляется все больше данных о том, что прием фолатов в дозах, превышающих физиологические, может обусловить неблагоприятное действие неметаболизированной синтетической ФК в виде маскировки В12-дефицитной анемии, высокого риска онкологических заболеваний, депрессии, когнитивных нарушений[2, 15].
Избыточное потребление синтетических фолатов при беременности также ассоциировано с неблагоприятными последствиями для плода. С ним связывают нарушение когнитивных способностей и зрения у новорожденного, риски ожирения в более старшем возрасте[2]. Избыточный прием синтетической ФК в составе высокодозовых препаратов (более 1 мг в таблетке) подавляет физиологический метаболизм фолатов и тормозит превращение ФК в биологически активные производные — тетрагидрофолаты — вследствие ингибирования внутриклеточного транспорта фолатов и их последующих биотрансформаций[3].
Таким образом, актуальными для современного акушерства являются не только проблемы восполнения дефицита микронутриентов, но и способы предотвращения их избыточного потребления в гестационном периоде. Медицинская общественность России в настоящее время широко обсуждает агрессивную «профилактическую и лечебную» фармакологическую полипрагмазию при беременности, которая особенно часто наблюдается в группах женщин с высоким риском акушерских и перинатальных осложнений начиная с прегравидарного этапа[8].
Снизить возможные риски избытка потребления фолатов беременными может прием добавки 5-МТГФ. Метафолин является легкоусвояемой биологически активной формой фолатов и всасывается в кровь без участия ферментативных систем кишечника, что позволяет обеспечить достаточное присутствие фолатов в тканях независимо от активности ферментных систем. Для утилизации данной формы фолатов в организме не требуется дополнительных этапов метаболизма. Метафолин непосредственно захватывается клетками и используется в обменных процессах — репликации ДНК и циклах метилирования[3, 10, 15]. Результаты исследования уровня фолатов в эритроцитах крови у здоровых небеременных женщин репродуктивного возраста и у женщин с полиморфизмом гена MTHFR продемонстрировали более высокую эффективность биологически активной формы 5-МТГФ по сравнению с эквимолярной дозой ФК в отношении создаваемого уровня фолатов[18, 20, 21].
Физиологическая потребность в фолатах у взрослых, официально утвержденная в РФ с 2008 г., составляет 400 мкг/сут, верхний допустимый уровень потребления — 1000 мкг/сут. Потребность во второй половине беременности увеличивается на 200 мкг (до 600 мкг/сут), а у кормящих матерей — на 100 мкг, т. е. до 500 мкг/сут[6].
При выборе препаратов ФК для прегравидарной подготовки, беременной и кормящей женщины важно учитывать не только дозы, длительность приема, но и форму фолатов, входящих в их состав, а также инструкцию к препарату. Для профилактики врожденных пороков развития плода большинству женщин рекомендован прием фолатов в физиологических дозировках, предпочтительно в составе поливитаминов, за 4–12 недель до зачатия и в I триместре гестации[18, 19]. По данным многолетних рандомизированных исследований, проведенных в Венгрии среди большой когорты женщин репродуктивного возраста и беременных, поливитамины, содержащие 0,8 мг ФК, более эффективны для профилактики дефектов нервной трубки (ДНТ) плода, чем высокие дозы монопрепарата ФК. Доказано также, что синергидный эффект витаминов группы В (ФК, B2, B6 и B12) повышает профилактическую эффективность витаминно-минерального комплекса[11].
Важность длительного дозозависимого приема препаратов ФК до и после зачатия для значительного снижения риска спонтанных преждевременных родов продемонстрирована в крупном исследовании, проведенном в США и охватившем около 35 тыс. женщин (ОР = 0,22, p = 0,004 для родов на 20–28-й неделе и ОР = 0,45, p = 0,01 для родов на 28–32-й неделе). Самый низкий риск был достигнут у женщин, принимавших добавки ФК более года до зачатия[14].
В 2015 г. опубликованы обновленные данные группы экспертов из Канады по использованию препаратов ФК в комплексе с витаминами/микроэлементами или без них для предотвращения ДНТ и других фолатзависимых врожденных аномалий плода в преконцепции и в период беременности. Женщинам с низким риском ДНТ и других фолатзависимых врожденных аномалий плода рекомендован прием поливитаминов, содержащих 0,4 мг ФК, по крайней мере за 2–3 месяца до зачатия, в течение всей беременности и 4–6 недель после родов или до окончания кормления грудью. Женщинам с умеренным риском ДНТ и других фолатзависимых врожденных аномалий плода следует принимать поливитамины, содержащие 1,0 мг ФК, за 3 месяца до зачатия и до 12 недель гестации. С 12 недель и до конца беременности, а также в течение 4–6 недель после родов или до окончания кормления грудью им рекомендован прием поливитаминов, содержащих 0,4–1,0 мг ФК. И только женщинам с повышенным или высоким риском ДНТ плода (у которых один или более плодов уже имели ДНТ) рекомендуется принимать 4,0 мг ФК по крайней мере за 3 месяца до зачатия и до 12 недель гестации. С 12 недель и до конца беременности, а также в течение 4–6 недель после родов или до окончания кормления грудью они должны принимать поливитамины, содержащие 0,4–1,0 мг ФК[25].
Следует особо отметить, что с позиций клинической фармакологии для компенсации и профилактики дефицита фолатов на популяционном уровне следует использовать физиологические дозы ФК в диапазоне от 400 до 800 мкг/сут, тогда как дозы 1000 мкг/сут и выше не могут быть рекомендованы без консультации врача[2].
С учетом высокого популяционного показателя распространенности полиморфизмов генов MTHFR и проблем, связанных с пониженной активностью этого фермента, последние исследования, посвященные профилактике патологий, обусловленных дефицитом фолатов, стали в большей степени фокусироваться на добавке метафолина, чем на дополнительном назначении традиционных лекарственных форм ФК[15, 18]. В России также появились сведения о том, что при полиморфизме гена MTHFR предпочтителен прием метафолина за 4–8 недель до зачатия, в течение всей беременности и 3–6 месяцев после родов, когда риск тромбофилических осложнений особенно высок.
Биологически активная форма ФК метафолин содержится в препарате Фемибион Наталкер I, предназначенном для прегравидарной подготовки и приема в I триместре беременности. В состав препарата входят две формы фолатов: 200 мкг ФК и 208 мкг метафолина (суммарная доза эквивалентна 400 мкг ФК). Он включает также другие витамины группы В (В1, В2, В5, В6 и В12), витамины С, Е, РР и йод в физиологических дозировках. Фемибион Наталкер II дополнительно содержит рекомендуемое беременным количество докозагексаеновой кислоты (ДГК) — 200 мг[3, 10] и согласно инструкции к препарату предназначен для приема с 13-й недели гестации до конца периода лактации.
Безусловный интерес для акушерства представляют результаты многоцентровых исследований, подтверждающие эффективность применения омега-3-полиненасыщенных жирных кислот (ω3-ПНЖК), особенно ДГК, в схемах лечения и профилактики привычного невынашивания и преждевременных родов, тромбофилических нарушений, ФПН, задержки внутриутробного роста плода. Важным является тот факт, что ω3-ПНЖК (ДГК) выступают в роли синергентов метафолина при гипергомоцистеинемии[3, 10].
В отечественной литературе последних лет появились единичные публикации, обобщающие клинический опыт использования препарата Фемибион Наталкер. Авторами показана эффективность комбинации 200 мкг ФК, 208 мкг метафолина и 200 мг ДГК в составе данного витаминно-минерального комплекса для профилактики аномалий развития плода, предотвращения и коррекции первичной плацентарной недостаточности[5, 9]. Поэтому исследования, посвященные оценке эффективности различных препаратов и дозировок ФК на этапе преконцепции, в рамках прегравидарной подготовки, у беременных и кормящих матерей, особенно в группах высокого акушерского и перинатального риска, представляют большой практический интерес.
Целью данного исследования стал сравнительный анализ течения беременности и перинатальных исходов срочных родов у женщин с полиморфизмами генов фолатного цикла и невынашиванием в анамнезе в зависимости от варианта коррекции фолатного дефицита.
МАТЕРИАЛЫ И МЕТОДЫ
При ретроспективном анализе медицинской документации (формы № 025/у, 111/у, 113/у) женщин с невынашиванием беременности в анамнезе, родивших доношенных детей в 2013–2014 гг., оказалось, что при наличии полиморфизмов генов фолатного цикла врачи ряда женских консультаций г. Саратова стереотипно назначали пациенткам (1-я группа, n = 54) с прегравидарного этапа и до 28 недель беременности монопрепарат или комплекс витаминов группы В, содержащий 5 мг ФК, а также дополнительно 0,8 мг ФК в составе витаминно-минеральных комплексов (всего 5,8 мг ФК в сутки). Для сравнения мы проанализировали течение беременности и перинатальные исходы срочных родов у аналогичных пациенток (2-я группа, n = 60), наблюдавшихся в ГУЗ «Саратовский областной центр охраны здоровья семьи и репродукции» (СОЦОЗСиР). Эти женщины до зачатия и в течение всей беременности получали 208 мкг метафолина и 200 мкг ФК в составе витаминно-минерального комплекса Фемибион Наталкер. Таким образом, две группы женщин были сформированы и стратифицированы в зависимости от видов и дозировок препаратов ФК, которые они получали в преконцепции и во время беременности.
Всего в исследование включили 114 женщин с полиморфизмами генов MTHFR-677C>T, MTHFR-1298A>C, MTRR-66A>G, выявленными методом ПЦР с детекцией продукта амплификации в режиме реального времени на ДНК, полученной из лейкоцитов периферической крови (амплификатор «ДТ prime 5» и комплект реагентов «Генетика метаболизма фолатов» производства ООО «НПО ДНК-Технология», РФ). У подавляющего большинства пациенток имел место полиморфизм гена MTHFR-677C>T (гомозиготная форма — у 23,7%, гетерозиготная — у 57,9%), у остальных 18,4% были выявлены иные полиморфизмы генов фолатного цикла.
Критерием исключения из исследования стало наличие других генетических полиморфизмов, ассоциированных с риском тромбофилии, ожирения, а также хронических заболеваний, требующих постоянной медикаментозной терапии.
В качестве биохимических показателей эффективности использовавшихся препаратов и суточных доз ФК были выбраны уровни гомоцистеина и показатели скрининговой коагулограммы в плазме крови: активированное частичное тромбопластиновое время (АЧТВ), протромбиновое время (ПВ), уровни фибриногена и растворимых фибрин-мономерных комплексов (РФМК), — поскольку их мониторировали у всех пациенток до планирования очередной беременности и в гестационном периоде.
Уровень гомоцистеина определяли на приборе Immulite-1000 (США) с использованием реактивов компании Siemens (США), показатели коагулограммы — на аппарате ACL-200 (IL, США) с использованием реактивов компании Helena Biosciences Europe (АЧТВ, ПВ, фибриноген) и набора реагентов «РФМК-тест» производства НПО «Ренам» (РФ). В исследование были включены только те пациентки, которым биохимические исследования крови и ПЦР-диагностику генетических полиморфизмов проводили в клинико-диагностической лаборатории ГУЗ СОЦОЗСиР (главный врач — к. м. н. Н. П. Смирнова).
Клиническую эффективность использованных в данном исследовании методов профилактики дефицита ФК оценивали путем анализа показателей, характеризующих особенности течения беременности, родов и состояние здоровья новорожденных (в период нахождения в роддоме) у женщин сравниваемых групп.
Статистическую обработку фактического материала выполняли с применением пакета прикладных программ Statistica 6.0 StatSoft. С учетом ограниченной выборки пациенток использовали методы непараметрической статистики. Для непрерывных независимых данных применяли U-критерий Манна — Уитни, для дихотомических независимых показателей — критерий χ2 с поправкой Йетса. Данные в тексте и таблицах для признаков, принимающих непрерывные значения, представлены в виде Me [25; 75], где Me — медиана, [25; 75] — интерквартильный размах. Критический уровень значимости при проверке статистических гипотез принимали равным 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
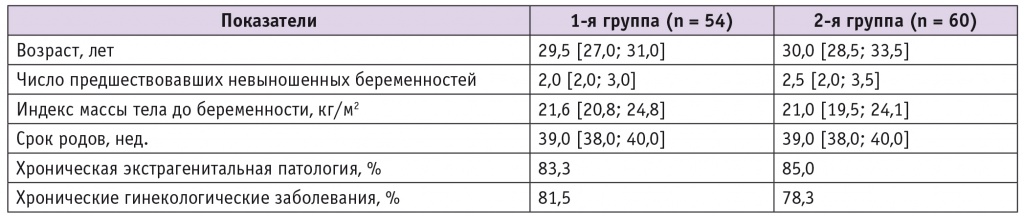
Пациентки обеих групп не различались по средним показателям возраста, ИМТ в прегестационном периоде, числу предшествовавших невыношенных беременностей, сроку родов и частоте хронических заболеваний (табл. 1).
Таблица 1
Характеристика беременных женщин сравниваемых групп
Примечание. Здесь и далее в таблицах:
- 1-я группа — женщины, получавшие прегравидарно и до 28 недель беременности 5,8 мг фолиевой кислоты (ФК) в сутки в виде комбинации монопрепарата, содержащего 5 мг ФК, или комплекса витаминов группы В, в состав которого входят 5 мг ФК, и витаминно-минеральных комплексов, содержащих 800 мкг ФК; 2-я группа — пациентки, получавшие до зачатия и в течение всей беременности витаминно-минеральный комплекс, содержащий 208 мкг метафолина и 200 мкг ФК, а также включающий в себя другие витамины группы В (В1, В2, В5, В6
и В12);
- данные для признаков, принимающих непрерывные значения, представлены в виде Me [25; 75], где Me — медиана, [25; 75] — интерквартильный размах.
На прегравидарном этапе у женщин сравниваемых групп уровни гомоцистеина в плазме крови были в пределах нормы и без статистически значимых различий. Во всех триместрах беременности его концентрации у женщин 1-й группы оказались достоверно выше, чем у пациенток 2-й группы (табл. 2). Настораживает тот факт, что медианы уровней гомоцистеина у пациенток, длительно получавших 5,8 мг синтетической ФК, практически не изменились по сравнению с прегестационным значением (6,9 мкмоль/л) и нарастали от I (6,85 мкмоль/л) ко II (7,65 мкмоль/л) и III (7,73 мкмоль/л) триместрам беременности. По данным одного из зарубежных исследований, практически такой же уровень гомоцистеина в крови (7,9 [1,7–28,2] мкмоль/л) был получен у беременных женщин с преэклампсией, он существенно превышал концентрации в нормотензивной группе беременных (5,9 [1,8–14,6] мкмоль/л)[20].
Таблица 2
Уровни гомоцистеина у обследованных женщин на фоне приема различных форм и доз препаратов фолиевой кислоты, мкмоль/л
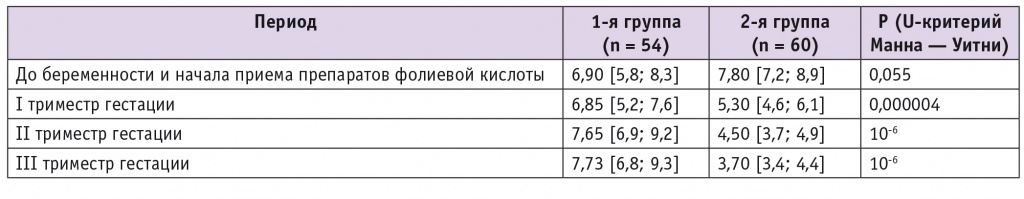
Во 2-й группе беременных, получавших Фемибион Наталкер, напротив, уровень гомоцистеина снижался по сравнению с прегравидарным этапом (7,8 мкмоль/л) в течение всего гестационного периода (с 5,3 мкмоль/л в I триместре до 3,7 мкмоль/л в III триместре). Существенно более низкие значения гомоцистеина у этих женщин можно объяснить длительным приемом метафолина, что позволило обеспечить достаточное присутствие фолатов в тканях независимо от активности ферментных систем. Уровни гомоцистеина у пациенток 2-й группы были сопоставимы с целевыми значениями для женщин с физиологически протекающей беременностью: 5,6 мкмоль/л в I триместре; 4,3 мкмоль/л — во II и 3,3 мкмоль/л — в III триместре.
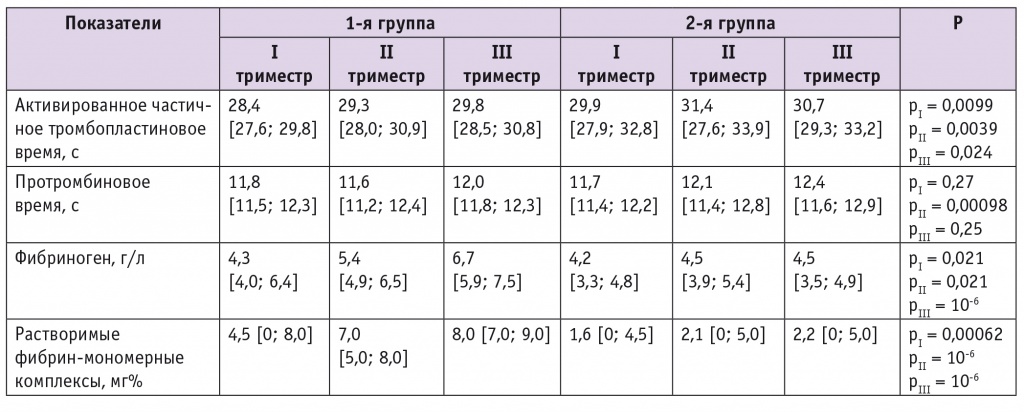
Установлено, что у женщин 1-й группы в течение всей беременности достоверно более высокими были концентрации фибриногена, РФМК в крови, а также имело место статистически значимое укорочение хронометрических показателей коагулограммы (АЧТВ, ПВ), что является свидетельством нарушений в системе гемостаза и указывает на склонность к гиперкоагуляции (табл. 3). Эти изменения гемостазиограммы могли быть обусловлены дефектом фолатного обмена на фоне чрезмерного потребления с фармпрепаратами синтетической ФК, ингибирующей транспорт эндогенных фолатов, более востребованных для нужд организма[2].
Таблица 3
Показатели коагулограммы у обследованных женщин на фоне приема различных форм и доз препаратов фолиевой кислоты
При анализе клинических исходов у женщин сравниваемых групп не было получено значимых различий в частоте таких гестационных осложнений, как угроза прерывания беременности, анемия беременных, что можно объяснить наличием у подавляющего большинства из них нескольких хронических соматических и гинекологических заболеваний. Рвоту беременных регистрировали нечасто, она имела относительно легкое и кратковременное течение, возможно, благодаря приему женщинами обеих групп комплексов витаминов группы В. Более трети пациенток были родоразрешены оперативным путем, большинство из них направляли на плановое кесарево сечение на сроке около 38 недель гестации.
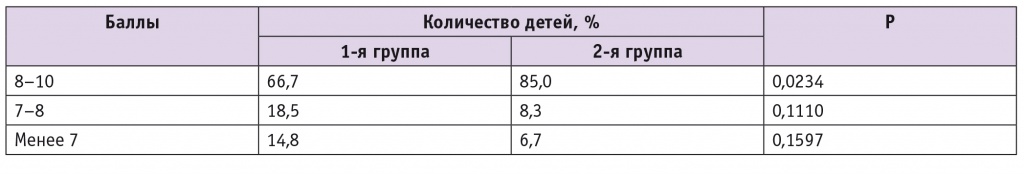
Важным является тот факт, что во 2-й группе в 2,5 раза ниже оказалась частота преэклампсии, в 3,9 раза — ФПН, в 2,7 раза — хронической гипоксии плода, в 1,5 раза — осложнений во время родов, в 2,1 раза — нарушений ранней неонатальной адаптации, в 2,1 раза — заболеваний и патологических состояний у детей в раннем неонатальном периоде (для всех показателей p < 0,05) (табл. 4). Новорожденные от матерей сравниваемых групп не различались по массо-ростовым показателям (p > 0,1). Доля детей от матерей 2-й группы с лучшими показателями по шкале Апгар (8–10 баллов) была статистически значимо выше, чем среди новорожденных от женщин 1-й группы (табл. 5).
Таблица 4
Частота осложнений беременности и родов, нарушений у новорожденных в сравниваемых группах, %
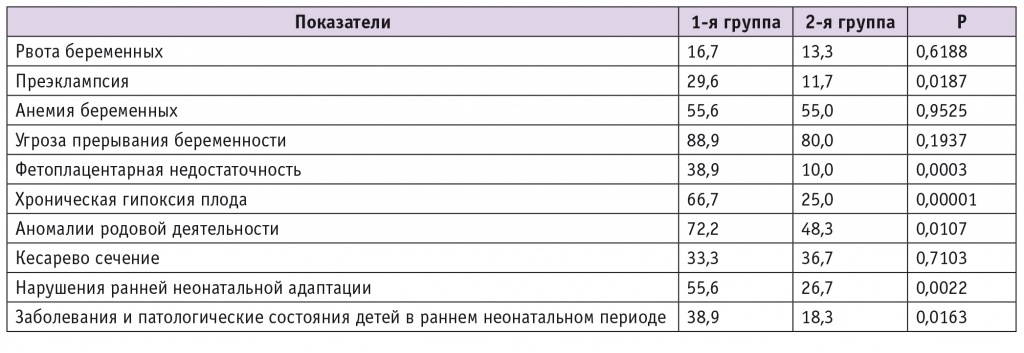
Таблица 5
Показатели по шкале Апгар у новорожденных от матерей из сравниваемых групп
Учитывая данные литературы, можно предположить, что существенно лучшие показатели течения беременности, родов, а также состояния здоровья новорожденных у пациенток 2-й группы были обусловлены не только длительным приемом метафолина, но и дополнительными положительными эффектами потребления оптимального количества ДГК в составе препарата Фемибион Наталкер II со второго триместра гестации[3, 5, 10]. Однако эти предположения требуют дальнейшего изучения.
ЗАКЛЮЧЕНИЕ
У пациенток с полиморфизмами генов фолатного цикла и невынашиванием беременности в анамнезе, которые с прегравидарного этапа и в течение всей беременности получали физиологические дозы двух форм фолатов (208 мкг метафолина и 200 мкг фолиевой кислоты (ФК) в составе витаминно-минерального комплекса Фемибион Наталкер), были статистически значимо ниже уровни гомоцистеина, фибриногена, маркеров тромбинемии (растворимых фибрин-мономерных комплексов) в крови, частота ряда акушерских и перинатальных осложнений (в 1,5–3,9 раза) по сравнению с аналогичными показателями в группе женщин, принимавших комбинацию фармпрепаратов с суммарным содержанием 5,8 мг синтетической ФК.
Таким образом, использование витаминно-минерального комплекса, содержащего активную форму фолатов (метафолин), позволяет улучшить течение беременности и перинатальные исходы срочных родов у женщин с полиморфизмами генов фолатного цикла и невынашиванием в анамнезе.








