ВВЕДЕНИЕ
Понятие «плацента-ассоциированные осложнения» в акушерстве объединяет целый ряд состояний, в основе которых лежат нарушения имплантации и плацентации: задержка роста плода, ранняя преэклампсия (ПЭ), антенатальная гибель плода, неоднократные кровотечения из-за отслойки плаценты, некоторые случаи экстремально ранних и ранних преждевременных родов. Известно, что в большинстве случаев при неустановленной этиологии и нескорректированных нарушениях можно ожидать повторного развития вышеуказанных осложнений. Особенно это относится к женщинам с неоднократными ранними потерями и/или потерями плода во втором триместре беременности.
Синдром задержки роста плода (СЗРП) является одной из ведущих причин заболеваемости и перинатальной смертности. СЗРП определяется как замедление темпов роста плода, приводящее к отклонению его линейных размеров от нормальных значений для данного срока гестации и к массе плода при рождении ниже десятого процентиля для данного срока беременности.
На развитие СЗРП оказывают влияние факторы материнского, фетального или плацентарного происхождения. Наиболее значимые из них — возраст матери, интервал между беременностями, курение, наличие инфекций, нарушение обменной функции плаценты, тромбофилии высокого риска, некоторые экстрагенитальные заболевания, пороки развития плода, хромосомные нарушения[1].
Имеет значение и акушерский анамнез матери. Так, известно, что у женщин с тремя и более выкидышами в анамнезе значимо выше риск развития СЗРП. Кроме того, при физиологической беременности рост и развитие плода протекают под строгим контролем иммунной системы матери, которая с прогрессированием беременности переключается с провоспалительного фенотипа (в первом триместре) на противовоспалительный (в начале второго триместра)[2]. Это позволяет материнскому организму не отторгать полуаллогенный плод, клетки которого содержат отцовские антигены.
В то же время в течение беременности между плодом и материнским организмом существует связь, обусловленная механизмами межклеточной коммуникации и регулирующая нормальное течение беременности. Межклеточная сигнализация состоит из трех основных частей: проксимального элемента (источника сигнальных молекул), транспортного элемента (микровезикулы, экзосомы) и дистального элемента (клеток, принимающих сигнал)[3, 4].
На сегодняшний день микровезикулы рассматриваются исследователями как ключевое звено в парадигме межклеточной коммуникации[4]. Микровезикулы продуцируются большинством типов клеток: представляя собой сферы, образованные липидным бислоем, они содержат набор белков и липидов, а также ДНК, мРНК и некодирующие РНК различных типов. Наличие микровезикул показано практически во всех жидкостях организма — в крови, лимфе, слюне, моче, амниотической жидкости, молоке и др.[5, 6]. Входящие в состав везикул молекулы характерны для типа секретирующих их клеток и полностью сохраняют соответствующую биологическую активность[7, 8]. Это делает секретируемые клетками везикулы объектом пристального внимания исследователей не только в качестве компонента нового типа межклеточного взаимодействия и регуляции, но и в качестве потенциальных биомаркеров, отражающих клеточные процессы, происходящие в организме, в том числе и при патологических состояниях[9, 10].
Характерной чертой микровезикул является их небольшой размер — от 100 до 1000 нм. Микровезикулы образуются посредством выпячивания плазматической мембраны и содержат в своем составе элементы цитозоля секретирующих их клеток, а также ферменты и транскрипционные факторы. Такой характер биогенеза микровезикул обусловливает тот факт, что молекулярный состав их содержимого и набор белков, встроенных в их мембраны, напрямую зависят от степени представленности этих молекул в цитоплазме и плазматической мембране клетки-донора на момент формирования микровезикулы[11, 12].
После достижения клетки-мишени и слияния с ней, опосредованного специальной системой рецепции, содержимое микровезикул может оказывать влияние на трансляционную активность клеток-мишеней, контролируя их метаболизм и такие важные для поддержания тканевого гомеостаза процессы, как пролиферация, апоптоз, ангиогенез и другие[13].
В ряде работ показано, что количество и состав микровезикул крови при той или иной патологии весьма специфичны. Некоторые авторы продемонстрировали, что уровень циркулирующих в материнском кровотоке микровезикул увеличивается со сроком гестации. Таким образом, характеристика состава микровезикул важна для понимания механизмов межклеточной коммуникации в системе «мать — плод» и вышеописанных процессов в плаценте, обеспечивающих ее функциональную состоятельность.
Ранее нами обнаружено, что изменение уровенй митохондриальных белков в плазме крови беременных свидетельствует о наличии вариантов взаимодействия провоспалительных факторов митохондриального происхождения (ПФМП) в патогенезе привычного выкидыша и экстремально ранних преждевременных родов[14, 15]. Установлено развитие избыточной воспалительной реакции, препятствующей нормальной инвазии трофобласта и вызывающей осложнения беременности[16, 17].
В связи с этим цель нашего исследования — выявление взаимосвязи между содержанием сигнальных белковых последовательностей митохондриального происхождения в микровезикулах крови беременных и последующим развитием СЗРП, маловесного плода, ПЭ или нормальными массо-ростовыми показателями плодов и новорожденных.
МАТЕРИАЛЫ И МЕТОДЫ
В проспективном сравнительном исследовании основную группу составили беременные женщины (начиная со срока 24 недели) с измененными данными доплерометрии (снижением показателей фето-плацентарного и/или маточно-плацентарного кровотока) и/или уменьшением фетометрических показателей при УЗИ. У всех пациенток основной группы в анамнезе отмечены плацента-ассоциированные осложнения в течение предыдущих беременностей — СЗРП, ПЭ, антенатальная гибель плода, преждевременные роды, обусловленные дистрессом плода.
Критериями исключения из основной группы были ранняя ПЭ на момент исследования, тяжелые экстрагенитальные заболевания, системные заболевания соединительной ткани, резус-сенсибилизация.
Группу контроля (группу «норма») составили 20 беременных с неотягощенным акушерским анамнезом, физиологическим течением беременности и нормальными показателями ультразвуковой фетометрии и доплерометрии в сроке 24 недели беременности.
У женщин обеих групп проводились заборы периферической крови с интервалом 4 недели до момента родоразрешения.
Согласно критериям включения и исключения, в основную группу отобраны 96 беременных. Ввиду различий клинико-патогенетических осложнений, течения и исходов беременности после родоразрешения основная группа была разделена на 4 подгруппы: в подгруппу IА входили 32 пациентки, беременность которых осложнилась СЗРП, подгруппа IБ состояла из 20 пациенток, у которых к манифестации СЗРП присоединилась ПЭ, в подгруппу IВ вошли 24 беременные, у которых родились маловесные к сроку гестации дети, подгруппу IГ составили 20 беременных с плацента-ассоциированными осложнениями в анамнезе и аномальными показателями доплерометрии, масса и рост детей которых после рождения не отличались от нормативных значений. Итого в исследовании приняли участие 116 пациенток — 96 женщин основной группы и 20 женщин группы контроля.
Наблюдение и родоразрешение пациенток проводились в ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России в 2019–2022 гг. Все беременные основной группы получали терапию низкомолекулярными гепаринами подкожно в профилактической дозе и ацетилсалициловую кислоту при установленном высоком риске ПЭ по результату комбинированного скрининга первого триместра.
Образцы плазмы крови собирали на базе в ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России в соответствии с рекомендациями и требованиями этического комитета. Все пациентки подписали добровольное информированное согласие на забор биологического материала.
Микровезикулы выделяли из плазмы крови методом дифференциального центрифугирования: кровь центрифугировали при 2000 g в течение 15 мин при температуре +4°С для осаждения клеток и клеточного дебриса на центрифуге ELMI (Эстония), супернатант центрифугировали при 100 000 g в течение 30 мин при температуре +4°С на центрифуге Optima L7 (Beckman Coulter, США).
Получившийся осадок, содержащий фракцию микровезикул, дважды промывали переосаждением при тех же условиях в фосфатно-солевом буфере. В пробе измеряли концентрацию белка методом с бицинхониновой кислотой в соответствии с рекомендациями производителя (Pierce, США). Методом вестерн-блот при помощи первичных моноклональных антител и вторичных антивидовых антител, конъюгированных с пероксидазой хрена, и детекции хемилюминесценции на приборе ChemiDoc (Bio-Rad, США) в микровезикулярной фракции плазмы пациенток с СЗРП и женщин с физиологической беременностью на сроках 25, 29, 33 и 37 недель проведен сравнительный анализ относительного содержания следующих белков: белка внешней мембраны митохондрий (VDAC1), активатора транскрипции и репликации митохондриальной ДНК (TFAM), белка слияния внешних мембран митохондрий (MFN2), а также белка TAZ, отвечающего за ремоделирование кардиолипина при его окислительном повреждении.
Нормирование сигнала проводили на общее содержание белка в пробе, полученные данные обработаны при помощи программ Statisics for Windows v8.0 и Prism 8.0 (Graph Pad, США). Данные представляли в виде среднего со стандартной ошибкой среднего. Статистически значимыми различия считали при значении р < 0,05 в соответствии с многомерным обобщенным критерием Краскелла — Уоллиса.
РЕЗУЛЬТАТЫ
В течение беременности нами проанализированы показатели пренатального скрининга, осложнения по триместрам, фетометрические, доплерометрические параметры, клиническое состояние беременных и родильниц, состояние новорожденных.
Осложнения ранних сроков беременности приведены в таблице 1.
Таблица 1
Осложнения ранних сроков беременности у пациенток исследуемых групп, n (%)
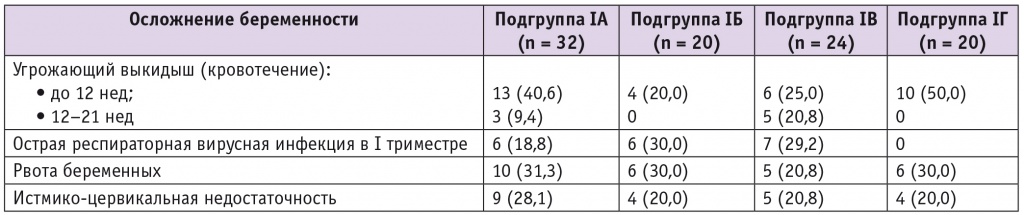
Как следует из представленных данных, в подгруппе с СЗРП чаще, чем в при СЗРП + ПЭ, отмечались кровотечения в первом и начале второго триместра беременности. В целом угрожающий выкидыш первого триместра был частым осложнением во всех подгруппах основной группы.
ОРВИ в первом триместре перенесли всего около 20% пациенток, что также могло быть одним из факторов воспалительных изменений и плацентарной недостаточности. В частоте таких осложнений, как рвота беременных и истмико-цервикальная недостаточность, не зафиксированы значимые различия между подгруппами.
По результатам комбинированного скрининга первого триместра, высокий риск СЗРП и ПЭ зафиксирован у 13 (40,6%) женщин подгруппы IА, 8 (40%) из подгруппы IБ, 5 (20,8%) из подгруппы IВ и 10 (50%) из подгруппы IГ. Из представленных данных следует, что более чем у половины женщин с последующим развитием СЗРП и ПЭ не был выявлен высокий риск этих состояний в ходе скрининга первого триместра, тогда как у женщин с последующим рождением ребенка нормальной массы на фоне проводимой антикоагулянтной и антиагрегантной терапии в 50% случаев такой риск был установлен в 12 недель беременности.
Полученные данные указывают на недостаточную чувствительность скрининга первого триместра и диктуют необходимость дальнейших исследований для поиска информативных предикторов акушерских осложнений.
Первые проявления нарушения кровотока в маточных артериях зафиксированы у всех женщин исследуемых подгрупп в сроке 24 недели беременности (критерий включения в основную группу), при этом в сочетании с нарушением кровотока в артерии пуповины — у 20 (62,5%) подгруппе в IА, у 4 (20,0%) в подгруппе IБ, в остальных подгруппах фето-плацентарный кровоток во втором триместре не был нарушен.
Маловодие обнаружено в подгруппе IА у 10 (31,3%) беременных, в подгруппе IБ — у 14 (70%), в подгруппе IВ — у 4 (20,0%), в подгруппе IГ маловодие отсутствовало.
Ранняя форма СЗРП в подгруппе IА установлена у 22 (68,7%) женщин, при этом самое раннее проявление, по результатам УЗИ, отмечено в 21 неделю беременности. Поздняя форма СЗРП выявлена у 10 (31,3%) женщин, а позднее проявление СЗРП наблюдалось в сроке 35 недель, кроме того, отмечалась манифестация СЗРП в подгруппе IБ на сроке 33 недели.
Содержание митохондриальных белков в микровезикулах крови, полученное методом вестерн-блот, проанализировано в динамике беременности у пациенток исследуемых групп начиная со срока 24 недели с интервалом 4 недели до родоразрешения.
На первом этапе в микровезикулах плазмы в зависимости от срока гестации в группах меняелся уровень митохондриального белка VDAC1, что говорит об общем изменении содержания фрагментов митохондрий в экскретируемых мембранных частицах (табл. 2). Далее для выравнивания содержания митохондриальных белков полученные данные по уровню VDAC1 в микровезикулах использовали в качестве нормировочного параметра для белков митохондриального биогенеза и TAZ.
Таблица 2
Относительное содержание белка VDAC1 в микровезикулах крови беременных, у. е.
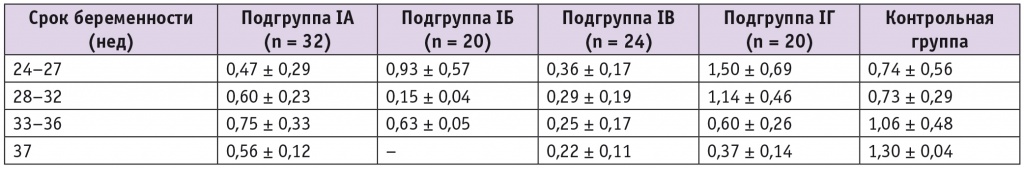
Примечание. Здесь и в таблицах 3–5: в подгруппе синдрома задержки роста плода и преэклампсии, как правило, родоразрешение проведено в сроке до 37 недель из-за ухудшения состояния беременной и плода.
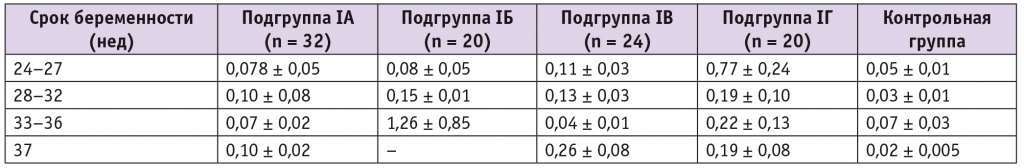
Данные по концентрациям в микровезикулах крови белков OPA1 и DRP1, отвечающих за митохондриальный биогенез, представлены в таблицах 3, 4.
Таблица 3
Относительное содержание белка OPA1 в микровезикулах плазмы крови беременных, у. е.
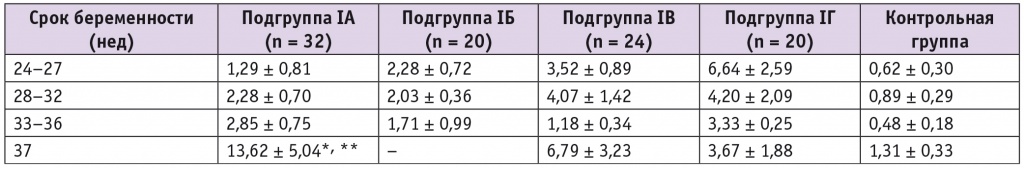
* Отличие от показателя в 24–27 недель статистически значимо: р < 0,05 (критерий Краскелла — Уоллиса).
** Отличие от показателя контрольной группы в 37 недель статистически значимо: р = 0,0078 (критерий Краскелла — Уоллиса).
Таблица 4
Относительное содержание белка DRP1 в микровезикулах плазмы крови беременных, у. е.
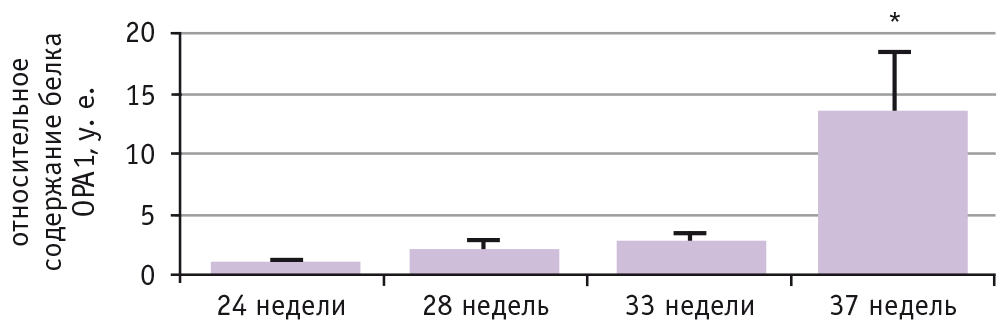
Примечательным является тот факт, что содержание белка OPA1 только в группе СЗРП значимо увеличилось к 37 неделе (рис. 1).
Рис. 1. Относительное содержание белка ОРА1 в микровезикулах плазмы крови беременных с синдромом задержки роста плода в период с 24 по 37 недель беременности. Данные представлены в виде среднего со стандартной ошибкой среднего.
* Р < 0,05 (критерий Краскелла — Уоллиса)
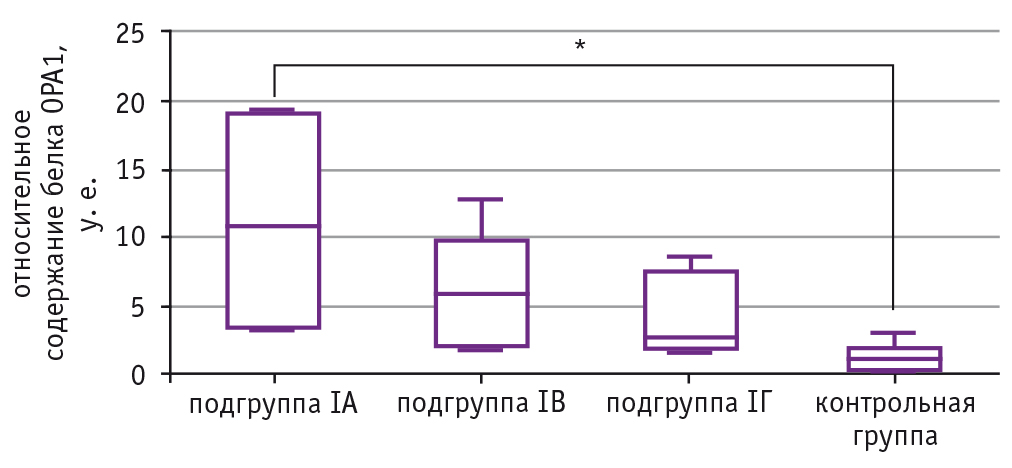
На рисунке 2 наглядно прослеживается изменение уровня белка OPA1 на сроке 37 недель во всех исследуемых подгруппах и при неосложненной беременности. В сроке 37 недель в подгруппе СЗРП концентрация белка OPA1 была значимо выше, чем при физиологической беременности (р = 0,0078). Ожидаемым являлся тот факт, что в подгруппе, в которой на фоне СЗРП развилась ПЭ, как правило, родоразрешение проведено в сроке до 37 недель ввиду ухудшения состояния беременной и плода. У женщин, у которых родились дети с малой и нормальной массой, значимые отличия от нормы отсутствовали.
Рис. 2. Относительное содержание белка ОРА1 в микровезикулах плазмы крови беременных с плацента-ассоциированными патологиями и в норме на 37 неделе гестации. Данные представлены в виде медиан с интерквартильным размахом.
* Р = 0,0078 (критерий Краскелла — Уоллиса)
По результатам проведенных измерений и нормировки на содержание белка VDAC1, можно констатировать, что уровни белка DRP1 в микровезикулярной фракции крови беременных исследуемых групп значимо не различались.
Можно предположить, что, в отличие от нормы, в группе СЗРП на разных сроках гестации, в том числе на сроке 37 недель, сигнал о слиянии митохондрий преобладает над сигналом о делении митохондриального ретикулума, что отражает необходимость компенсации энергодефицитного состояния, связанного с низким качеством митохондрий при плацентарной недостаточности.
Данные по содержанию белка TAZ, отвечающего за сохранность ключевого липида митохондрий кардиолипина, в микровезикулах крови беременных представлены в таблице 5. Анализ полученных данных выявил значимые различия в 33–36 недель гестации.
Таблица 5
Относительное содержание белка TAZ в микровезикулах пациенток с плацента-ассоциированными осложнениями и при неосложненной беременности, у. е.
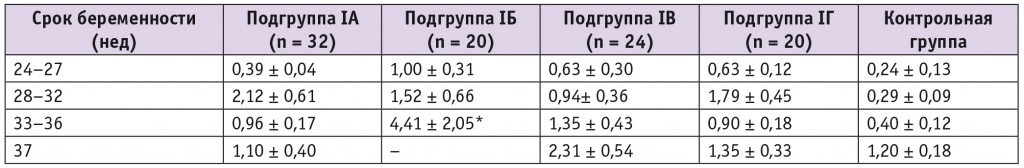
* Отличия от подгрупп IА, IГ и контрольной группы статистически значимы (р < 0,05).
В подгруппе IБ (СЗРП + ПЭ) концентрация TAZ оказалась значимо выше, чем в подгруппе СЗРП, у женщин, родивших детей с нормальной массой, и в контрольной группе (во всех случаях р < 0 ,05). Между пациентками с СЗРП + ПЭ и женщинами, у которых родились маловесные дети, значимые различия отсутствовали.
ОБСУЖДЕНИЕ
Известно, что при окислительном стрессе, воспалении, а также некрозе происходит активное повреждение тканей и в кровоток высвобождаются внутриклеточные структуры, обладающие выраженным провоспалительным действием. Такие соединения и фрагменты клеток принято называть аларминами (damage-associated molecular patterns, DAMPs). Среди общего пула DAMPs особое место занимают паттерны, ассоциированные с митохондриями, поскольку именно корректное функционирование митохондрий определяет энергетический баланс клеток, а следовательно, и тканей в целом.
Наиболее хорошо изученные митохондриальные DAMPs — митохондриальная ДНК, N-формил пептид, а также микроРНК, связанные с регуляцией активности митохондрий[17].
В отечественной литературе распространение получил термин «провоспалительные факторы митохондриального происхождения». В данной работе мы предположили, что выделяемые в материнский кровоток микровезикулы также могут выполнять роль ПФМП и иметь митохондриальное происхождение. Предполагая, что информация о состоянии митохондрий и эффективности энергетического метаболизма является ключевой в межклеточной коммуникации при беременности, мы проанализировали содержание основных белков, характеризующих биогенез митохондрий, во фракции микровезикул крови у женщин при нормальном течении беременности и на фоне СЗРП.
В продолжение анализа содержания ряда белков митохондрий в ткани плаценты, проведенного на предыдущем этапе исследования, в 2018 году, мы оценивали концентрации белков VDAC1, OPA1, DRP1, TAZ в микровезикулах, выделенных из плазмы крови женщин с плацента-осложненной или физиологической беременностью на разных сроках (аппроксимированных к 25, 29, 33 и 37 неделям)[16, 17]. Перечисленные белки являются ключевыми мембранными и матриксными белками митохондрий, отвечающими за поддержание структурно-функциональной целостности митохондрий, а также участниками сигнального пути, приводящего к активации аутофагии.
Стоит отметить, что белки митохондриального происхождения в настоящий момент активно исследуются во всем мире на предмет их участия в развитии и потенцировании осложнений, связанных с нарушениями биоэнергетического баланса. Служащая признанным примером ПФМП митохондриальная ДНК способна запускать сигнальные каскады, приводящие к активации врожденного иммунитета. В связи с этим все большее распространение получает мнение, что и другие митохондриальные белки могут выступать в этой роли.
СЗРП зачастую становится сопутствующим осложнением при ПЭ. Недавние исследования показали, что секретируемые плацентой в материнский кровоток микровезикулы и митохондриальные DAMPs могут играть роль триггеров системного воспаления и эндотелиальной дисфункции. При ПЭ выявлено значительное увеличение количества циркулирующих в кровотоке микровезикул, а в ткани плаценты обнаружено повышение уровня ПФМП на фоне снижения экспрессии маркеров аутофагии.
Вариантом микроаутофагии является митофагия — процесс селективного удаления из клетки поврежденных митохондрий, при этом именно баланс между скоростью биогенеза митохондрий и митофагии определяет количество митохондрий в клетке, а значит, и ее метаболический статус. В данной части работы нам удалось собрать коллекцию плазмы крови пациенток с нормальным течением беременности и с СЗРП, не сопровождающимся повышением АД и другими симптомами, характерными для ПЭ. Это позволило нам получить представление о возможной роли микровезикул и содержащихся в них митохондриальных маркеров в развитии данного типа осложнений беременности.
На стадии бластоцисты микровезикулы являются важным средством коммуникации между эмбриональными стволовыми клетками, входящими в состав внутренней клеточной массы, и клетками трофэктодермы, они стимулируют миграцию трофобласта и эффективную имплантацию эмбриона[18]. Кроме того, установлено, что во время нормально протекающей беременности клетки синцитиотрофобласта постоянно секретируют микровезикулы, обладающие провоспалительными, иммуноактивирующими и прокоагулянтными свойствами[19].
Продукция микровезикул усиливается в ответ на системный и локальный окислительный стресс при физиологической беременности. Предполагают, что такое мягкое системное воспаление служит фактором, поддерживающим адекватный уровень активации врожденного иммунитета матери на фоне общего подавления системы приобретенного иммунитета.
В то же время при ПЭ показано увеличение количества микровезикул в крови, в том числе микровезикул, секретируемых синцитиотрофобластом[19, 20]. Анализ маркеров, содержащихся в микровезикулах при ПЭ, позволяет предполагать их участие в развитии системной эндотелиальной дисфункции, активации системы свертывания, подавлении ангиогенеза в плаценте, потенцировании окислительного стресса.
Сведения об изменениях секреции микровезикул при СЗРП в литературе единичны, в основном рассматривается задержка роста плода, ассоциированная с ПЭ. Так, например, D. Goswamia и соавт. не выявили увеличение количества микровезикул в крови матери при нормотензивном СЗРП[20].
В рамках данной работы объектом нашего исследования также стала группа женщин с СЗРП на фоне нормонтензии, однако в отличие от D. Goswamia и соавт. мы проанализировали микровезикулы на предмет маркеров митохондриального биогенеза, а не абсолютное количество микровезикул. Преобладание маркера слияния митохондрий OPA1 над маркером деления DRP1 в сроке 37 недель свидетельствует о нарушении системы отбора митохондрий, позволяющем накапливать дисфункциональные митохондрии. В то же время мы наблюдаем соответствующее состоянию окислительного стресса увеличение уровня белка TAZ, отвечающего за поддержание целостности кардиолипина — критично важного липида для выполнения митохондриями функции дыхания и продукции энергии в количестве, адекватном потребностям растущего плода.
ЗАКЛЮЧЕНИЕ
Полученные результаты подтверждают предположение, что при синдроме задержки роста плода по сравнению с состоянием при физиологической беременности наблюдаются изменения в биогенезе и работе системы контроля качества митохондрий, приводящие к энергетической катастрофе, вероятно, имеющей прямое отношение к развитию функциональной несостоятельности плаценты.
Характеристика состава и сравнение профилей белков, содержащихся в микровезикулах в норме и при осложнениях, в динамике беременности, на наш взгляд, являются перспективным подходом, который в будущем позволит малоинвазивным путем осуществлять мониторинг и прогнозирование развития акушерских осложнений.
Поступила: 29.08.2022
Принята к публикации: 26.09.2022








