Интерес к дифференциальной диагностике двух форм акушерского сепсиса обусловлен клиническими критериями сепсиса как системной воспалительной реакции на инвазию микроорганизмов, в которой ведущую роль играют цитокиновый каскад и повреждающее действие экзо и эндотоксинов. Вследствие этих патологических процессов генерализация инфекции приобретает тяжелый и часто необратимый характер, то есть синдром системной воспалительной реакции (systemic inflammatory response syndrome, SIRS) переходит в тяжелую стадию сепсиса или септический шок [1–4].
В ныне действующей МКБ-10 фигурируют три пуэрперальные формы: сепсис во время родов (О75.3), послеродовой сепсис (О85) и инфекция хирургической акушерской раны, или акушерский перитонит (О86.0). Однако клиницисты редко дифференцируют первые две нозологические формы [2]. В заключительном клиническом диагнозе сепсис во время родов трактуют как синдром амниотической инфекции, эндометрит в родах или обозначают общим термином «послеродовой сепсис». Такая же практика распространена при указании первоначальной причины смерти или основного диагноза в патолого-анатомических заключениях [3]. Тем не менее клинические особенности сепсиса во время родов и послеродового сепсиса существенно различаются, особенно на начальном этапе [1–3].
Кроме того, среди патологоанатомов развернулась полемика о правомочности термина «септицемия», о наличии или отсутствии гнойных очагов — морфологических эквивалентов SIRS, о формулировке основного патолого-анатомического диагноза в связи с современными представлениями о сепсисе [2, 5, 6]. Эти проблемы актуальны и в оценке акушерского сепсиса.
Для понимания соответствия этапов SIRS, в частности цитокинового каскада, патоморфологической картине септического процесса необходимы современные иммуногистохимические методы идентификации клеток-продуцентов провоспалительных цитокинов в местах внедрения инфекции (входных воротах сепсиса), регионарных лимфатических узлах и селезенке. Особый интерес представляет иммунногистохимическое выявление ФНО-α — основного провоспалительного медиатора, запускающего инициальные механизмы генерализации инфекции [2, 3].
Цель исследования: обосновать необходимость дифференциации двух основных нозологических форм акушерского сепсиса: септицемии в родах и послеродового сепсиса.
МАТЕРИАЛЫ И МЕТОДЫ
Работа выполнена на базе ФГБНУ «Научно-исследовательский институт морфологии человека» г. Москвы в 2008–2010 гг. В работу включены результаты клиникоморфологического исследования 13 наблюдений материнской смерти (вследствие акушерского сепсиса: 6 умерших от сепсиса во время родов, 7 — от послеродового сепсиса). Изучены данные акушерского анамнеза, особенности течения родов (преждевременный разрыв плодных оболочек, длительность безводного периода, первичная слабость родовой деятельности и использование утеротоников, плотное прикрепление плаценты, самостоятельные роды или оперативное родоразрешение), перинатальные исходы, начало и длительность клинической картины. Проанализированы заключительный клинический и патолого-анатомический диагнозы, макроскопические и микроскопические изменения, данные бактериологического исследования.
При аутопсии для бактериологического исследования проводили забор крови из полостей сердца в асептических условиях. При микробиологическом исследовании определяли видовой и количественный состав всех ассоциантов микроценоза изучаемых образцов.
Бактериологическое исследование проводили с применением набора стандартных питательных сред. Для отбора и транспортировки исследуемых образцов использовали набор для забора и транспортировки аэробных и анаэробных бактерий Portagerm Amies Agar + Swab фирмы bioMerieux (Франция). К моменту доставки материала в лабораторию готовили питательные среды.
Образцы тканей заливали в парафин. Серийные срезы толщиной 3 мкм изготавливали на микротоме (MR 2055, Leiсa, Германия).
Полученные срезы окрашивали гематоксилином и эозином, ставили PAS-реакцию; соединительную ткань выявляли методом окраски по Массону.
Для иммуногистохимического исследования использовали парафиновые срезы толщиной 3 мкм. Иммунореактивность первичных антител фирмы Dako (Дания) обнаруживали с помощью вторичных антител, конъюгированных с пероксидазной системой, составляющих набор реактивов En Vision TM + System, и систему визуализации фирмы Dako.
Гранулоциты выявляли с помощью поликлональных антител Myeloperoxidase, макрофаги — моноклонального антитела CD68 (клон KP1), плазматические клетки — моноклонального антитела Plasma cell (клон VS38c), Тлимфоциты — моноклонального антитела CD45RO (клон OPD4), Влимфоциты — моноклонального антитела CD20 (клон L26) производства фирмы Dako. Для определения ФНОα взяты первичные антитела клона E8G6 фирмы Santa Cruz (США). Срезы докрашивали гематоксилином Майера.
При интерпретации результатов распределения продуктов иммуногистохимической реакции учитывали локализацию и интенсивность окрашивания, которую оценивали при 200-кратном увеличении в баллах по следующим критериям:
- – — реакция отсутствует;
- + — 1 балл (слабая реакция в 2–5 клетках);
- ++ — 2 балла (умеренная реакция в 5–10 клетках);
- +++ — 3 балла (выраженная реакция более чем в 10 клетках) [3].
Для статистической обработки данных использовали пакет программного обеспечения Statistica 6.0. Бинарные данные сравнивали с помощью точного критерия χ2 с общепринятыми уровнями значимости: p < 0,05; p < 0,01 и p < 0,001.
РЕЗУЛЬТАТЫ
Как показало исследование анамнеза и клинических данных, среди родильниц, умерших от сепсиса в родах, преобладали повторнородящие в возрасте 20–30 лет, имевшие в анамнезе не менее 3 беременностей и родов (66,6%). В подавляющем большинстве случаев зарегистрированы самостоятельные роды (83,3%) с преждевременным разрывом плодных оболочек и длительностью безводного периода 25–35 часов. Более чем у половины (66,6%) родильниц выполнены ручное отделение плаценты и последующее выскабливание полости матки. Начало развития симптомов сепсиса в 1-е сутки после родов наблюдали у 66,6% умерших.
Сроки гибели родильниц в среднем составляли 2,5 ± 0,8 суток от начала клинических проявлений. Бактериально-токсический шок и синдром диссеминированного внутрисосудистого свертывания (ДВС) диагностировали при всех летальных исходах. Экстирпация матки была выполнена лишь одной пациентке (16,7%). Ни одна из женщин, умерших от сепсиса в родах, не была переведена в многопрофильный стационар. При этой нозологической форме сепсиса в структуре перинатальных потерь, составивших 83,3%, преобладала антенатальная гибель (80,0%).
Септицемия подтверждена исследованиями крови из полости сердца, выполненными у 83,3% умерших женщин. Данные аутопсии (обнаружение хориоамнионита, децидуита и плацентита на фоне относительной интактности эндо- и миометрия), а также структура перинатальных потерь свидетельствовали о том, что входными воротами инфекции для организма матери стали компоненты последа. Это подтверждала иммуногистохимическая визуализация клеток, продуцирующих ФНО-α.
При клинико-статистическом анализе выявлены принципиальные отличия послеродового сепсиса от описанной выше нозологической формы. Умершие от послеродового сепсиса были моложе (до 20 лет — 85,7%, χ2 = 6,964, p < 0,05). Большинство были первобеременными, первородящими (85,7%, χ2 = 6,198, p < 0,05). Кроме того, существенное отличие от сепсиса во время родов состояло в преобладании затяжных родов с первичной слабостью родовой деятельности, повторной родостимуляцией (85,7%, χ2 = 6,198, p < 0,05). Дородовое излитие околоплодных вод с длительным безводным промежутком, чаще наблюдаемое при сепсисе в родах (66,7%), при послеродовом сепсисе не отмечено (χ2 = 6,741, p < 0,05).
В отличие от сепсиса в родах, при котором у большинства умерших роды были самостоятельными, при послеродовом сепсисе оперативным путем были родоразрешены 71,4% пациенток (χ2 = 3,899, p < 0,05). Исходы беременности и родов для плода у этих женщин статистически значимо чаще были благоприятными (85,7%, χ2 = 6,198, p < 0,05).
Отличия данной нозологической формы от сепсиса в родах также определялись анамнестическими сведениями о хронических экстрагенитальных (пиелонефрите — 71,4%, χ2 = 3,899, p < 0,05) и хронических воспалительных гинекологических заболеваниях (сальпингооофорите, цервиците, кольпите — 85,7%, χ2 = 6,198, p < 0,05 для всех трех заболеваний).
На принципиальные различия исследуемых форм акушерского сепсиса указывают и сроки возникновения клинической картины: у большинства пациенток с послеродовым сепсисом (85,7%) симптомы развивались существенно позже, чем у умерших от сепсиса во время родов (χ2 = 6,741, p < 0,05). На 4-е сутки после родоразрешения умерли 28,6%, на 5-е — 42,8%, на 8–13-е сутки — 28,6% женщин. Более тяжелый и длительный характер послеродового сепсиса у этих родильниц сопровождался морфологическими признаками септического шока (100%), нарушениями гемокоагуляции в виде синдрома ДВС, сменяемого гипокоагуляцией и фибринолизом (100%).
В отличие от сепсиса в родах при данной форме акушерского сепсиса большинству родильниц выполнена экстирпация матки с придатками (71,4%, χ2 = 6,964, p < 0,05). Однако ее сроки во всех случаях были запоздалыми: 4–5-е сутки послеродового периода.
В последах женщин, умерших от послеродового сепсиса, существенных воспалительных изменений, бактериальной микрофлоры и клеток воспаления не было (χ2 = 13,00, p < 0,05 для сравнения с умершими от сепсиса во время родов). Наиболее выраженные воспалительные изменения обнаружены в матках, в которых диагностирована типичная картина эндомиометрита, заключавшаяся в диффузной воспалительной инфильтрации остатков децидуальной ткани эндометрия и ее распространении по соединительнотканной строме между пучками прилежащего миометрия. Кроме того, при аутопсиях и микроскопическом исследовании органов у 74,1% пациенток (χ2 = 6,964, p < 0,05) находили вторичные пиемические очаги: микроабсцессы в легких, почках, печени и ткани головного мозга, а также признаки синдрома ДВС, инфекционнотоксического шока и полиорганной недостаточности — компонентов III этапа SIRS. Бактериологическое исследование крови из полостей сердца и тканей матки обнаружило стафилококки, стрептококки, грибы рода Candida, неклостридиальные анаэробные микроорганизмы.
Представленные ниже клинические примеры наглядно демонстрируют описанные клиникостатистические особенности, морфологические и иммуногистохимические признаки двух форм акушерского сепсиса, вызывающие необходимость их четкой и своевременной дифференцировки.
Пример 1. Пациентка К., 16 лет, 18.03.2008 г. доставлена бригадой скорой помощи в больницу скорой медицинской помощи с жалобами на повышение АД до 180/100 мм рт. ст., головную боль, схваткообразные боли внизу живота, с целыми околоплодными водами, в сроке беременности 31–32 недели.
Данная беременность — 1-я, нежеланная; на учете в женской консультации не состояла. Со слов женщины, первая половина беременности протекала без осложнений. Во второй половине отмечала эпизоды повышения АД, незначительную пастозность нижних конечностей. Отсутствие шевеления плода заметила 17.03.2008 г.
Диагностирована антенатальная гибель плода. Развился приступ эклампсии, пациентка потеряла сознание. Выполнено экстренное родоразрешение путем кесарева сечения. Околоплодные воды мутные, желтоватые. Извлечена мертворожденная девочка массой 1150,0 г, длиной 39 см. Дренирована брюшная полость.
После извлечения плода состояние родильницы резко ухудшилось, АД снизилось до 70/20 мм рт. ст. Отделение частично плотно прикрепленной плаценты сопровождалось маточным кровотечением. Проведено выскабливание полости матки. Брюшная полость дренирована. В послеоперационном периоде проводили реанимационные мероприятия, переливание препаратов крови и свежезамороженной плазмы крови, вводили антибиотики. Несмотря на реанимационные мероприятия, 18.03.2008 г. в 22:40 зарегистрирована остановка сердечной деятельности, в 23:00 констатирована биологическая смерть родильницы.
Заключительный клинический диагноз
Основное заболевание: Септицемия во время 1-х преждевременных родов (в сроке 31–32 недели) при 1-й беременности.
Операция: Экстренное кесарево сечение (18.03.2008 г.).
Осложнения: Инфекционно-токсический шок. Маточное кровотечение.
Операции: Выскабливание полости матки, дренирование брюшной полости (18.03.2008 г.).
Сопутствующее заболевание: Хронический пиелонефрит.
Патология плода и последа: Антенатальная гибель плода. Частичное плотное прикрепление нормально расположенной плаценты.
Результаты посмертного бактериологического исследования подтвердили септицемию, вызванную кокковой грамположительной (стрептококковой) микрофлорой и неклостридиальными анаэробными микроорганизмами. Во внутренних органах найдены признаки инфекционно-токсического шока: эритроцитарные, гиалиновые тромбы в сосудах микроциркуляторного русла, периваскулярные кровоизлияния, сладжи эритроцитов в капиллярах межальвеолярных перегородок легких, дистелектазы и отек легких, некротический нефроз, дистрофические изменения паренхиматозных органов, а также респираторный дистресс-синдром взрослых и остановка сердечной деятельности.
При гистологическом исследовании обнаружены входные ворота инфекционного процесса — компоненты последа, в которых констатирован максимальный объем воспалительных изменений в виде массивной лейкоцитарной инфильтрации плодных оболочек (децидуита), базальной пластинки плаценты и между ее ворсин (интервиллузита и инфицированных тромбов), что свидетельствовало о гематогенном пути инфицирования организма матери (рис. 1А).
Рис. 1. Септицемия в родах: А — послед с массивной лимфоцитарной инфильтрацией плодных оболочек и интервиллезного пространства (окраска гематоксилином и эозином, 100-кратное увеличение); Б — минимальные воспалительные изменения на границе эндо- и миометрия (окраска гематоксилином и эозином, 640-кратное увеличение). Здесь и далее в статье фото авторов
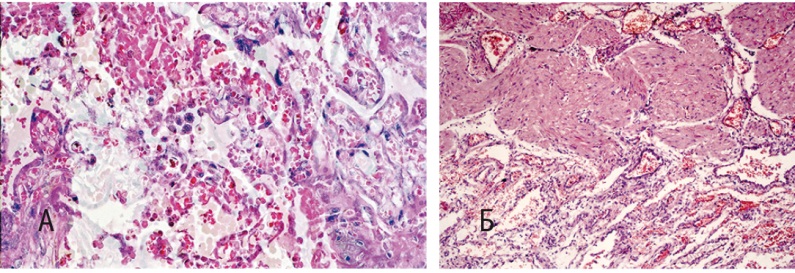
Прицельное исследование матки (эндо- и миометрия) выявило начальную миграцию лимфоцитов и сегментоядерных лейкоцитов лишь на поверхности эндометрия (рис. 1Б), соответствующую физиологическому притоку воспалительных клеток в зону некроза, то есть к месту родившейся плаценты.
Иммуногистохимическая верификация клеток воспаления подтвердила наиболее раннее и объемное поражение плодных оболочек и ворсин плаценты. Воспалительный инфильтрат плодных оболочек (рис. 2–4) был представлен большим количеством гранулоцитов, плазматических клеток и макрофагов, а также единичными Т-лимфоцитами. Положительная реакция на ФНО-α отмечалась во всех клетках. При макро- и микроскопическом исследовании органов вторичные пиемические очаги не найдены. Преобладали интерстициальные воспалительные изменения, проявления синдрома ДВС и инфекционнотоксического шока.
Рис. 2. Плодные оболочки: А — диффузно-очаговая инфильтрация компактного слоя сегментоядерными лейкоцитами, лимфоцитами и макрофагами (окраска гематоксилином и эозином, 1000-кратное увеличение); Б — положительная реакция на миелопероксидазу (указана стрелками) гранулоцитов в составе слоя цитотрофобласта
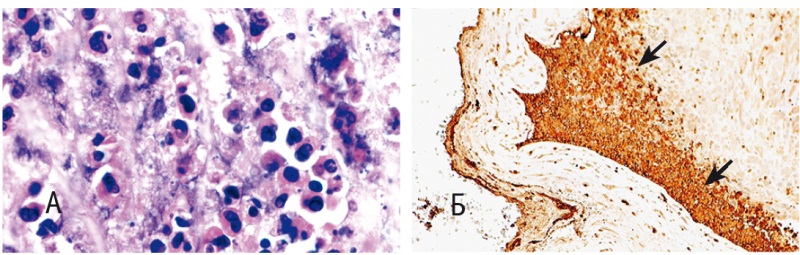
Рис. 3. Плодные оболочки: А — СD68+ макрофаги (указаны стрелкой), сконцентрированные в слое цитотрофобласта и децидуальной части (100-кратное увеличение); Б — плазматические клетки, представленные главным образом в децидуальной части (100-кратное увеличение) и децидуальной части (100-кратное увеличение)
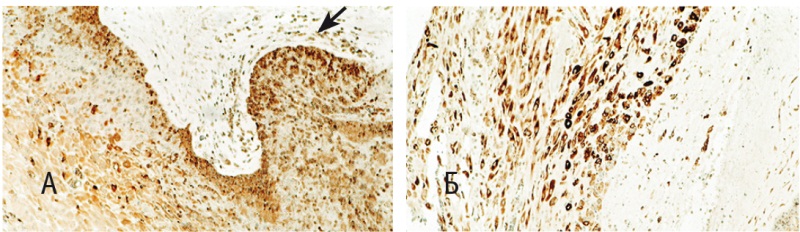
Рис. 4. Плодные оболочки: А — единичные клетки с позитивной реакцией на фактор некроза опухоли α (указаны стрелкой) в компактном слое плодных оболочек (400-кратное увеличение); Б — макрофаг (указан стрелкой) с положительной реакцией на фактор некроза опухоли α (1000-кратное увеличение)
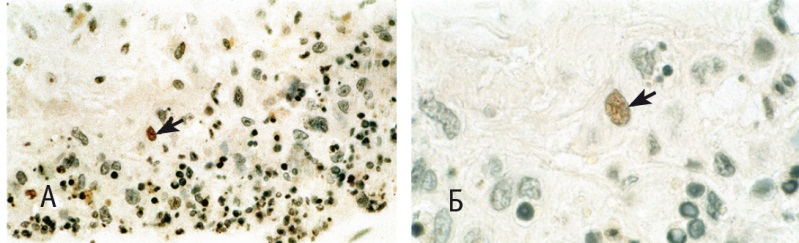
Патологоанатомический диагноз
Основное заболевание: Сепсис во время 1-х преждевременных родов (в сроке 31–32 недели) при 1-й беременности: обострение хронического эндомиометрита, цервицита; диффузный гнойный хориоамнионит, интервиллезит, виллузит, вызванный грамположительными микрококками и неклостридиальными анаэробными микроорганизмами (бактериологическое исследование № 23 от 18.03.2008 г.).
Операция: Экстренное кесарево сечение (18.03.2008 г.).
Осложнения: Инфекционно-токсический шок: эритроцитарные и фибриновые тромбы в сосудах микроциркуляторного русла, периваскулярные кровоизлияния, сладжи эритроцитов в капиллярах межальвеолярных перегородок легких, дистелектазы и отек легких, некротический нефроз, дистрофические изменения паренхиматозных органов. Гиперплазия костного мозга, гиперплазия и миелоидная метаплазия селезенки и лимфатических узлов, межуточный гепатит. Маточное кровотечение.
Операции: Выскабливание полости матки, дренирование брюшной полости (18.03.2008 г.).
Сопутствующее заболевание: Хронический пиелонефрит.
Патология плода и последа: Антенатальная гибель плода. Частичное плотное прикрепление нормально расположенной плаценты.
Пример 2. У женщины Д., 17 лет, 1-я беременность протекала на фоне хронического пиелонефрита. С 32 недель отмечала повышение АД до 150/90 мм рт. ст., анемию, отеки. 25.02.2009 г. в сроке 37 недель АД повысилось до 180/100 мм рт. ст. С приема в женской консультации госпитализирована в акушерский стационар, где было выполнено кесарево сечение. Извлечен живой новорожденный массой 3100 г. Ранний послеоперационный период протекал благополучно, женщина была выписана из стационара. Внезапно 02.03.2009 г. состояние резко ухудшилось, родильница потеряла сознание, развились признаки острой дыхательной и сердечно-сосудистой недостаточности. Женщина экстренно госпитализирована в анестезиологическореанимационное отделение. Проведены интубация трахеи, ИВЛ, пункция и катетеризация подключичной вены справа. По результатам общего анализа крови при поступлении, лейкоцитоз — до 20,0 × 109, палочкоядерные лейкоциты — 24%. По результатам общего анализа мочи, протеинурия 0,033%, лейкоциты — до 18 в поле зрения, эритроциты — до 24 в поле зрения. Интенсивная реанимационная терапия, проводимая в течение 3 часов, оказалась безуспешной. Родильница умерла на 9-е сутки послеродового периода.
Заключительный клинический диагноз
Основное заболевание: Послеродовой сепсис после 1-х оперативных преждевременных родов в сроке 37 недель беременности.
Операция 1: Экстренное кесарево сечение (25.02.2009 г.).
Осложнения основного заболевания: Бактериально-токсический шок. Синдром ДВС.
Операция 2: Пункция и катетеризация подключичной вены справа (02.03.2009 г.).
Реанимационные мероприятия: ИВЛ, инфузионно-трансфузионная терапия.
Фоновые заболевания: Хронический пиелонефрит. Анемия I степени.
В отличие от предыдущего клинического случая (септицемии в родах) начало септического процесса регистрировали в послеродовом периоде на 6-е сутки после оперативного родоразрешения с последующей быстро прогрессирующей клинической картиной сепсиса. В последе не выявлены воспалительные изменения, что свидетельствовало о послеродовом характере возникновения септического процесса (рис. 5А). По данным микроскопического исследования, наибольший объем воспалительного поражения вызван диффузным эндомиометритом с расслаивающими кровоизлияниями (рис. 5Б). Результаты микроскопического исследования матки при данной нозологической форме сепсиса принципиально отличались от таковых в случае материнской смерти от септицемии в родах.
Рис. 5. Послеродовый сепсис: А — интактные плодные оболочки (окраска гематоксилином и эозином, 100-кратное увеличение); Б — диффузный эндомиометрит с расслаивающими кровоизлияниями (окраска гематоксилином и эозином, 100- кратное увеличение)
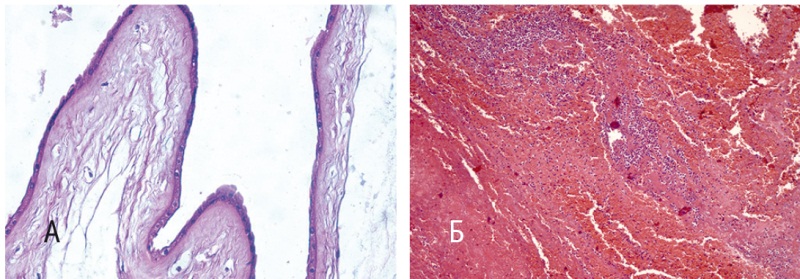
При интактных компонентах последа (см. рис. 5А) выраженную воспалительную инфильтрацию обнаружили в париетальной части (см. рис. 5Б) с переходом в миометрий и просветы оставшихся эндометриальных желез. Главными признаками гнойного эндомиометрита, отличающими его от физиологического воспалительного вала, служили глубина и выраженность инфильтрации. Она выходила за пределы сохранившегося эндометрия, проникала между инволютивными маточно-плацентарными артериями, распространялась далеко в прилежащий миометрий, главным образом по отечным межмышечным прослойкам.
Иммуногистохимическая верификация клеток воспаления в составе париетального эндометрия и плацентарной площадки матки демонстрировала существенные отличия от аналогичных образцов ткани женщин, погибших от септицемии в родах, и позволила детализировать особенности эндомиометрита при послеродовом сепсисе.
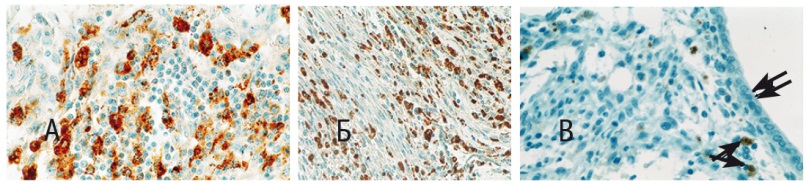
Максимальную концентрацию макрофагов наблюдали как в пределах плацентарной площадки (рис. 6А), так и по ходу соединительнотканных прослоек между мышечными пучками. При эндомиометритах численность плазматических клеток, составивших существенную часть воспалительного инфильтрата плацентарной площадки, преимущественно в зонах отека, несколько уступала таковой макрофагов (рис. 6Б). Гранулоциты формировали небольшие скопления в плацентарной площадке, отдельные клетки наблюдали среди мышечных пучков. Особый интерес вызвала высокая иммуноэкспрессия ФНО-α в строме эндометрия и миометрия, обнаруженная в составе воспалительного инфильтрата при эндомиометрите (рис. 6В).
Рис. 6. Послеродовой сепсис, 5-е сутки пуэрперия, матка: А — выраженная инфильтрация миометрия макрофагами (маркер CD68) (400-кратное увеличение); Б — плазматические клетки среди миоцитов (маркер Plasma cell) (200-кратное увеличение); В — отдельные макрофаги, синтезирующие фактор некроза опухоли α (маркер фактора некроза опухоли Αα) (указаны стрелками), справа — стенка эндометриальной железы (указана двойной стрелкой) (400-кратное увеличение)
Патолого-анатомический диагноз
Основное заболевание: Послеродовой сепсис (085) после 1-х преждевременных экстренных оперативных родов в сроке 37 недель — септикопиемия: гнойный эндомиометрит, сальпингит, перисальпингит, межуточный гепатит, межуточный миокардит, гнойный трахеобронхит, двусторонняя сливная пневмония, гнойный менингоэнцефалит.
Операция: Экстренное кесарево сечение 25.02.2009 г.
Фоновое заболевание: Апостематозный нефрит.
Осложнения основного заболевания: Бактериальный шок. Синдром ДВС, отек легких.
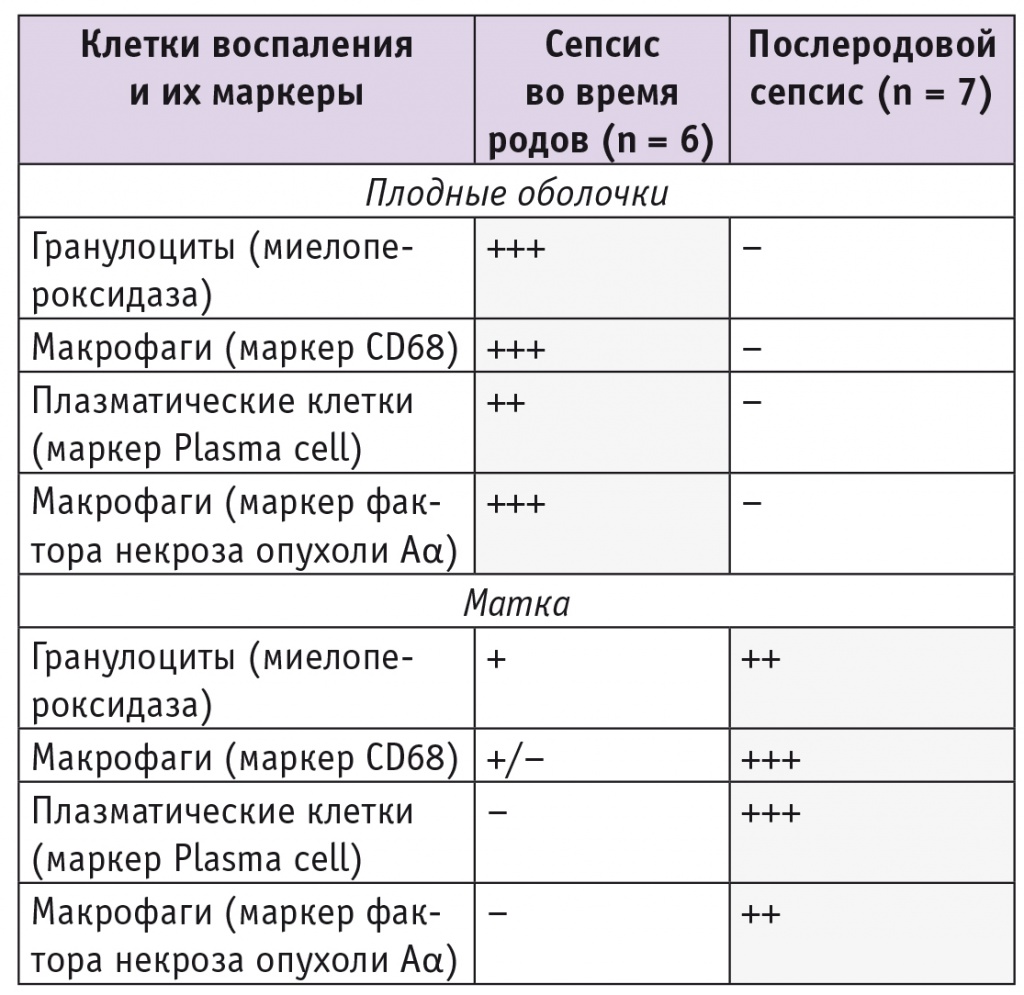
Балльная оценка иммуногистохимической активности клеток воспаления и их маркеры в плодных оболочках и матке женщин, умерших от септицемии в родах и послеродового сепсиса, представлены в таблице.
Таблица
Типы клеток воспаления и их иммуногистохимическая активность в плодных оболочках и матке при сепсисе во время родов и послеродовом сепсисе
ОБСУЖДЕНИЕ
Клинический анализ наблюдений материнской смерти вследствие септических осложнений убедительно свидетельствует об особенностях течения двух нозологических форм акушерского сепсиса (сепсиса во время родов и послеродового): различных условиях возникновения (дородовом фоне и предшествующих заболеваниях), сроках начала клинических проявлений и гибели женщин, исходах беременности и родов для плода, составе клеток воспаления, их локализации и активности во входных воротах инфекции. Обе исследуемые формы акушерского сепсиса объединяет сходство финальных стадий, протекающих с симптомами и морфологическими признаками инфекционно-токсического шока, синдрома ДВС и полиорганной недостаточности.
ЗАКЛЮЧЕНИЕ
Установленные клинико-статистические особенности, морфологические и иммуногистохимические эквиваленты двух форм акушерского сепсиса диктуют необходимость их четкой и своевременной дифференциации с целью реализации стратегического принципа лечения — локализации системной воспалительной реакции на этапе первичного очага, предотвращения перехода в синдром системной воспалительной реакции, профилактики материнских и перинатальных потерь.








