Послеродовые гнойносептические заболевания (ГСЗ) являются одной из актуальных проблем современного акушерства вследствие их высокой распространенности, отсутствия тенденции к снижению их частоты. Они стойко занимают в течение последних 10 лет 4е место в структуре причин материнской смертности в мире [1, 2]. По данным Департамента здравоохранения города Москвы (ДЗМ), в Москве от инфекционных осложнений погибла 1 пациентка в 2013 г.; 3 — в 2014 г.; ни одной — в 2015 г. и 1 пациентка — в 2016 г. [3].
В последние десятилетия во всем мире отмечается стойкая тенденция к росту распространенности абдоминального родоразрешения, обусловленная перинатальной направленностью акушерства [4]. В Москве также наблюдается ежегодный рост удельного веса кесарева сечения: так, в 2000 г. его доля составляла 16% от общего числа родов, в 2010 г. — 22%, а к 2013 г. выросла до 24,2%; в 2014 г. — 24,9%, но в 2015 г. отмечается незначительное снижение — 24,5%, которое сохранилось и в 2016 г. — 24,6% за счет увеличения числа родов, хотя абсолютные цифры свидетельствуют о росте общего числа операций кесарева сечения на 900 женщин, что связано с общемировой тенденцией [3].
По данным ДЗМ, основным показанием к оперативному родоразрешению является рубец на матке после предыдущего кесарева сечения (32%), у 11% женщин — аномалии родовой деятельности, у 9% — отягощенный акушерский анамнез, у 5% — преэклампсия, у 3% — клинически узкий таз, у 5% — экстрагенитальные заболевания, у 2% — предлежание плаценты, у 9% — тазовое предлежание, у 24% — показания со стороны плода [3]. Рекомендованный ВОЗ в 1985 г. как желательный диапазон частоты кесарева сечения 10–15% в России просуществовал всего 10 лет.
Сейчас перечень показаний к кесареву сечению из константы превратился в переменную, что особенно заметно по так называемым относительным показаниям. Возникает «эффект домино», когда наличие одного рубца на матке побуждает к оперативному родоразрешению в последующем, потому что основным показанием к операции кесарева сечения как в Москве, так и в мире является рубец на матке [3, 4]. Современные реалии таковы, что у 25% женщин кесарево сечение производится необоснованно, что в последующем приведет к еще большему увеличению распростарненности абдоминального родоразрешения [1].
В свою очередь, высокая частота выполнения абдоминального родоразрешения обусловила увеличение количества и тяжести послеоперационных инфекционных осложнений [5].
Как любое хирургическое вмешательство, кесарево сечение сопряжено с различного рода осложнениями, среди которых превалируют воспалительные процессы. Несмотря на совершенствование техники операции, использование современных шовных материалов и антибактериальных препаратов, кесарево сечение остается сложной операцией и создает дополнительный риск возникновения послеродовых послеоперационных осложнений [5, 6].
Поэтому риск развития гнойновоспалительных заболеваний после кесарева сечения в 20 раз выше, чем при естественных родах [5–8]. Известно, что увеличение доли абдоминального родоразрешения на 1% повышает частоту развития послеродовых гнойносептических осложнений в 2 раза. Материнская смертность после кесарева сечения, особенно повторного, в 4 раза выше, чем после родов per vias naturales [1, 5]. Причин формирования несостоятельного рубца на матке после кесарева сечения достаточно много: интраоперационные кровотечения, ранение соседних органов, неправильно выбранный метод операции, послеоперационные осложнения (гематолохиометра, эндометрит) [9, 10].
Послеродовой эндометрит является основной причиной неполноценного рубца на матке и генерализации инфекции. Формирование всех последующих гнойных осложнений в послеродовом периоде — следствие прогрессирующего эндометрита. Частота эндометрита после самопроизвольных родов в среднем составляет 2–5%, после кесарева сечения — 10–30% [11, 12]. Инфекционный процесс в матке после оперативного родоразрешения отличается тяжелым и длительным течением, сопровождается воспалительными изменениями шва на матке и его несостоятельностью, развитием перитонита и генерализацией инфекции [13–15].
Распространенность тяжелых осложнений эндометрита, к числу которых относят перитонит, тазовые абсцессы, сепсис, — менее 2%, но именно на их долю приходится значительное количество наблюдений материнской смерти [5, 11].
Одним из наиболее грозных гнойносептических осложнений, сопровождающихся высокой смертностью (15–40%), является акушерский перитонит. По данным ДЗМ, в 2012 г. зарегистрированы 5 наблюдений акушерского перитонита, в 2013 г. — 6, в 2014 г. — 4, в 2015 и 2016 гг. — по 11 [3]. Причиной акушерского перитонита у 98% пациенток становится осложнение кесарева сечения, у 1–2% — обострение воспалительного процесса придатков матки. Инфицирование брюшины, приводящее к развитию акушерского перитонита после кесарева сечения, происходит тремя путями: у 30% женщин инфицированное содержимое полости матки попадает в брюшную полость во время операции, у 15% кишечная микрофлора проникает в брюшную полость на фоне послеоперационного пареза кишечника, у 55% инфицирование брюшной полости возникает при несостоятельности шва на матке на фоне эндометрита. Несостоятельность шва на матке, в свою очередь, у 70% женщин связана с неправильным наложением шва, неполноценным гемостазом во время операции с образованием гематомы послеоперационного шва, к которой присоединяется инфекция, и лишь у 30% пациенток — с репаративными возможностями организма [5, 12, 16–18].
Течение сепсиса и септического шока в акушерстве сопровождается меньшей летальностью, чем у других категорий пациентов (в акушерстве — до 28%, у небеременных женщин — 20–50%). Этому способствуют такие факторы, как более молодой возраст, менее отягощенный преморбидный фон, расположение первичного очага инфекции в полости таза — доступной зоне для диагностических и хирургических вмешательств, чувствительность микрофлоры к антибактериальным препаратам широкого спектра действия.
При рассмотрении вопроса о тяжелом сепсисе и септическом шоке в акушерстве особое внимание следует уделять современным критериям постановки диагноза. Необходимо помнить, что при развитии этих тяжелейших осложнений речь идет не просто о клинике, например, послеродового эндометрита — локальном гнойном очаге, а о системном поражении, и очень часто традиционные симптомы (увеличение размеров матки, гнойные выделения) могут просто отсутствовать. Положительные бактериологические пробы выявляются всего в 58% клинических наблюдений, и на них в первые часы оказания помощи нельзя рассчитывать. Проводимая терапия основного заболевания также может сглаживать остроту проявления некоторых симптомов. Именно на этапе своевременной постановки диагноза и санации очага инфекции происходит большинство ошибок, имеющих фатальные последствия. Системные проявления вплоть до развития полиорганной недостаточности и шока могут значительно опережать локальные симптомы гнойного очага, и без учета современных критериев постановки диагноза невозможно адекватное оказание помощи данной категории пациенток [19].
Отличительной особенностью современного оперативного акушерства является снижение частоты перитонита и сепсиса, зарегистрированных в послеродовом периоде. Несмотря на все профилактические мероприятия, нет тенденции к снижению частоты эндометрита, который в современных условиях имеет торпидное течение с невыраженной клинической симптоматикой, что побуждает к углубленному изучению методов диагностики и адекватного лечения, чтобы избежать перехода в тяжелые формы ГСЗ.
Цель исследования: усовершенствовать алгоритм ведения пациенток с различными формами ГСЗ.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проведено на базе гинекологического отделения ГБУЗ «Городская клиническая больница им. Ф. И. Иноземцева ДЗМ» (главный врач — д. м. н., профессор А. Е. Митичкин). В когортное проспективное сравнительное исследование были включены 276 женщин, поступивших в гинекологический стационар с ГСЗ с 01.01.2014 по 31.12.2016 г.
По клиническому течению, тактике ведения, исходу пациенток разделили на две группы, соответствующие клиническим формам ГСЗ: неосложненные (n = 265) и осложненные (n = 11). Первая группа состояла из трех подгрупп: женщины с эндометритом после самопроизвольных родов (n = 198), после оперативных родов (n = 61) и после оперативных родов с частичной несостоятельностью швов на матке (n = 6). Во вторую группу входили две подгруппы: 10 пациенток с перитонитом и одна с перитонитом и сепсисом.
У всех участниц проведены стандартные клинические, лабораторные и морфологические исследования.
Клиникоанамнестический метод — изучение акушерского анамнеза, особенности течения вагинальных и абдоминальных родов. У всех женщин оценивали соматический статус с использованием визуальных и физикальных методов.
Клиническое лабораторное обследование включало клинический и биохимический анализы крови, общий анализ мочи, коагулограмму, определение группы крови и резусфактора, бактериоскопическое и бактериологическое исследование отделяемого из цервикального канала, измерение уровня прокальцитонина (ПКТ), бактериологическое исследование выпота брюшной полости у прооперированных родильниц.
Инструментальное обследование: трансваганальное и трансабдоминальное УЗИ малого таза, УЗИ брюшной полости, рентгенография органов брюшной полости, КТ и МРТ у родильниц с осложненными формами ГСЗ.
Материал для морфологического исследования (содержимое полости матки, рубцовоизмененные фрагменты матки) забирался во время инвазивных диагностики и лечения и хирургических операций.
Данные подвергали статистической обработке с использованием пакета программ Statistica 12,0; SPSS. Применяли метод описательной статистики с определением среднего арифметического, дисперсии, стандартного отклонения, 95%ного ДИ. Достоверность различий оценивали с помощью непараметрического Uкритерия Манна — Уитни. Различия считали статистически значимыми при p < 0,05.
РЕЗУЛЬТАТЫ
В ходе исследования были получены данные об анамнезе, особенности течения беременности, родов, послеродового периода. Выявлены время манифестации заболевания в каждой группе, специфические и неспецифические клинические лабораторные показатели.
Диапазон возраста обследуемых родильниц — от 22 до 35 лет при среднем значении 26 ± 3,1 года. При анализе медикосоциальной характеристики групп не найдены статистически значимые различия в возрасте менархе, показателях, характеризующих менструальную функцию, в ИМТ, частоте гинекологических и соматических заболеваний, количестве беременностей и их исходах (табл. 1).
Таблица 1
Медико-социальная характеристика пациенток
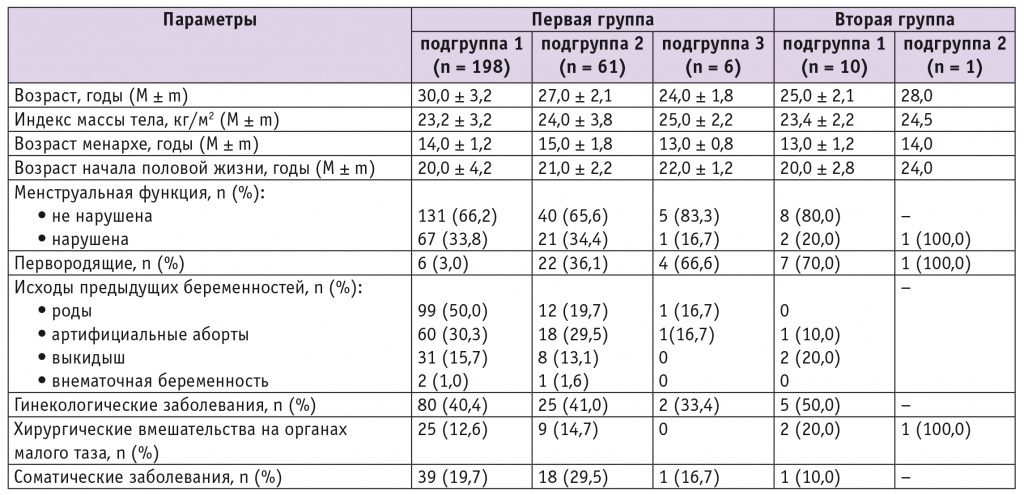
При анализе течения беременности у обследуемых родильниц выявлено, что в совокупности осложнения наблюдались чаще у пациенток с неосложненными формами ГСЗ (p < 0,05). Нарушения биоценоза влагалища чаще отмечались у пациенток с осложненными формами ГСЗ (90 ± 4,0%), чем у женщин с неосложненными формами (64 ± 7,0%) (p < 0,05), причем каждой родильнице из второй группы назначалась антибактериальная терапия во время беременности (табл. 2).
Таблица 2
Осложнения беременности у обследуемых пациенток, n (%)
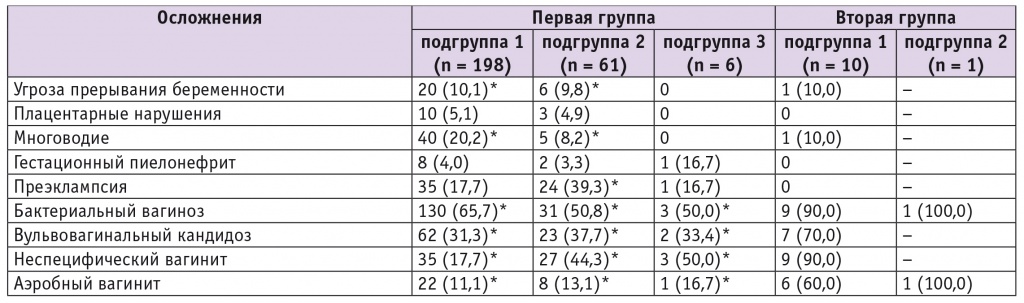
* Отличия от второй группы статистически значимы (p < 0,05).
Анализ течения родов показал, что у каждой третьей пациентки с неосложненными формами ГСЗ безводный промежуток превышал 15 часов, у 89,5% кесарево сечение производилось по экстренным показаниям. У 11 (100%) родильниц с осложненными формами ГСЗ безводный промежуток длился 17 часов, кесарево сечение производилось при открытии маточного зева 8–10 см, и в послеоперационном периоде 95% женщин назначались цефалоспорины I поколения (табл. 3).
Таблица 3
Особенности течения родов у обследуемых пациенток
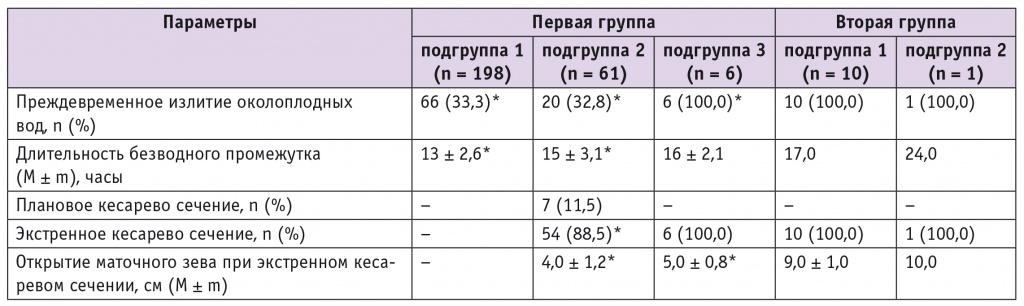
* Отличия от второй группы статистически значимы (p < 0,05).
Родильницы, независимо от формы послеродовых ГСЗ, поступали в гинекологический стационар с жалобами на тянущие боли внизу живота, повышение температуры тела до 38–39°, озноб, слабость, что свидетельствует о том, что специфических различий между неосложненными и осложненными формами не было.
Для клинической картины пациенток первой группы (с послеродовым эндометритом) были характерны начало на 4–12е сутки после родов (в среднем — на 6,0 ± 1,2 суток, в зависимости от формы заболевания), повышение температуры тела до 38–39°, слабость, тянущие боли внизу живота. При вагинальном исследовании определялись замедленная инволюция матки, ее болезненность при пальпации, мутные выделения из половых путей с неприятным запахом.
Для родильниц с осложненными формами ГСЗ (с акушерским перитонитом) характерны неспецифические симптомы: гипертермия, тахикардия, боли внизу живота. Диспепсические симптомы (тошнота, рвота, понос) возникали в более поздние временны́е интервалы послеоперационного периода и в основном имели место при запоздалой диагностике и несвоевременно начатом лечении эндометрита. Диагностически значимые для своевременной постановки диагноза акушерского перитонита симптомы появлялись в более поздний период, чем в первой группе, и были выявлены примерно у половины женщин: напряжение мышц живота — у 50 ± 6,0%; перитониальные симптомы — у 50 ± 6,0%; парез кишечника — у 40 ± 8,0%. Первые симптомы акушерского перитонита у всех родильниц второй группы регистрировали в среднем на 5,5 ± 1,2 суток после кесарева сечения. Диагноз же акушерского перитонита был установлен лишь на 8,8 ± 2,1 суток, т. е. примерно на третьи сутки от манифестации заболевания.
При анализе лабораторных показателей регистрировались изменения в клиническом анализе крови — лейкоцитоз, сдвиг формулы влево, увеличение СОЭ. Следует отметить, что при послеродовом эндометрите может и не наблюдаться реакция воспаления со стороны периферической крови. Изменения в биохимическом анализе крови характеризовались гипопротеинемией, более выраженной при осложненных формах ГСЗ. В коагулограмме наблюдалась гиперкоагуляция, также более выраженная у родильниц с осложненными формами ГСЗ.
При бактериоскопическом исследовании отделяемого из половых путей отмечались признаки вагинита. При бактериологическом исследовании отделяемого из цервикального канала у 9 (81,8%) пациенток с осложненными ГСЗ обнаружен Acinetobacter baumannii.
У 6 (60,0%) родильниц с перитонитом уровень ПКТ составил 0,5–2,0 нг/мл, что характеризует наличие локального бактериального очага (перитонита) и синдрома системной воспалительной реакции, у одной женщины содержание ПКТ было более 2 нг/мл, что свидетельствовало о перитоните и сепсисе (табл. 4).
Таблица 4
Лабораторные показатели у обследуемых пациенток, n (%)
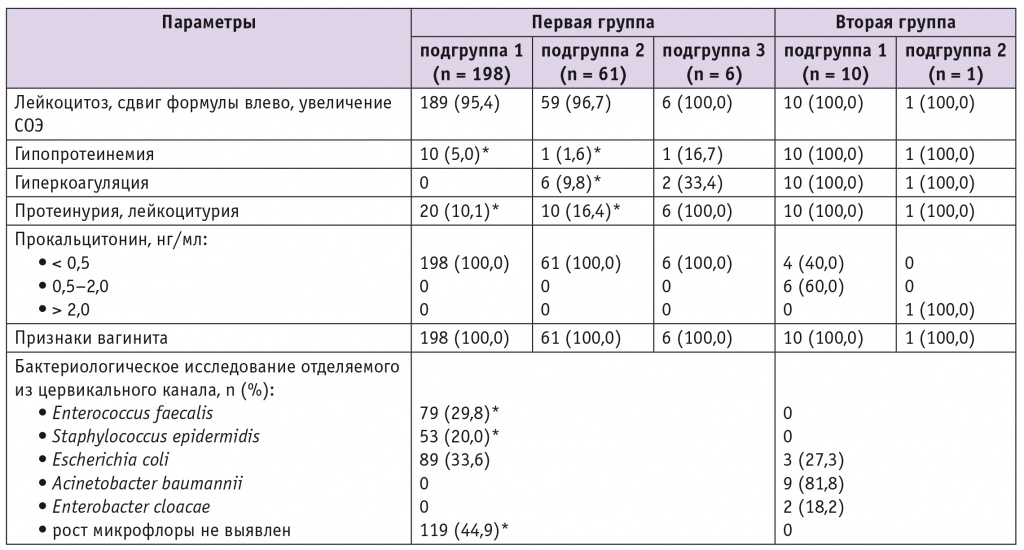
* Отличия от второй группы статистически значимы (p < 0,05).
Информативным и объективным методом оценки наличия послеродового эндометрита и состояния шва на матке в настоящее время считается УЗИ. УЗИ позволяет выявить субинволюцию матки, которая характеризуется увеличением длины, ширины, переднезаднего размера и объема матки по сравнению с показателями, свойственными физиологическому течению пуэрперия. Эхографические признаки послеродового эндометрита — наличие в полости матки плацентарной, децидуальной ткани, оболочек, сгустков крови (больше 5 мм в диаметре), расширение и/или появление неровностей контуров полости матки, в которой могут определяться жидкость, пузырьки газа, создающие эффект «акустической тени». В ряде наблюдений на фоне нерасширенной полости матки обнаруживают мелкие гиперэхогенные включения, и, что особенно важно, обращает на себя внимание повышенная эхогенность стенок полости матки, обусловленная воспалительным процессом.
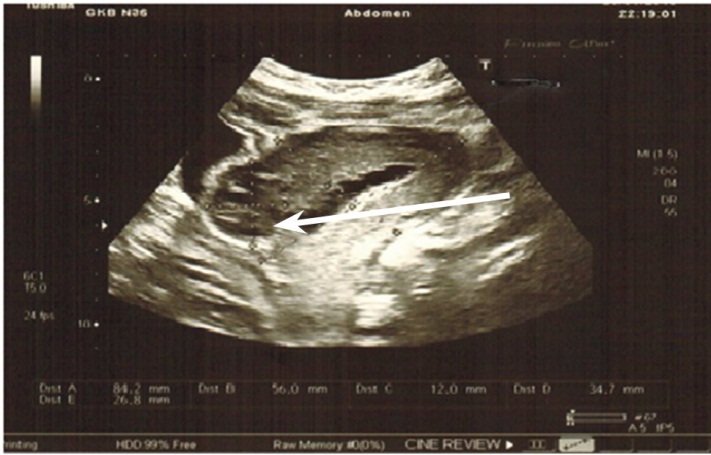
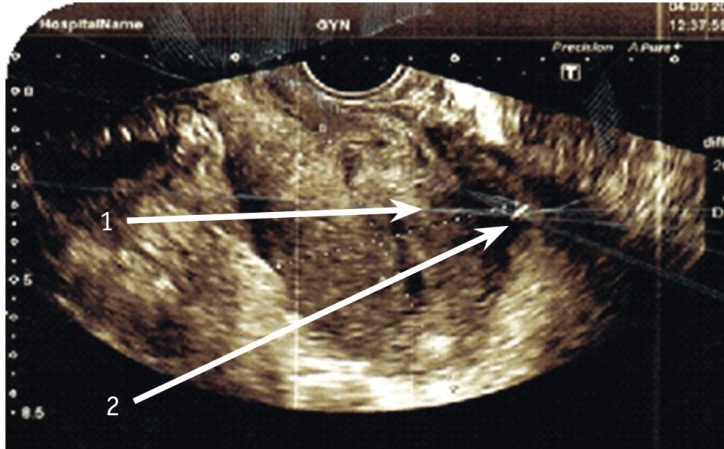
Частичная несостоятельность характеризуется деструкцией не на всем протяжении шва и не на всю его глубину, и полость матки не сообщается с брюшной полостью (рис. 1). В данной ситуации необходим комплексный подход с оценкой клинической картины и данных клиниколабораторного обследования. При УЗИ органов малого таза у всех женщин с осложненными формами ГСЗ обнаруживались эхопризнаки полной несостоятельности рубца на матке, свободной жидкости в брюшной полости. При этом визуализировалось сообщение полости матки с брюшной полостью, что принципиально отличало данную эхографическую картину от частичной несостоятельности шва на матке (рис. 2).
|
Рис. 1. Ультразвуковая картина частичной несостоятельности шва на матке (указана стрелкой). Здесь и далее в статье фото авторов |
|
| Рис. 2. Ультразвуковая картина полной несостоятельности шва на матке. Стрелка 1 — полная несостоятельность шва на матке, стрелка 2 — свободная жидкость в брюшной полости |
 |
Всем родильницам производилась рентгенография органов брюшной полости. МРТ и КТ делали женщинам с осложненными формами ГСЗ и с частичной несостоятельностью швов на матке. При рентгенографии у 45,0 ± 7,0% женщин обнаружены уровни в петлях тонкой и толстой кишки. У всех обследуемых, которым проводили КТ и МРТ, выявлены признаки частичной или полной несостоятельности передней стенки матки.
Пациенткам с неосложненными формами ГСЗ назначалась антибактериальная терапия, согласованная с клиническим фармакологом, включавшая ингибиторозащищенные аминопенициллины, цефалоспорины III–IV поколения и имидазол. При тяжелых формах эндометрита и при частичной несостоятельности швов на матке применяли карбопенемы и гликопептиды. Следует учитывать, что ни один из цефалоспоринов не обладает достаточной эффективностью против энтерококков, поэтому при подозрении на энтерококковую инфекцию целесообразно использовать препараты пенициллинового ряда. В нашем исследовании энтерококковая инфекция была диагностирована у 79 (29,8%) пациенток.
Выбор той или иной комбинации препаратов определяется тяжестью течения эндометрита и спектром возбудителей. Проводилась инфузионная, дезинтоксикационная терапия. С целью профилактики венозных тромбоэмболических осложнений назначался бемипарин натрия в дозе 2500 МЕ 1 раз в сутки.
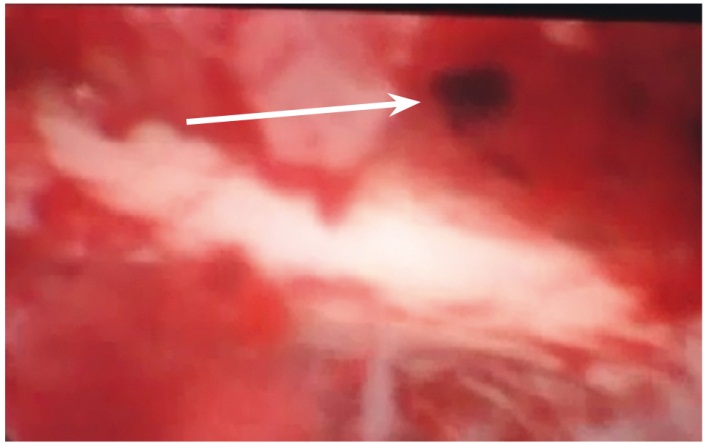
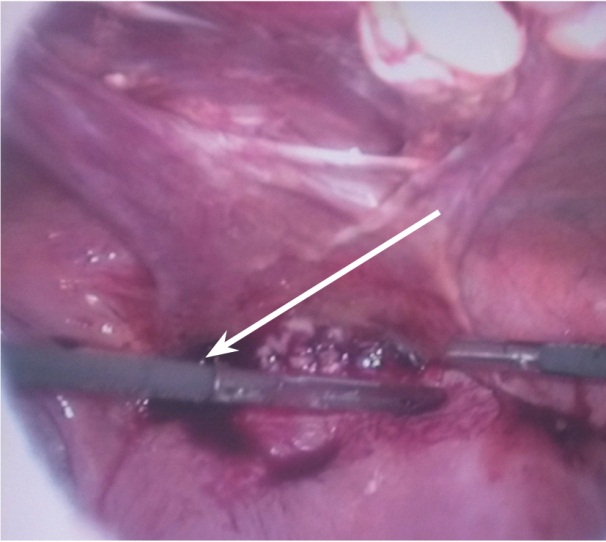
Всем родильницам с неосложненными ГСЗ после самопроизвольных и оперативных родов производилась гистероскопия с целью удаления патологического субстрата из полости матки и адекватной санации очага инфекции. Гистероскопия позволяет выявить эндометрит, обусловленный остатками плацентарной ткани, эндометрит с некрозом децидуальной ткани, эндометрит с частичной несостоятельностью швов на матке, санировать полость и назначить дифференцированное лечение [20]. Шести (100%) родильницам с частичной несостоятельностью швов на матке проводилась гистероскопия в сочетании с лапароскопией, причем чем раньше предпринято это вмешательство с диагностической или лечебной целью, тем лучше исход заболевания, тем меньше вероятность развития акушерского перитонита (рис. 3, 4).
| Рис. 3. Гистероскопическая картина частичной несостоятельности шва на матке (указана стрелкой) |
 |
| Рис. 4. Лапароскопическая картина частичной несостоятельности шва на матке (указана стрелкой) |
 |
Всех родильниц с подозрением на акушерский перитонит госпитализировали в реанимационное отделение для проведения клиниколабораторного обследования. Незамедлительно начиналась интенсивная антибиотикотерапия, инфузионная, дезинтоксикационная терапия. При выявлении перитонита с синдромом системной воспалительной реакции или без него по данным прокальцитонинового теста предположительный объем операции включал метропластику, а при ее невозможности — экстирпацию матки, однако окончательное решение принималось в каждом случае индивидуально интраоперационно. При диагностировании перитонита и сепсиса показана экстирпация матки как источника инфекции, однако, учитывая возможности стационара, вопрос может решается индивидуально в каждом конкретном случае.
Антибактериальные препараты до получения результатов бактериологического исследования назначали по согласованию с клиническим фармакологом и с учетом применения антибиотикотерапии в послеродовом периоде. Девяти (81,8%) родильницам назначены карбапенемы в сочетании с гликопептидами и имидазолом, 2 (18,2%) — карбапенемы в комбинации с гликопептидами и оксазолидином.
После получения результатов клиниколабораторного исследования при наличии данных за перитонит совместно с хирургами 11 родильницам произведена нижнесрединная лапаротомия. По характеру экссудата у 8 (72,7%) из них был выявлен фибринозногнойный перитонит, у 3 (27,3%) — серозный. У 4 (36,4%) женщин имелись гнойновоспалительная инфильтрация тканей по ходу швов с гнойным расплавлением шва, несостоятельность швов, у 6 (54,5%) — воспалительная инфильтрация тканей по ходу швов с полной несостоятельностью швов, у 1 (9,1%) — расплавление шва на всем протяжении с полной несостоятельностью.
Всем пациенткам с несостоятельностью швов на матке и акушерским перитонитом вне зависимости от формы и распространенности перитонита были выполнены органосохраняющие операции. Программированные релапаротомии проведены 2 (18,2%) родильницам, они помогли адекватно санировать брюшную полость и, самое главное, сохранить матку, а значит, репродуктивную функцию. У одной пациентки диагностировали перитонит и сепсис, при этом при релапаротомии должны были произвести экстирпацию матки как источника инфекции, но с учетом положительной динамики удалось сохранить орган. В послеоперационном периоде продолжалась дезинтоксикационная, инфузионная терапия.
Родильницы с эндометритом после самопроизвольных и оперативных родов выписаны в удовлетворительном состоянии на 4,4 ± 2,2 суток, с эндометритом после оперативных родов и частичной несостоятельностью швов на матке — на 5,5 ± 1,1 суток, с осложненными формами ГСЗ — на 9,1 ± 2,3 суток.
ОБСУЖДЕНИЕ
В настоящее время диагностика послеродовых ГСЗ основывается на данных анамнеза, клинической картине, результатах клиниколабораторного исследования.
Для акушерского перитонита характерна стертая клиническая картина, основными и наиболее ранними проявлениями которой становятся неспецифические симптомы, что значительно затрудняет своевременную диагностику, увеличивая временной интервал между началом заболевания и постановкой правильного диагноза.
Определено, что причиной возникновения послеродового инфекционного заболевания чаще всего служит эндогенная инфекция. Показаны многолетние колебания микробиологических показателей цервикального канала женщин с преобладанием грамположительной или грамотрицательной флоры, сохранение ведущей роли в генезе послеродовых заболеваний Enterococcus ecium и Enterococcus faecalis и возрастание значения Streptococcus agalactiae, Streptococcus haemolyticus, Escherichia coli и Pseudomonas aeruginosa [5]. Acinetobacter baumannii является завсегдатаем стационара, устойчивым к пенициллинам и цефалоспоринам I поколения, с ним ассоциируется чрезвычайный высокий уровень летальности (30–60%). На фоне сниженного иммунитета такая инфекция может привести к летальному исходу от инфекционнотоксического шока и полиорганной недостаточности.
В настоящее время мир вступил в постантибиотиковую эру. Микробная резистентность к лекарствам — рост невосприимчивости бактерий к новой «панацее» — следовала по пятам каждого создаваемого чудопрепарата, что привело к возникновению супербактерий ESCAPE (супербактерии, трудно поддающиеся лечению), устойчивых к антибиотикам [1]. Особое внимание уделяется прокальцитонинову тесту. Повышение уровня ПКТ — это специфический маркер при тяжелых бактериальных инфекциях и сепсисе, когда развивается системное воспаление бактериальной этиологии [6, 7, 19].
УЗИ является информативным методом в диагностике вида и тяжести послеродового осложнения. Значимые признаки эндометрита после кесарева сечения — значительная инфильтрация миометрия, наличие внутриматочного субстрата, а также инфильтрата шва на матке, причем геморрагическое или гнойное содержимое инфильтрата — определяющий фактор в формировании полной несостоятельности шва [5–7].
Инфекционные осложнения возникают как после родов через естественные родовые пути, так и после абдоминальных родов. Инфекционный процесс в матке после кесарева сечения отличается более тяжелым и длительным течением, нередко сопровождается развитием воспалительных изменений миометрия в области шва на матке и является ведущей причиной генерализованных форм послеродовой инфекции. Развитие перитонита чаще всего связано с несостоятельностью швов на матке и присоединением инфекции, реже — с технической погрешностью наложения швов. В ходе исследований установлено, что, несмотря на совершенствование хирургических технологий родоразрешения, кесарево сечение становится фактором риска ГСЗ чаще, чем вагинальные роды [5, 7]. ГСЗ органов малого таза сопутствовали осложнения, обусловленные нарушениями системы гемостаза, соматическими и генитальными заболеваниями неинфекционной природы.
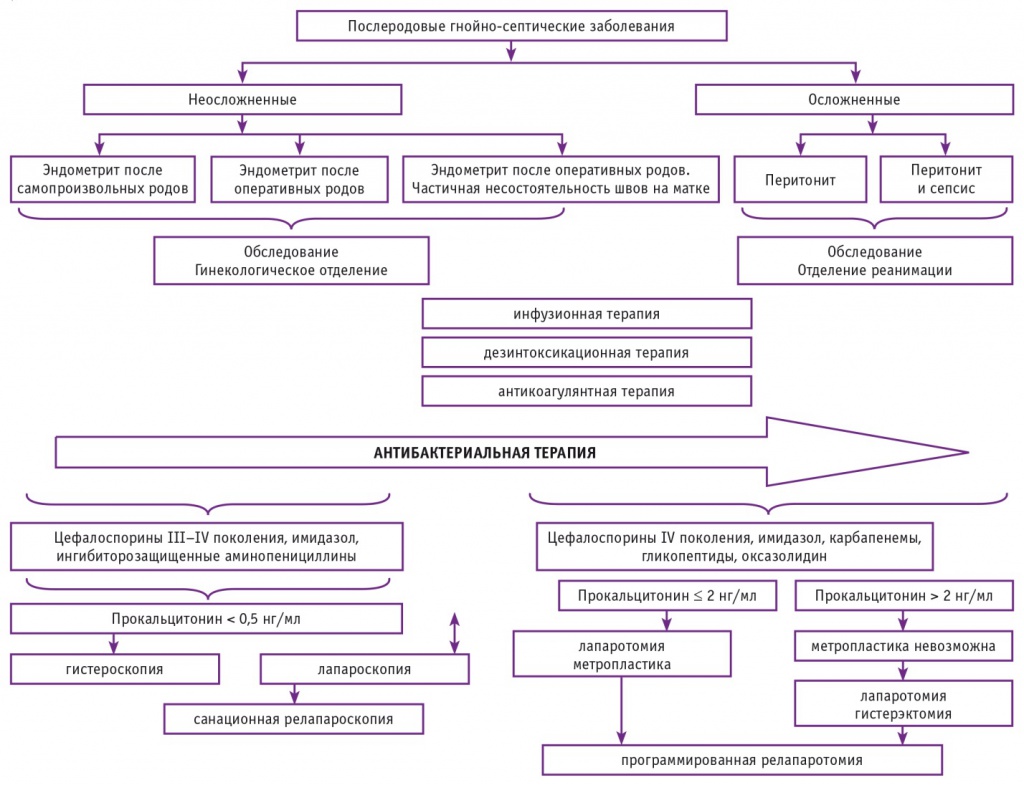
На основании проведенного нами исследования был разработан алгоритм ведения пациенток с различными формами ГСЗ (рис. 5). Пациенток с неосложнеными формами ГСЗ госпитализировали для обследования в отделение гинекологии, с осложненными — в отделение реанимации. В засимости от формы ГСЗ назначались дезинтоксикационная, инфузионная, антикоагулянтная и эмпирическая антибактериальная терапия. Родильницам с эндометритом после самопроизвольных и оперативных родов проводили гистероскопию; с эндометритом и частичной несостоятельностью — гистероскопию в сочетании с лапароскопией, при необходимости — санационную релапароскопию. Родильницам с осложненными формами ГСЗ осуществляли лапаротомию. В зависимости от уровня ПКТ и возможности метропластики производили органосохраняющее вмешательство. С целью адекватной санации очага инфекции также проводили программированные релапаротомии. При содержании ПКТ более 2 нг/мл показана гистерэктомия, в нашем случае удалось сохранить матку.
Рис. 5. Алгоритм ведения родильниц с гнойно-септическими заболеваниями
ЗАКЛЮЧЕНИЕ
Разработанный алгоритм ведения пациенток с различными формами послеродовых гнойносептических заболеваний позволил у всех 276 (100%) участниц сохранить репродуктивную функцию и избежать ранних послеоперационных осложнений.








