В свете современных представлений причинами ВПР являются социальноэкономические, генетические факторы, инфекции, неадекватное питание матери (дефицит фолиевой кислоты, чрезмерное потребление витамина А) и экологические факторы (пестициды, радиация, проживание вблизи свалок мусора, металлургических предприятий, шахт и др.), повреждающее действие которых кратно усиливается при дефиците нутриентов [1].
Врожденные пороки сердца (ВПС) составляют почти треть всех основных врожденных аномалий развития плода [2]. Так, в США ежегодно рождаются до 30–35 тыс. детей с ВПС, в России — 20–22 тыс. [3]. За последние 10 лет отмечается неуклонный рост числа ВПС, в том числе сложных и тяжелых, что в значительной мере обусловлено совершенствованием диагностики [4, 5]. В структуре смертности они занимают третье место после патологии опорнодвигательного аппарата и ЦНС. К наиболее распространенным ВПС относятся дефекты межжелудочковой и межпредсердной перегородок (ДМЖП, ДМПП), открытый артериальный проток, коарктация аорты и тетрада Фалло [6, 7].
Известно, что как ранний, так и поздний возраст матери являются факторами риска ВПР [1, 8, 9]. В большом популяционном исследовании M. Loane и соавт. (2009) проанализированы 38 958 случаев нехромосомных аномалий развития плода и выявлено, что у детей матерей в возрасте моложе 20 лет имеет место наибольший риск ВПР (ОР = 1,11; 95%ный ДИ: 0,06‒1,17), в том числе атрезии и стеноза трикуспидального клапана (ОР = 2,63; 95%ный ДИ: 1,37‒5,06) [9]. По данным L. M. Hollier и соавт. (2002), ОР ВПС у детей матерей в возрасте 35‒39 лет составляет 1,43 (95%ный ДИ: 0,77‒2,64), старше 40 лет — 3,95 (95%ный ДИ: 1,70‒9,17) [8].
Общепризнанный фактор риска ВПС плода — курение матери [10], однако дозозависимость воздействия требует дополнительных исследований [11]. В то же время систематический обзор и метаанализ 2015 г. не выявили взаимосвязи между употреблением алкоголя беременной и развитием ВПС у ребенка [12].
Данные доказательной медицины свидетельствуют, что ИМТ > 30 кг/м2 является фактором риска ВПР плода (уровень доказательности II b), при этом найдена прямая корреляционная зависимость между степенью тяжести ожирения и дефектами атриовентрикулярной перегородки сердца [13‒16].
В качестве ведущей причины ВПР у детей от матерей с ожирением исследователи выделяют алиментарный дефицит фолиевой кислоты и нарушения метаболизма, в том числе фолатов [17, 18].
Цель настоящего исследования: оценить влияние нутриционной поддержки в периконцепционном и гестационном периодах на частоту развития акушерских и перинатальных осложнений у здоровых женщин репродуктивного возраста с одноплодной беременностью.
МАТЕРИАЛЫ И МЕТОДЫ
Данное исследование было одобрено Этическим комитетом Читинской государственной медицинской академии (протокол № 64 от 23 июня 2014 г.). Проведен ретроспективный анализ 150 историй родов и историй новорожденных в Забайкальском краевом перинатальном центре (г. Чита, главный врач — Е. Н. Агафонова), отобранных в соответствии с критериями включения в исследования за период 2014–2016 гг.
Критериями исключения из исследования были: возраст матери моложе 20 и старше 35 лет, ожирение, курение, употребление алкоголя, профессиональные вредности, ИППП, острые (обострения хронических) инфекционные заболевания в первом или втором триместрах гестации, экстрагенитальные заболевания, наличие у пациентки или в семье детей с пороками развития. Все участницы имели одноплодную беременность. Группы были сопоставимы по социальному статусу, паритету, особенностям питания и наличию вредных привычек, отягощенного личного и семейного анамнеза.
Характер питания оценивали с помощью модифицированного опросника, предложенного О. Я. Лещенко (2012) [19] и разработанного на основе анкеты Норвежского университета г. Берчена (Health Behavior among SchoolAged Children) [20].
Основным группирующим признаком был прием в периконцепционном периоде и в течение данной беременности фолатов в виде 200 мкг фолиевой кислоты и 200 мкг метафолина в составе витаминноминерального комплекса (ВМК), содержащего также витамины Е, С, В1, В2, В6, В12, никотинамид, биотин, пантотенат и йод, а со второго триместра гестации — дополнительно докозагексаеновую полиненасыщенную жирную кислоту в дозе 200 мг. В результате были сформированы две клинические группы: в 1ю группу вошли 75 пациенток, не получавшие нутриционную поддержку; во 2ю — 75 женщин, принимавшие указанный ВМК (ни одна пациентка не отметила побочных эффектов).
Статистическая обработка результатов была произведена с помощью пакета программ Statistica 10. Достоверность различий между двумя средними показателями оценивали по критерию Стьюдента (t); между долями — по критерию χ2. Значения считали достоверными при χ2 > 3,84, при р ≤ 0,05. Силу связи между изучаемым воздействием и частотой акушерских и перинатальных осложнений оценивали по величине показателя ОШ. ОШ = 1 означает, что зависимость между вмешательством и изучаемым явлением отсутствует. При ОШ > 1 вероятность события повышена, а ОШ < 1 указывает на отсутствие влияния. ДИ, приводимые в работе, строили для доверительной вероятности p = 95%.
РЕЗУЛЬТАТЫ
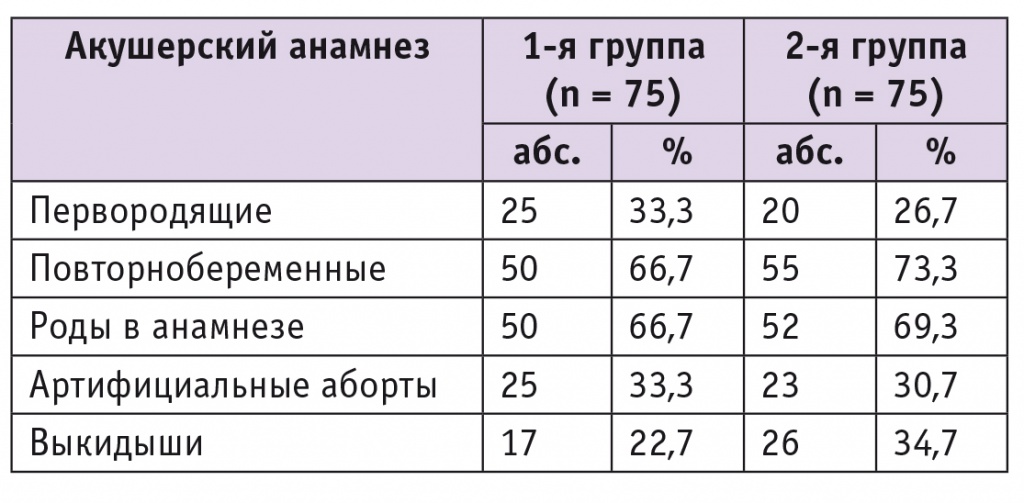
Участницы были сопоставимы по возрасту (27,4 ± 4,6 и 28,8 ± 3,7 года, р > 0,05) и не имели отличий по ИМТ (22,6 ± 4,1 vs 22,4 ± 3,2 кг/м2; р > 0,05); паритету (первородящих было 33,3% vs 26,7%; р(χ2) > 0,05; многорожавших не было). Данные акушерского анамнеза пациенток сравниваемых групп не различались, они представлены в таблице 1.
Таблица 1
Акушерский анамнез пациенток сравниваемых групп
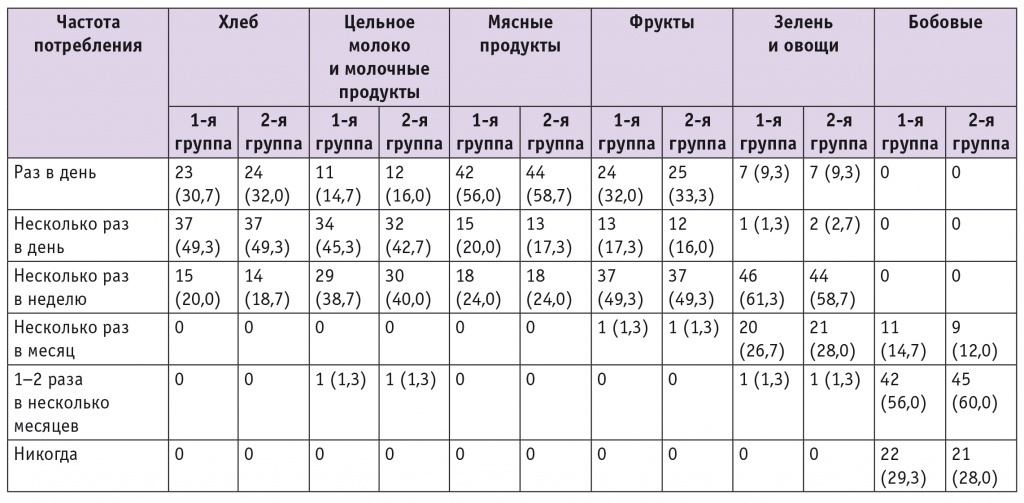
При анонимном интервьюировании с помощью модифицированного опросника установлено, что женщины сравниваемых групп не различались по характеру питания во время беременности и употребляли пищу, бедную микроэлементами и витаминами (табл. 2). Большинство участниц обеих групп имели алиментарный дефицит фолатов, основным источником которых служат свежие овощи и зелень: 89,3% в 1й и 88,0% во 2й группе (р(χ2) > 0,05).
Таблица 2
Питание беременных сравниваемых групп, n (%)
Осложнения беременности у пациенток сравниваемых групп представлены в таблице 3. У беременных, не получавших ВМК с метафолином, в 5,3 раза чаще возникала задержка роста плода (ЗРП) (ОШ = 6,6; 95%ный ДИ: 1,81–23,42). По степени тяжести в структуре данного осложнения преобладала ЗРП 1й степени, которую регистрировали в 4,4 раза чаще в группе женщин без нутриционной поддержки в период преконцепции и беременности (ОШ = 5,0; 95%ный ДИ: 1,04–18,88). ЗРП 2й степени в обеих клинических группах встречалась реже, но преобладала у матерей, не употреблявших ВМК (ОШ = 3,1; 95%ный ДИ: 1,12–19,33). ЗРП 3й степени имела место только у младенцев, матери которых не принимали нутриенты.
Таблица 3
Осложнения беременности у пациенток сравниваемых групп, n (%)
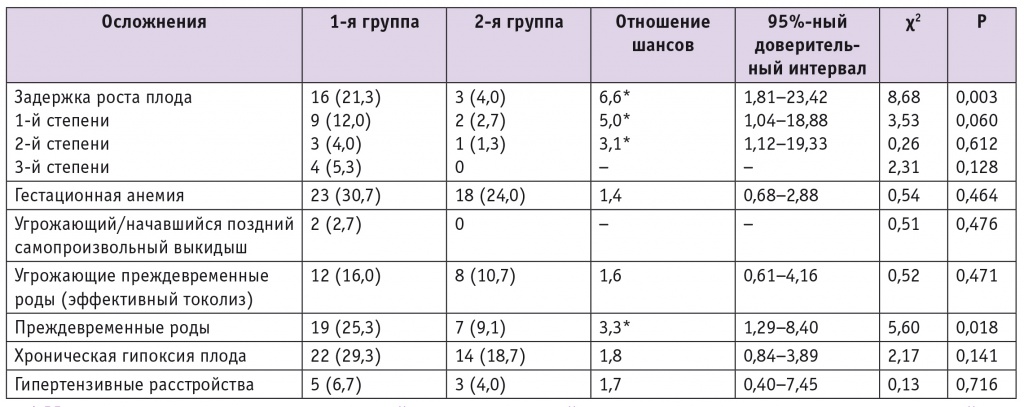
* Имеется связь между изучаемым воздействием и частотой акушерских и перинатальных осложнений.
Следующим по частоте встречаемости осложнением беременности были преждевременные роды, которые зарегистрированы в 2,7 раза чаще (р = 0,018) у беременных, не получавших ВМК с метафолином, а затем с докозагексаеновой полиненасыщенной жирной кислотой (ОШ = 3,3; 95%ный ДИ: 1,29–8,40).
Дальнейшее ранжирование осложнений беременности выявило, что у здоровых женщин, беременность которых протекала без нутриционной поддержки, в 1,7 раза развивались гипертензивные расстройства (ОШ = 1,7; 95%ный ДИ: 0,40–7,45), в 1,6 раза чаще — хроническая гипоксия плода (ОШ = 1,8; 95%ный ДИ: 0,84–3,89), в 1,5 раза чаще — угрожающие преждевременные роды (ОШ = 1,6; 95%ный ДИ: 0,61–4,16), по поводу чего им проводили токолитическую терапию и профилактику респираторного дистресссиндрома плода, в 1,3 раза чаще — гестационная анемия (ОШ = 1,4; 95%ный ДИ: 0,68–2,88). Угрожающий и начавшийся поздние самопроизвольные выкидыши осложнили беременность у 2,7% пациенток, не получавших ВМК, и не зарегистрированы во 2й группе.
В исследуемой когорте младенцев аномалии развития нервной трубки не наблюдали. Неожиданным и весьма показательным оказался тот факт, что у новорожденных от здоровых матерей с неотягощенным анамнезом, но не получавших нутриционную поддержку в периконцепционном периоде и при беременности, частота ВПС, как больших, так и малых, оказалась в 3,7 раза больше: 84,0% vs 22,7% (p < 0,01), а шанс развития данного заболевания составил 17,9 (95%ный ДИ: 7,88‒40,70) (табл. 4). Эти дети в 7,1 раза чаще имели сочетанные пороки (ОШ = 7,6; 95%ный ДИ: 1,19–63,53), такие как коарктация аорты и ДМПП (n = 2), коарктация аорты и ДМЖП (n = 1), общий артериальный ствол и ДМЖП (n = 1), атрезия устья аорты и синдром гипоплазии левых отделов (n = 1), ДМПП и ДМЖП (n = 2).
Таблица 4
Частота и структура врожденных пороков сердца у новорожденных от матерей сравниваемых групп, n (%)
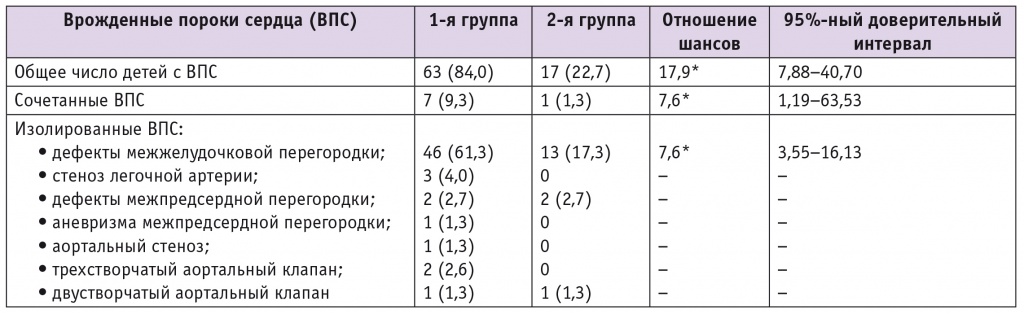
* Имеется связь между изучаемым воздействием и частотой акушерских и перинатальных осложнений.
Среди изолированных ВПС в группе детей от женщин, не получавших ВМК, в 3,5 раза чаще встречался ДМЖП (р < 0,01), шанс развития которого был достаточно высоким и составил 7,6 (95%ный ДИ: 3,55–16,13). Только у новорожденных от этих матерей зарегистрированы такие ВПС, как стеноз легочной артерии, трехстворчатый аортальный клапан, аортальный стеноз, аневризма межпредсердной перегородки. С одинаковой частотой у младенцев сравниваемых клинических групп диагностированы ДМПП и двустворчатый аортальный клапан.
ОБСУЖДЕНИЕ
Адекватная нутриционная поддержка женщин в преконцепционном и гестационном периодах находится в фокусе внимания современной перинатальной медицины. Доказанной и эффективной периконцепционной стратегией является дотация фолатов, которые играют важную роль в биосинтезе тимидина и являются ключевым фактором в эпигенетическом метилировании ДНК, регулирующем экспрессию каждого гена в геноме, что необходимо для нормального развития эмбриона, плода и их провизорных органов, роста новых кровеносных сосудов в матке. Биологические функции фолатов — реметилирование гомоцистеина в метионин, участие в процессах кроветворения, в синтезе эссенциальных фосфолипидов (фосфатидилхолина) и нейротрансмиттеров (серотонина, мелатонина, адреналина, дофамина) и др. [21].
В настоящее время убедительно доказано, что дефицит фолатов при беременности ассоциирован с формированием врожденных пороков, прежде всего дефектов нервной трубки и ВПС, и развитием ряда осложнений беременности, таких как ЗРП, преэклампсия, гестационная анемия, невынашивание беременности в ранние и поздние сроки [22‒28].
Фолатный цикл является сложным каскадным процессом, в котором задействовано большое количество различных ферментов. Основные гены, продукты которых контролируют превращение фолиевой кислоты в метаболически активные формы и регулируют обмен гомоцистеина, — это гены метилентетрагидрофолатредуктазы (MTHFR), метионинсинтазаредуктазы (MTRR), метионинредуктазы (MTR) и транскобаламинсинтетазы (TR). Снижение активности данных ферментов — один из основных путей накопления гомоцистеина в организме.
Наши предыдущие исследования продемонстрировали достаточно высокую, но соответствующую общепопуляционным данным распространенность мутантных генотипов полиморфизма генов MTHFR в Забайкальском крае у молодых здоровых женщин, планирующих беременность: 5,4% MTHFR677TТ и 11,5% MTHFR1298CС. Частота носительства MTRR66GG в Забайкалье в 1,3–2,1 раза превышает популяционные показатели (31,5% и 15–25% соответственно). Сочетания мутантных генотипов: MTHFR677TТ и MTHFR1298СС, MTHFR677TТ и MTRR66GG — кратно повышают риски невынашивания беременности и развития дефектов нервной трубки плода, они обнаружены у 1,6% обследованных (0,8% для каждого из сочетаний) [29].
С этих позиций имеет значение не только факт приема фолатов, но и их доза и биодоступность употребляемой формы. Известно, что у носителей гетерозиготных и гомозиготных генотипов MTHFR677TТ снижена активность ферментов примерно на 40% и 70% соответственно, что приводит к образованию меньшего количества активной формы фолатов 5метилтетрагидрофолата, повышению уровня гомоцистеина и увеличению риска осложнений гестации и пороков развития плода (нервной трубки, сердечнососудистой системы и др.), что отчасти объясняет полученные нами данные [21, 22, 30, 31].
В 2015 г. ВОЗ, Международная федерация акушеровгинекологов и нормативные документы различных организаций 36 ведущих стран мира утвердили для беременных дозу фолатов не менее 400 мкг/сутки для профилактического приема. Оптимальная концентрация фолатов в эритроцитах должна составлять на момент зачатия 906 нмоль/л [21, 28]. Исследования последних лет показали, что прием высоких доз фолатов должен быть обоснован [32].
Особенно важно потребление адекватной дозы фолиевой кислоты при мутантном генотипе матери MTHFR677TТ. Результаты исследований L. Plumptre и соавт. (2015) свидетельствуют, что даже при обычном рационе питания беременных и дотации 400 мкг фолатов в сутки при гомозиготном генотипе MTHFR677TТ матери и плода в пуповинной крови низко содержание фолатов и высок уровень неметаболизированной фолиевой кислоты, которые могут оказать долгосрочные неблагоприятные воздействия на здоровье потомства [33].
Исследования Е. А. Сандаковой, Е. О. Гостевой (2013) показали, что прием активной формы фолиевой кислоты (метафолина) в сочетании с витаминами Е, С, В1, В2, В6, В12, никотинамидом, биотином, пантотенатом и йодом, а также с полиненасыщенными жирными кислотами (докозагексоеновой кислотой) позволяет не только более эффективно проводить профилактику ВПР плода, но и существенно улучшает течение беременности, снижая частоту анемии, плацентарных нарушений, угрозы прерывания. Применение ВМК, имеющего в своем составе метафолин и докозагексоеновую кислоту, оптимизирует исходы родов: улучшает ростовые показатели новорожденных; среднюю величину оценки по шкале Aпгар на первой минуте; снижает частоту недоношенности [31].
Результаты нашего исследования подтвердили клиническую эффективность нутриционной поддержки с использованием ВМК с метафолином и докозагексоеновой полиненасыщенной жирной кислотой в преконцепционный и гестационный периоды. Обоснованием такого назначения является потребность коррекции пищевого рациона будущих матерей в связи с недостаточным поступлением этих нутриентов с пищей, что было продемонстрировано в Российском популяционном исследовании с участием 2141 женщины 20–45 лет [34] и выявлено нами в данной работе при оценке особенностей питания молодых здоровых женщин, не имеющих отягощенного личного и семейного анамнеза.
ЗАКЛЮЧЕНИЕ
Полученные данные свидетельствуют о целесообразности нутриционной поддержки в период преконцепции и беременности, что обусловлено алиментарным дефицитом нутриентов даже у здоровых женщин оптимального репродуктивного возраста. Прием витаминноминерального комплекса с активной формой фолиевой кислоты (метафолином) в ранние сроки беременности, а со второго триместра в сочетании с полиненасыщенными жирными кислотами (докозагексоеновой) значительно улучшает акушерские и перинатальные исходы.








