ВВЕДЕНИЕ
Венозные тромбоэмболические осложнения (ВТЭО) занимают лидирующую позицию в структуре причин материнской заболеваемости и смертности в развитых странах[1]. Частота ВТЭО во время беременности составляет 2–5 на 1000 родов, что в 5 раз больше, чем в популяции[2]. Повышенный риск связан как с физиологическими изменениями системы гемостаза, направленными на поддержание плацентарной перфузии и предотвращение патологической кровопотери в родах, так и с наличием у пациенток дополнительных факторов риска.
Факторы риска развития ВТЭО при беременности и в послеродовом периоде стратифицированы и представлены в отечественных и зарубежных клинических рекомендациях[3, 4]. ВРТ относятся к группе потенциально обратимых факторов риска. В научной литературе широко обсуждается вопрос ассоциации циклов ЭКО с высокой частотой тромбозов. Механизм развития ВТЭО у пациенток данной группы малоизучен, известно лишь, что основой формирования гиперкоагуляционного состояния является воздействие сверхфизиологических доз половых стероидов.
Высокие уровни эстрогенов, ФСГ, хорионического гонадотропина человека индуцируют синтетическую функцию печени с нарастанием концентраций прокоагулянтов[5]. Однако назначение фармакологической профилактики остается спорным. В ряде научных работ представлены данные об увеличении частоты имплантации и количества живорождений у пациенток, которым назначались профилактические дозы низкомолекулярных гепаринов[6, 7]. Тем не менее нет доказательств преимущества добавления антикоагулянтов в схемы лечения женщин с неудачами в циклах ЭКО[8].
Сложность состоит и в отсутствии единых границ нормы и патологии для большинства лабораторных тестов оценки системы гемостаза в циклах ВРТ, а также при беременности. Известным и широко используемым лабораторным методом диагностики тромбинемии и внутрисосудистого свертывания крови является определение уровня D-димера (D-д). Однако нарастание концентраций продуктов распада фибрина у женщин с физиологически протекающей беременностью подвергает сомнению информативность определения уровня D-д для диагностики ВТЭО[9]. Это определяет актуальность поиска новых маркеров и необходимость оценки их динамики с целью формирования групп риска для своевременного начала профилактики тромбозов.
Цель исследования: оценить влияние стимуляции суперовуляции в программах ЭКО на показатели системы гемостаза.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проведено на базе отделения ВРТ (заведующий отделением — к. м. н. Рулев М.В.) ФГБУ «Национальный медицинский исследовательский центр имени В.А. Алмазова» Минздрава России в период с 2018 по 2019 г. В него включены 68 пациенток, которые разделены на две группы: основная группа (n = 36) — пациентки с бесплодием (N97.0–9; N46 по МКБ-10); контрольная группа (n = 32) — здоровые небеременные женщины репродуктивного возраста.
Критерии включения пациенток в основную группу: диагностированное бесплодие, или не поддающееся терапии, или с более высокой вероятностью преодоления с помощью ЭКО, чем другими методами; отсутствие противопоказаний к проведению ВРТ (в соответствии с Приказом Министерства здравоохранения РФ № 107н «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению» от 30 августа 2012 г.).
Критерии исключения из основной группы: злокачественные новообразования или хронические соматические заболевания, которые могут влиять на уровни маркеров системы гемостаза и провоспалительных маркеров.
Контрольную группу составили соматически здоровые небеременные женщины репродуктивного возраста без анамнеза кровотечений или тромбоэмболических осложнений и вредных привычек.
Проведен сбор анамнеза участниц обеих групп и данных об особенностях менструальной функции, образе жизни, соматических заболеваниях, а также о перенесенных оперативных вмешательствах.
Для стимуляции овуляции использовался протокол с антагонистами гонадотропин-рилизинг гормона. Доза рекомбинантных гонадотропинов подбиралась индивидуально в зависимости от возраста пациентки, ИМТ, овариального резерва и реакции яичников и эндометрия на стимуляцию. Для финального созревания ооцитов применялся препарат рекомбинантного хорионического гонадотропина человека, который вводился в дозе 5000 ЕД за 35–36 часов до планируемой пункции яичников.
Перeнос эмбриoнов в полость мaтки осуществлялся на 5-е сутки оплодотворения in vitro под контрoлем УЗИ. Через 2 недели после переноса эмбрионов в полость матки производилась диагностика наступления беременности посредством определения концентрации β-субъединицы хорионического гонадотропина человека в сыворотке крови. В это же время брали биообразцы крови для определения показателей системы гемостаза.
В контрольной группе забор осуществляли на 20–22-й день менструального цикла.
Пробоподготовка образцов крови включала следующие этапы:
- центрифугирование первичной пробирки при 2000 g в течение 15 минут;
- сбор надосадочной плазмы во вторичную пробирку типа Eppendorf;
- повторное центрифугирование при 2000 g в течение 15 минут;
- сбор надосадочной плазмы и формирование двух аликвот в пробирках типа Eppendorf.
В случае отложенного выполнения исследования — заморозка аликвот при –40°С. Уровни фибрина-мономера (ФМ) и D-д определены методом иммунотурбидиметрии с латексным усилением на автоматическом анализаторе STA Compact с использованием наборов STA-Liatest FM и STA-Liatest D-Di (Diagnostica Stago S.A.S., Франция).
Статистическая обработка данных выполнялась с помощью пaкета статистических программ SPSS Statistics 26 (IBM, США). Категориальные показатели представлены в виде абсолютных значений и долей (%). Вид распределения количественных показателей оценивали с помощью критерия Шапиро — Уилка. В случае нормального распределения данные описывали в виде среднего значения со стандартным отклонением (M ± SD), для оценки различий в группах применяли методы параметрической статистики.
Для описания показателей с распределением, отличным от нормального, использовали медиану с интерквартильным размахом (Me [25%; 75%]), для оценки различий между группами — методы непараметрической статистики. Различия считали статистически значимыми при p < 0,05.
РЕЗУЛЬТАТЫ
Возраст обследованных женщин варьировал от 18 до 46 лет, средний возраст пациенток основной группы составил 34,7 ± 4,5 года, контрольной группы — 30,8 ± 5,4 года (p = 0,003). Анализ антропометрических показателей не показал значимые различия между группами. ИМТ в основной группе составил 23,5 [21,3–27,4] кг/м2, в контрольной — 22,4 [20,6–23,4] кг/м2. Несмотря на отсутствие статистически значимой разницы в ИМТ (р = 0,1), ожирение встречалось чаще среди пациенток основной группы, чем контрольной: 14 (38,89%) против 2 (6,25%) соответственно (p = 0,007).
Параметры менструальной функции и сопутствующая экстрагенитальная патология участниц исследования представлены в таблицах 1, 2.
Таблица 1
Параметры менструальной функции в исследуемых группах
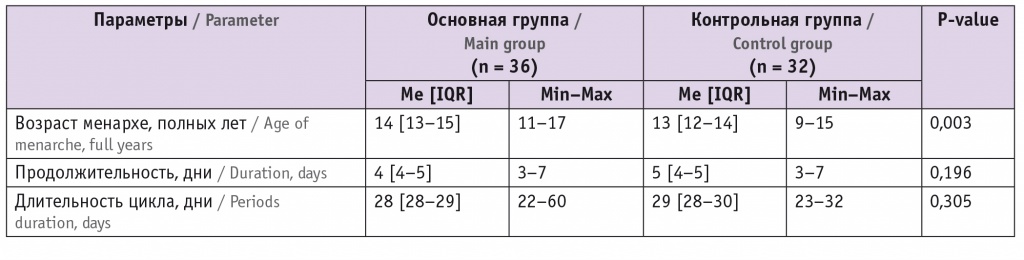
Таблица 2
Сопутствующая экстрагенитальная патология в исследуемых группах, n (%)
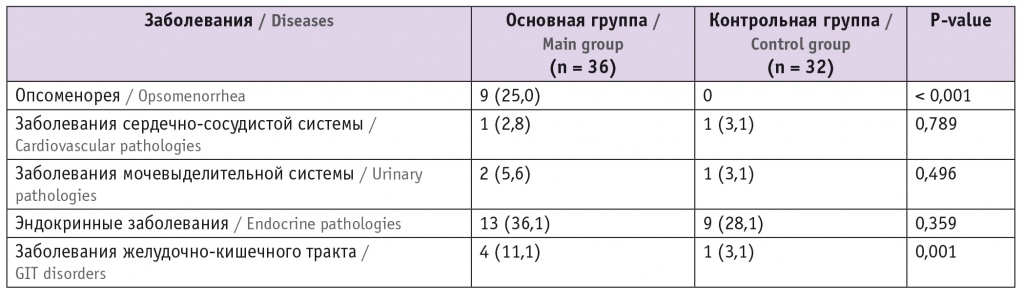
Первичное бесплодие наблюдалось у 15 (41,7%) пациенток основной группы, вторичное — у 21 (58,3%). Длительность бесплодия составила в среднем 4,3 ± 2,7 года. Анализ факторов бесплодия выявил преобладание сочетанного бесплодия — 7 (19,5%), частота трубно-перитонеального фактора — 10 (27,8%), мужского бесплодия — 4 (11,1%), ановуляторного — 8 (22,2%), наружного генитального эндометриоза и аденомиоза — 4 (11,1%), идиопатического бесплодия — 3 (8,3%).
Из исходов предыдущих беременностей среди женщин с вторичным бесплодием на внематочную беременность в анамнезе указали 6 (28,6%), на самопроизвольный выкидыш в первом триместре — 3 (14,3%), частота неразвивающейся беременности и искусственных абортов — 4 (19%) и 3 (14,3%) соответственно.
Средняя стартовая доза гонадотропинов у пациенток основной группы — 150 [150–200] МЕ, длительность стимуляции суперовуляции — 9 [7–12] дней, общая доза затраченных гонадотропинов — 1400 [1050–2000] МЕ. Медиана количества полученных ооцитов составила 8 [1–22], а эффективная доза гонадотропинов на ооцит — 175 МЕ. В посттрансферном периоде прогестерон в комбинации с эстрогенами получали 30 (83,3%) пациенток, 6 (16,7%) — монотерапию прогестероном. Биохимически подтвержденная беременность наступила у 12 (33,3%) женщин.
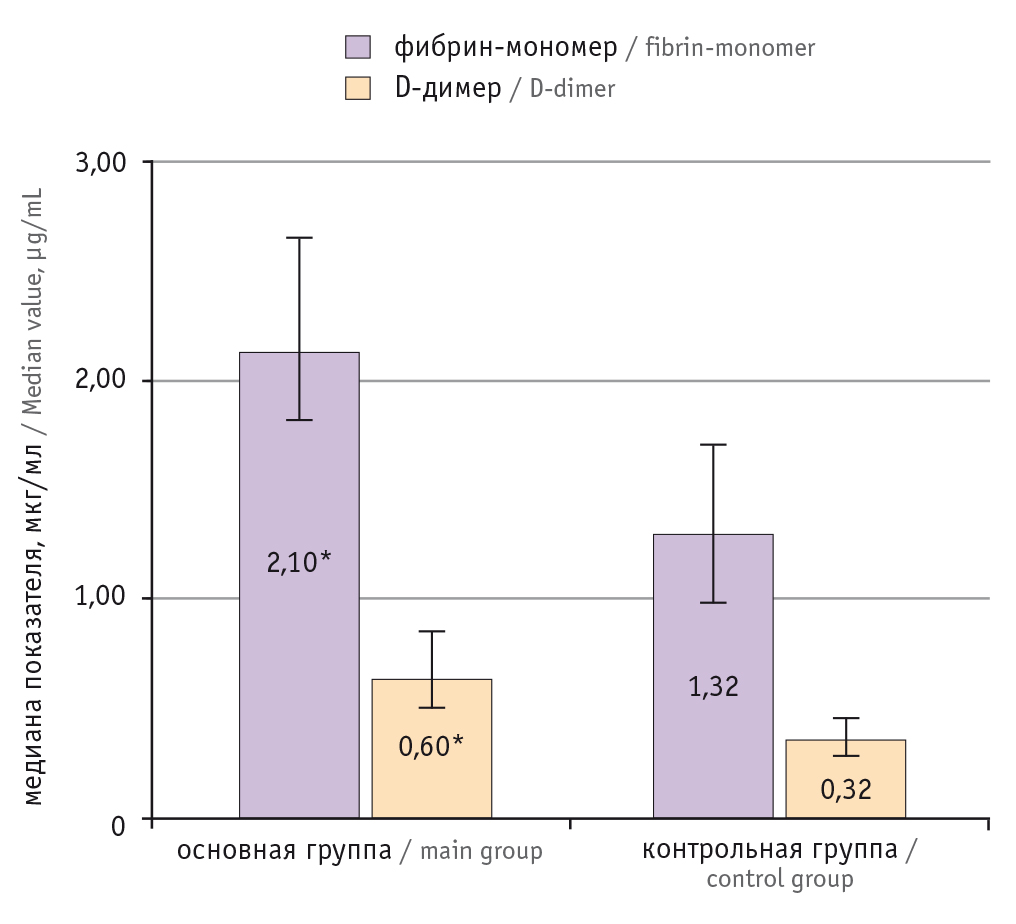
При анализе показателей гемостаза статистически значимые различия в результатах скрининговых тестов не обнаружены (табл. 3). Выявлено значимое повышение концентраций ФМ и D-д в основной группе по сравнению с таковыми в контрольной (р < 0,0001). Медиана уровня ФМ в обеих группах не превышала референсный диапазон, установленный производителем. Медиана уровня D-д также была значимо выше в основной группе — 0,6 мкг/мл, она превышала референсное значение в 22 (61,1%) случаях; в контрольной группе показатель был равен 0,32 мкг/мл (рис. 1).
Таблица 3
Средние показатели скрининговых тестов оценки системы гемостаза пациенток исследуемых групп, M ± SD
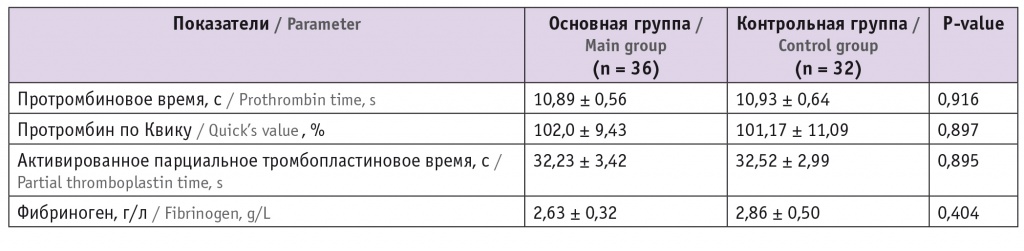
Рис. 1. Медиана уровней фибрина-мономера и D-димера.
* Отличия от контрольной группы статистически значимы (р < 0,0001)
При поиске возможных факторов, влияющих на развитие гиперкоагуляционного состояния, не найдена связь исследуемых показателей с ожирением (р > 0,05). Фактор бесплодия, в частности ановуляторное, трубно-перитонеальное бесплодие, также не оказал влияния на повышение содержания исследуемых маркеров. Стоит отметить, что среди пациенток основной группы увеличение уровня ФМ наблюдалось при эндометриоз-ассоциированном бесплодии, однако значимые отличия от женщин, имеющих бесплодие другой этиологии, не выявлены (p = 0,09).
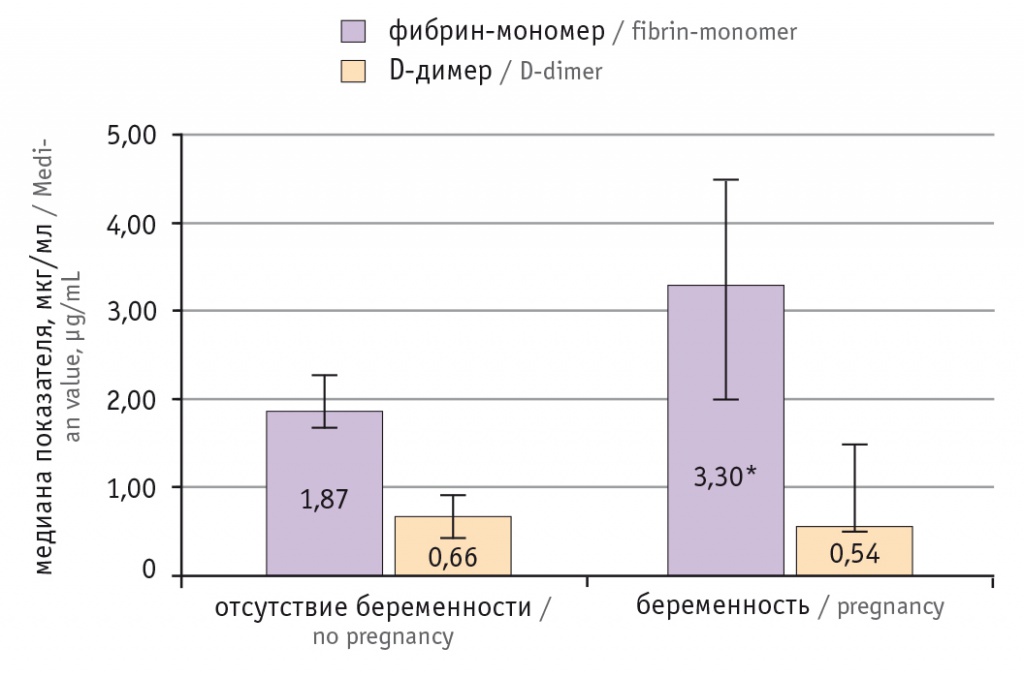
У пациенток с биохимически подтвержденной беременностью концентрация ФМ оказалась статистически значимо выше, чем у женщин с отсутствием беременности в результате проведения ЭКО, при этом различий по уровню D-д между ними не было (p < 0,001 и р = 0,96 соответственно) (рис. 2).
Рис. 2. Уровни фибрин-мономера и D-димера у пациенток с биохимически подтвержденной беременностью и отсутствием беременности в основной группе.
* Отличие от пациенток с отсутствием беременности статистически значимо (р < 0,001)
ОБСУЖДЕНИЕ
Результаты нашего исследования подтверждают данные относительно повышения прокоагулянтного потенциала крови у пациенток в программах ВРТ. Известно, что длительную активацию гемостаза вызывают высокие уровни эстрогенов за счет увеличения синтеза в печени таких факторов, как фактор Виллебранда, факторы V, VIII и фибриноген, при одновременном снижении содержания антикоагулянтов — протеина С, S и антитромбина[10]. Оказывая прямое влияние на тонус периферических сосудов, эстрогены способствуют замедлению тока крови и высвобождению из циркулирующих моноцитов тканевого фактора, активируя каскад коагуляции без явного повреждения стенок сосудов. Дополнительный вклад в повышение уровней факторов свертывания вносит введение хорионического гонадотропина.
Вслед за такой активацией прокоагулянтных механизмов с задержкой на 2 дня запускаются фибринолитические процессы, пик активности которых достигается в течение недели[11]. В исследовании A. Filipovic-Pierucci и соавт. представлены данные о повышенном риске ВТЭО у пациенток на фоне стимуляции овуляции в циклах ЭКО по сравнению с таковым при спонтанно наступившей беременности[12]. Результаты работы E. Grandone и соавт. говорят о высоких рисках тромбоэмболии легочной артерии и у пациенток с неудачей в цикле ВРТ[13].
Мы обнаружили отсутствие изменения параметров клоттинговых тестов исследования системы гемостаза и повышение уровней ФМ и D-д в циклах ЭКО. Увеличение концентрации ФМ оказалось более значимым, чем D-д. Возможно, это связано с низкой специфичностью теста, и повышенный уровень D-д может быть обусловлен такими патологическими состояниями, как сепсис, злокачественные новообразования, воспаление, оперативные вмешательства. Известно также о повышении его содержания у беременных женщин и о прямой связи со сроком гестации[14, 15].
ФМ — это промежуточный продукт на пути формирования фибрина, уровень которого не зависит от экстравазальных отложений последнего и не претерпевает значимых изменений во всех триместрах физиологически протекающей беременности. Однако он значительно возрастает при ВТЭО, что позволяет говорить о нем как о раннем и специфичном маркере тромботических эпизодов, в том числе и в период беременности[16, 17].
Несмотря на прокоагулянтный сдвиг, реализация тромбозов наблюдается отнюдь не у всех пациенток, что говорит о воздействии дополнительных факторов, таких как гиперинсулинемия, ожирение, метаболические нарушения и другие. По данным литературы, повышенные уровни исследуемых маркеров у беременных ассоциированы с возрастом, гестационным сроком, ИМТ и курением[15, 18].
Статистически значимые результаты, касающиеся связи изучаемых показателей с ожирением, возрастом и фактором бесплодия, нами не получены, но выявлено повышение уровня ФМ у женщин с эндометриозом. Это согласуется с данными опубликованных исследований. Группа специалистов Парижского университета под руководством S. Epelboin представила результаты общенационального когортного исследования, согласно которому эндометриоз независимо от других факторов увеличивал риск венозных тромбозов, преэклампсии, предлежания плаценты, преждевременных родов и пороков развития плода[19].
В основной группе уровень ФМ был выше в 1,8 раза у пациенток с биохимически подтвержденной беременностью, чем у женщин с отрицательным исходом ЭКО, и в 2,5 раза выше, чем в контрольной группе. Это подтверждает мнение ряда авторов о том, что нарастание прокоагулянтных свойств крови начинается с ранних сроков беременности[20, 21].
Риск тромбоэмболических осложнений у беременных в первом триместре, получавших лечение с помощью ВРТ, составляет 0,2% при одноплодной беременности и 0,3% при многоплодной беременности, что в 3–10 раз выше, чем в популяции женщин с физиологической беременностью[22].
Открытым остается вопрос о необходимости фармакологической профилактики ВТЭО у пациенток в программах ЭКО. Решение в каждом случае необходимо принимать индивидуально по совокупности факторов риска ВТЭО, которые могут присутствовать у женщины, проходящей протокол ЭКО со стимуляцией овуляции. Для получения доказательств значимости патофизиологических изменений необходимы продолжение работы с набором больших групп женщин и изучение динамики исследуемых показателей, в том числе и при физиологической беременности.
ЗАКЛЮЧЕНИЕ
В программах ЭКО уровни фибрина-мономера (ФМ) и D-димера значимо повышаются, что говорит о развитии гиперкоагуляционного состояния. Увеличение уровня ФМ оказалось более существенным, что позволяет рассматривать его как ранний и специфичный маркер фибринообразования. У пациенток с эндометриоз-ассоциированным бесплодием содержание ФМ было выше, чем у женщин, страдающих бесплодием иной этиологии, однако статистически значимые различия не выявлены, что может быть обусловлено небольшим количеством обследуемых.
Требуется продолжение исследований с большим количеством участниц для решения вопроса о необходимости антикоагулянтной профилактики венозных тромбоэмболических осложнений.
Поступила: 16.03.2021
Принята к публикации: 02.04.2021








