Значению гестационного СД (ГСД) и преэклампсии (ПЭ) в структуре материнских и перинатальных осложнений посвящено множество работ[1–5]. Ежегодно ПЭ становится причиной более 50 000 материнских смертей и более 500 000 смертей плода во всем мире[6]. Помимо материнских и плодовых осложнений, ПЭ также снижает качество и продолжительность жизни матери, способствует инвалидизации в результате тяжелого течения и присоединения тромботических микроангиопатий, увеличивает риск послеродовой депрессии[7]. Немаловажную роль отводят ПЭ и в эпигенетическом программировании. Так, дети женщин, перенесших ПЭ, подвержены повышенному риску сердечно-сосудистых и метаболических заболеваний в более позднем возрасте[8].
Что касается СД, то неуклонный рост его частоты в мировой популяции уже назвали пандемией XXI века[9]. По данным Международной федерации диабета, в 2019 году у каждой 5-й роженицы во всем мире был выявлен ГСД. Его наличие связано с многочисленными неблагоприятными исходами беременности. Женщины с ГСД подвергаются высокому риску развития СД 2 типа, особенно через 3–6 лет после родов. Воздействие гипергликемии в утробе матери предрасполагает детей к набору избыточной массы или к ожирению, связанному с формированием СД 2 типа1.
КЛИНИКО-АНАМНЕСТИЧЕСКИЕ ФАКТОРЫ РИСКА
На сегодняшний день имеется достаточно данных о влиянии клинико-анамнестических факторов на риск развития ПЭ у пациенток с ГСД. Так, ретроспективное популяционное исследование типа «случай — контроль», включающее 40 673 женщин с первыми и вторыми одноплодными последовательными родами, выявило, что такие осложнения, как преждевременные роды (15,0 против 7,7%), низкая масса при рождении (17,9 против 10,3%), перинатальная смертность (3,2 против 1,1%) и ГСД (7,0 против 2,7%), возникающие при первой беременности, являются факторами риска первичной ПЭ при второй беременности. Таким образом, первая беременность может послужить окном возможностей для выявления женщин, подверженных риску ПЭ в будущем[10].
На вероятность развития ПЭ также влияют длительность ГСД и степень его компенсации. Ранний ГСД (до 20 нед) более тесно ассоциирован с возникновением ПЭ, нежели поздний (после 20 нед) (9,2 против 7,7% соответственно)[11]. Однако стоит сделать оговорку: женщины с ранним началом ГСД имели значительно более высокий средний возраст и прегестационный ИМТ, чем женщины без ГСД, но сопоставимые с таковыми в группе позднего начала ГСД[12].
Что касается степени компенсации ГСД, то возраст и прегестационный ИМТ также прямо коррелируют с риском ПЭ у пациенток с ГСД. ОШ развития ПЭ у женщин с ГСД между двумя возрастными когортами — 26–30 и 36–40 лет — возрастает более чем двукратно (1,14 и 2,53 соответственно). А ОШ возникновения ПЭ в зависимости от прегестационного ИМТ увеличивается примерно в 2 раза при повышении ИМТ на одну степень, по классификации ВОЗ[13].
Фактором риска ПЭ является и этническая принадлежность. В исследовании J. Immanuel и соавт. (2021) ПЭ/эклампсия чаще встречались среди женщин Тихоокеанского региона и маори, чем среди европейских женщин (14,0 и 8,1% соответственно, p < 0,001)[14].
Чрезмерный прирост массы тела у пациенток с ГСД тоже становится фактором риска ПЭ[15, 16]. В исследовании M. Lewandowska и соавт. (2020) он увеличивал риск возникновения ПЭ в 8,61 раза. А пороговое значение ИМТ, выше которого значительно повышался риск ПЭ, было 23,1 кг/м2[17].
Любопытно, что среди пациенток с ранним ГСД у тех, кто получал лечение инсулином до 22 недель, до проведения перорального глюкозотолерантного теста (ПГТТ), частота развития ПЭ была меньше (1,2 против 2,6% в группе не получавших лечение)[18]. Данный феномен объясняется лучшим контролем уровня гликемии инсулинотерапией (ИТ), нежели диетой, и позволяет рассматривать гипергликемию как фактор риска ПЭ при ГСД.
Это предположение подтверждается результатами исследования, в котором беременные с аномальным уровнем глюкозы как натощак, так и спустя 2 часа после ПГТТ имели более высокий риск ПЭ, чем женщины с изолированным аномальным уровнем глюкозы натощак или изолированным отклонением спустя 2 часа после ПГТТ[19].
Некоторые проспективные когортные исследования и один метаанализ показали, что уровень гликированного гемоглобина (HbA1c) ≥ 5,9% на ранних сроках беременности значимо ассоциировался с риском ПЭ[20–22]. Более того, в одном из них имеются данные о том, что уровень HbA1с 5,5–5,9% является независимым от наличия ГСД фактором риска ПЭ, но у женщин с ГСД этот риск выше[22].
Следует также отметить, что вероятность развития ПЭ при ГСД в 3,4 раза выше у женщин с ожирением[23], поскольку патофизиологические метаболические изменения при ожирении и ГСД во многом схожи, включают окислительный стресс и метавоспаление, которые связаны с возникновением ПЭ[24].
Несомненным триггером метаболических нарушений следует считать и синдром поликистозных яичников (СПЯ). Женщины с СПЯ имеют повышенную резистентность к инсулину и гиперандрогенемию. СПЯ увеличивает частоту ГСД и ПЭ независимо от ожирения[25]. Распространенность ПЭ значительно выше у пациенток с ГСД в сочетании с СПЯ, чем у женщин без него. Риск оказался в 2–3 раза выше после корректировки на такие факторы, как возраст, ИМТ до беременности и паритет[26]. Однако есть данные, что СПЯ не является независимым фактором риска ПЭ, так как частота ПЭ у пациенток с СПЯ в группе ГСД была значительно выше, чем в группе без ГСД[27].
ПЛАЦЕНТАРНЫЙ МЕТАБОЛИЗМ
Плацента, орган, выполняющий функцию плодово-материнского интерфейса, участвует в поддержании иммунного, гуморального, метаболического, реологического и гемодинамического гомеостаза в обоих организмах. Нарушения, возникающие как первично во время инвазии трофобласта, так и вторично, связанные с состоянием материнского организма (декомпенсацией хронических заболеваний) и затрагивающие функцию плаценты, вносят вклад в развитие ГСД и ПЭ. Установлено, что при ПЭ нарушается баланс ангиогенных и антиангиогенных факторов в сторону последних.
Повышаются концентрации в крови растворимой fms-подобной тирозинкиназы 1 (sFlt-1) и растворимого эндоглина (sENG), снижаются уровни плацентарного (PlGF) и вазоэндотелиального факторов роста (VEGF) (поскольку они переходят в связанное с sFlt-1 неактивное состояние), а также трансформирующего фактора роста β1 (TGF-β1) (становится связанным sENG) в ответ на персистирующую гипоксию, вызванную недостаточной трансформацией маточных артерий, или на оксидативный стресс не связанного с плацентацией генеза. Дисбаланс этих факторов вызывает состояние системной сосудистой дисфункции, эндотелиоза и приводит к нарушению реологических свойств крови в микрососудистом русле, АГ и протеинурии[28].
Интересная находка, иллюстрирующая влияние степени тяжести ГСД на уровни ангиогенных факторов, приведена в работе Р.В. Капустина. Так, индекс sFlt-1/PlGF в группе пациенток с ГСД на фоне диетотерапии составлял в среднем 19,56 (6,62–32,5), а у пациенток с ГСД на фоне ИТ — 72,42 (29,16–115,68). Максимальные значения данного индекса приближались к минимальным в группе женщин с ПЭ, в которой данный индекс варьировал от 122,95 до 190,84[13].
Наконец, более высокое соотношение sFlt1/PlGF в крови у женщин с ПЭ на фоне ГСД связано с начальными признаками ПЭ, хотя и характеризуется менее тяжелой эндотелиальной дисфункцией с точки зрения ангиогенных биомаркеров[29]. По данным А.М. Nuzzo и соавт., более выраженное смещение ангиогенного профиля в сторону антиангиогенного фактора зарегистрировано в группе женщин с изолированной ПЭ.
При ГСД обусловленная гипергликемией повышенная экспрессия инсулиновых рецепторов A и B (IR-A и IR-B) в плаценте вызывает пролиферацию клеток посредством сигнального пути ERK, за счет чего увеличивается масса плода и самой плаценты. Избыток свободного инсулиноподобного фактора роста 1 (IGF-I), активируя собственный рецептор, запускает тот же путь пролиферации, что и активация инсулином IR-A. С другой стороны, связывание инсулина с IR-B способствует транслокации инсулин-зависимого белка-переносчика глюкозы GLUT-4 из эндосом на поверхность цитоплазматической мембраны клетки. Увеличение числа каналов переноса глюкозы на поверхности клеток плаценты повышает захват глюкозы, что также приводит к макросомии.
Гиперэкспрессия рецептора лептина на поверхности клетки через активацию сигнального белка STAT3 индуцирует транскрипцию VEGF, металлопротеиназ MMP-2 и MMP-9, провоспалительных цитокинов (ФНО-α, ИЛ-1α, ИЛ-1β, ИФН-α, ИФН-γ), что создает воспалительную микросреду в плаценте. Оба эти компонента — воспалительный и пролиферативный — приводят к инсулинорезистентности (ИР) и лептинорезистентности, а также могут объяснить механизмы формирования периферической эндотелиальной дисфункции, которая выявляется при ГСД[30].
АНГИОГЕННЫЙ ДИСБАЛАНС
Морфологическое исследование плацент пациенток с ГСД, проведенное I. Carrasco-Wong и соавт. в 2020 году, показало гиперваскуляризацию ворсинок, часто ассоциированную с утолщением капилляров в незрелых ворсинках[31]. Разнообразные экспериментальные данные указывают на то, что гипергликемия способствует ангиогенезу, сужению сосудов и повышению проницаемости их стенок[32, 33]. Таким образом, гипергликемия при ГСД тесно связана с повреждением сосудов, эндотелиальной дисфункцией и аберрантным, чрезмерно стимулированным плацентарным ангиогенезом. Все эти изменения вызывают серьезное повреждение эндотелия, что, в свою очередь, приводит к нарушению сосудистой системы матери и плода[30].
Фетальные капилляры ворсинок плаценты особенно уязвимы к любым изменениям в материнской крови при ГСД[34], при котором увеличено содержание различных вазоактивных веществ. Так, в настоящее время хорошо известно, что повышенный при гипергликемии уровень ФНО-α активно стимулирует выработку плазмой и эндотелием активных форм кислорода и токсичных конечных продуктов гликолиза[35], которые повреждают макро- и особенно микроциркуляторную сеть и могут способствовать тромботическим и атеросклеротическим явлениям, приводящим к задержке роста плода и дистрессу плода, несмотря на удовлетворительные данные ультразвуковой плацентометрии[36].
Кроме того, выдвинуто предположение, что описанное повреждение эндотелия, сопровождающееся возрастанием скорости ангиогенеза и разветвлением ворсинок хориона, повышает периферическое сосудистое сопротивление. Это может быть одним из механизмов развития ПЭ у пациенток с ГСД[37].
Сегодня принято разделять ПЭ по времени ее возникновения на раннюю и позднюю, поскольку предполагаемые этиопатогенетические механизмы двух этих подтипов различаются. ПЭ с ранним началом возникает из-за нарушения инвазии трофобласта, особенно первой волны, в то время как ПЭ с поздним началом (с 34 недели) может быть связана с декомпенсацией уже существующих сердечно-сосудистых и метаболических заболеваний[38].
МЕТАБОЛИЧЕСКИЕ НАРУШЕНИЯ
Логично предположить, что при ГСД ПЭ развивается по позднему типу, поскольку в ее основе лежат нарушение метаболизма и преждевременное старение плаценты за счет накопления конечных продуктов гликолиза. Однако все зависит от времени начала воздействия гипергликемии. Так, результаты недавнего исследования показали, что в условиях гипергликемии в синцитиотрофобласте значительно снижена экспрессия генов, связанных с дифференцировкой: hCG, GCM1 и синцитина 1, что напрямую влияет на формирование плаценты. А в цитотрофобласте гипергликемия подавляла скорость метаболизма: на 44% снижалось окислительное фосфорилирование, на 55–60% гликолиз, на 39% содержание АТФ, а также увеличивались количество и объем липидных капель[39].
Существуют и контраверсионные данные касательно метаболизма глюкозы: у пациенток с ГСД за счет ингибирования микроРНК miR-9 и miR-22 повышается экспрессия GLUT-1 и HK2 (гексокиназа 2 — фермент «первого шага» метаболизма глюкозы) в клетках вневорсинчатого трофобласта, за счет чего увеличиваются поглощение глюкозы, секреция лактата, жизнеспособность клеток и подавляется апоптоз[40]. Эти данные согласуются с описанным выше усилением пролиферации тканей плаценты в условиях гипергликемии, но не объясняют полноты и однозначности метаболизма глюкозы в тканях плаценты при ГСД.
В свою очередь, в плацентах пациенток с ПЭ выявлено повышение содержания ферментов, связанных с гликолизом: α-енолазы (ENOA), глицеральдегид-3-фосфатдегидрогеназы (G3P), фосфоглицераткиназы 1 (PGK1) и 3-меркаптопируватсульфотрансферазы (THTM), что свидетельствует в пользу гипотезы о метаболических аномалиях плаценты как о механизме, характерном для подтипа ПЭ с поздним началом[41]. Обнаружено также избыточное содержание аполипопротеинов в плацентах пациенток с ПЭ, что указывает на нарушение регуляции биосинтеза липидов и белков и путей их транспорта, как и в случае ГСД, о чем было сказано выше[42].
Анализ протеома и ацетилома плацент пациенток с ПЭ (одна группа) и ГСД (другая группа) выявил значительное повышение уровней ацетилированных белков, участвующих в стрессе эндоплазматического ретикулума (ЭР) и механизмах ферроптоза в обеих группах[43]. Примечательно, что ферроптоз поддерживает метавоспаление и стресс ЭР за счет железозависимого окисления липидов. Имеются данные о непосредственном влиянии ферроптоза на развитие ПЭ и ухудшение перинатальных исходов у пациенток с ГСД[44].
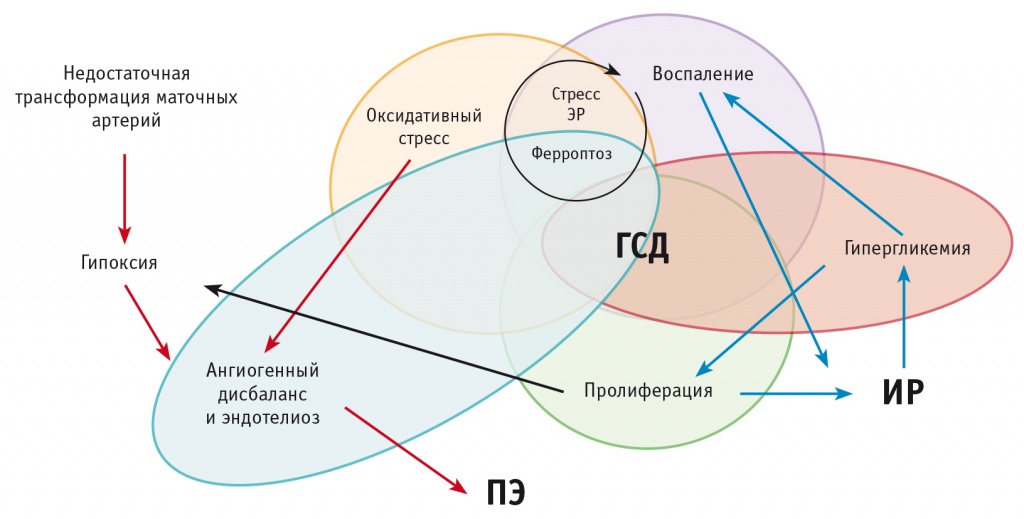
Общность патогенеза ПЭ и ГСД показана на рисунке. Пролиферация и воспаление как результаты гипергликемии при ГСД потенцируют рост ИР, увеличивая уровень гликемии. Воспаление посредством стресса ЭР и ферроптоза тесно связано с механизмами оксидативного стресса, приводящими к ангиогенному дисбалансу и эндотелиозу — прямому молекулярно-клеточному субстрату ПЭ. Возникающая из-за гипергликемии пролиферация клеток ворсин хориона также приводит к гипоксии — классической причине ангиогенного дисбаланса и эндотелиоза при ранней ПЭ.
Рис. Взаимосвязь плацентарных патогенетических механизмов преэклапсии и гестационного сахарного диабета.
Примечание: ГСД — гестационный сахарный диабет, ИР — инсулинорезистентность, ПЭ — преэклапсия, ЭР — эндоплазматический ретикулум
ЗАКЛЮЧЕНИЕ
На сегодняшний день большинством ученых гестационный СД (ГСД) признан фактором риска развития преэклапсии (ПЭ). У женщин с ГСД наличие синдрома поликистозных яичников и/или ожирения (повышенного прегестационного ИМТ) также увеличивает риск ПЭ. В подавляющем большинстве случаев развивается поздний тип ПЭ.
Все больше исследований подтверждают прямую связь степени декомпенсации ГСД (уровней гликемии, гликированного гемоглобина) с риском ПЭ. Предполагаемая патогенетическая общность ГСД и ПЭ заключается в наличии окислительного стресса и метавоспаления, усиливающих инсулинорезистентность и вызывающих эндотелиальную дисфункцию. И если эндотелиальная дисфункция при ГСД возникает в условиях метавоспаления, что уже можно считать аксиомой, то метаболические нарушения при ПЭ имеют куда более сложный механизм. Наиболее хорошо изученным патогенетическим звеном ПЭ является ангиогенный дисбаланс. При ГСД также повышается индекс sFlt-1/PlGF, причем в случае ГСД на фоне инсулинотерапии отмечается более выраженное увеличение индекса, сопоставимое с таковым в группе ПЭ.
Поступила: 27.02.2023
Принята к публикации: 27.03.2023
________
1 International Diabetes Federation. IDF Diabetes Atlas, 10th ed. 2021. URL: https://www.diabetesatlas.org (дата обращения — 13.03.2023).








