ВВЕДЕНИЕ
Преэклампсия (ПЭ) — мультисистемное патологическое состояние, которое регистрируется у 2–8% беременных, и его распространенность не имеет тенденции к снижению. Эффективные методы антенатальной терапии отсутствуют, ПЭ занимает 2–3-е место в структуре причин материнской смертности в мире [1]. В настоящее время доминируют пять классических гипотез патогенеза ПЭ: ишемия и гипоксия плаценты или трофобласта, повреждение эндотелия сосудов, окислительный стресс, иммунная дезрегуляция и генетическая детерминация [2], которые клинически реализуются в два фенотипа заболевания: с ранней (до 34 недели гестации) и поздней (после 34 недели) манифестацией. Механизмы формирования этих типов осложненного течения беременности различны, что, безусловно, определяет различные подходы к их прогнозированию [3].
Накоплена значительная библиотека специфических лабораторных биомаркеров, дисбаланс которых рассматривается как предикция развития ПЭ. Ученые из Китая проанализировали 20 потенциальных биомаркеров риска развития ПЭ [2, 3]. Наиболее информативным оказался дисбаланс биологически активных веществ, таких как антиангиогенный протеин — плацентарная растворимая fms-подобная тирозинкиназа 1 (sFlt-1), фактор роста сосудистого эндотелия (vascular endothelial growth factor) и плацентарный фактор роста (placental growth factor, PIGF), изменения уровней которых более специфичны для срока гестации 16–18 недель.
Наряду с изучением биомаркеров значительное число работ посвящено исследованию кровотока в маточных артериях и сонографическим характеристикам плаценты для стратификации пациенток в группу риска развития ПЭ. Отмечена достаточная информативность исследования пульсационного индекса в сроки гестации 19–23 недели [4, 5]. Относительно прогностической значимости аномальных сонографических плацентарных вариантов (толщины, длины, площади и объема плаценты) выводы исследователей неоднозначны [6-8].
Сочетание материнских клинических факторов риска, данных исследования биологических маркеров (PIGF и PAPP-A) и пульсационного индекса маточных артерий определено Международной ассоциацией акушеров и гинекологов как лучший комбинированный прогностический тест для оценки вероятности возникновения ПЭ в группе женщин высокого риска [3]. Однако отсутствие данных по одному из параметров в полном комбинированном тесте приведет к снижению эффективности скрининга. Кроме того, данный тест неэффективен у женщин с низким риском развития заболевания. Необходимость поиска ультразвуковых предикторов формирования ранней ПЭ в группе низкого риска ее развития определила цель нашего исследования.
Цель исследования: выявить предикторы развития ранней ПЭ, по данным плацентометрии, при проведении ультразвукового скрининга в сроки гестации 19–21 неделя у женщин низкого риска ПЭ.
МАТЕРИАЛЫ И МЕТОДЫ
В исследовании типа «случай — контроль», которое проводилось на базе КГБУЗ «Алтайский краевой клинический перинатальный центр» г. Барнаула (главный врач — к. м. н., главный внештатный акушер-гинеколог Алтайского края Молчанова И.В.) в 2020–2021 гг., участвовали 80 беременных женщин. Использовался парно-сопряженный метод отбора (метод «копи-пара»). Основную группу составили 40 пациенток с реализовавшейся ранней ПЭ, родоразрешенные по тяжести заболевания в сроки гестации 28–32 недели. В контрольную группу включены 40 женщин, беременность которых закончилась родами в срок через естественные родовые пути доношенными новорожденными без признаков гипотрофии.
Критерии включения в исследование: первые предстоящие роды, одноплодная беременность, возраст матери до 35 лет, отсутствие соматических заболеваний, таких как АГ, СД, повышения массы тела (ИМТ не более 25 кг/м2 до момента наступления беременности), принадлежность к европейской расе.
Критерии исключения: беременность, наступившая в программах ВРТ, репродуктивные потери в анамнезе, семейная история ПЭ, генетическая и приобретенная тромбофилия.
УЗИ в сроки гестации 19–21 неделя (второй ультразвуковой скрининг) производилось на сканере экспертного класса GE Voluson E10 трансабдоминально с использованием конвексного объемного датчика RAB6-D с частотой 2–8 МГц. УЗИ осуществляли два специалиста, проводящие не менее 1000 исследований в год в учреждении 3-го уровня оказания акушерско-гинекологической помощи, имеющие сертификаты Фонда медицины плода (FMF). Эти сертификаты позволяют производить расчеты риска акушерских осложнений в программе Astraia.
Толщину плаценты (Thp) измеряли в месте прикрепления пуповины. При этом датчик располагался перпендикулярно плоскости плаценты в области прикрепления пуповины. Длину плаценты (Lp) в декретируемые сроки второго ультразвукового скрининга определяли путем идентификации плаценты в ее продольной плоскости по максимально длинной оси с последующей установкой каллиперов на две наиболее удаленные точки по краям плаценты и измерением линейного размера. При расположении плаценты в дне матки с переходом на переднюю и/или заднюю стенки длина плаценты измерялась суммой двух линейных размеров, начинающихся от краев плаценты и встречающихся в центре.
Индекс плацентарного отношения (PRi) измерялся в миллиметрах и рассчитывался по формуле: PRi = Lp/Thp.
Проведение исследования одобрено решением локального этического комитета ФГБОУ ВО АГМУ Минздрава России, протокол № 8 от 25.10.2019 г.
Статистическая обработка данных осуществлялась с использованием пакета статистического программного обеспечения MedCalc Version 17.9.7 (лицензия BU556-P12YT-BBS55-YAH5M-UBE51). Нормальность распределения вариационных рядов оценивали с помощью теста Шапиро — Уилка (Shapiro-Wilk’s W-test). Необходимо отметить, что числовые переменные рядов данных (длина и толщина плаценты, выраженные в миллиметрах) не имели нормального распределения. В связи с этим данные плацентометрии (в миллиметрах) представлены в виде медианы (Ме), 95%-ного ДИ для медианы и интерквартильного размаха [25-й и 75-й перцентили, или Q1–Q3]. Рассчитывался также 95%-ный референсный интервал для показателей плацентометрии. Сравнение рядов выполняли с применением непараметрических методов. Критический уровень значимости различий определен как p < 0,05.
РЕЗУЛЬТАТЫ
Медиана возраста пациенток контрольной группы составила 28 (95%-ный ДИ: 24,0–33,1) лет, основной — 27 (95%-ный ДИ: 22,0–34,3) лет. Группы были сопоставимы по клиническим характеристикам и социальному статусу.
Медиана Lp в контрольной группе — 146,5 мм (95%-ный ДИ: 144,0–149,3 мм), в основной — 149,5 мм (95%-ный ДИ: 146,0–151,7 мм) (р = 0,2743). Медиана Thp в контрольной группе — 22,0 мм (95%-ный ДИ: 21,0–22,7 мм), в основной — 19,0 мм (95%-ный ДИ: 18,0–20,0 мм), разница показателей была статистически значимой (р < 0,0001).
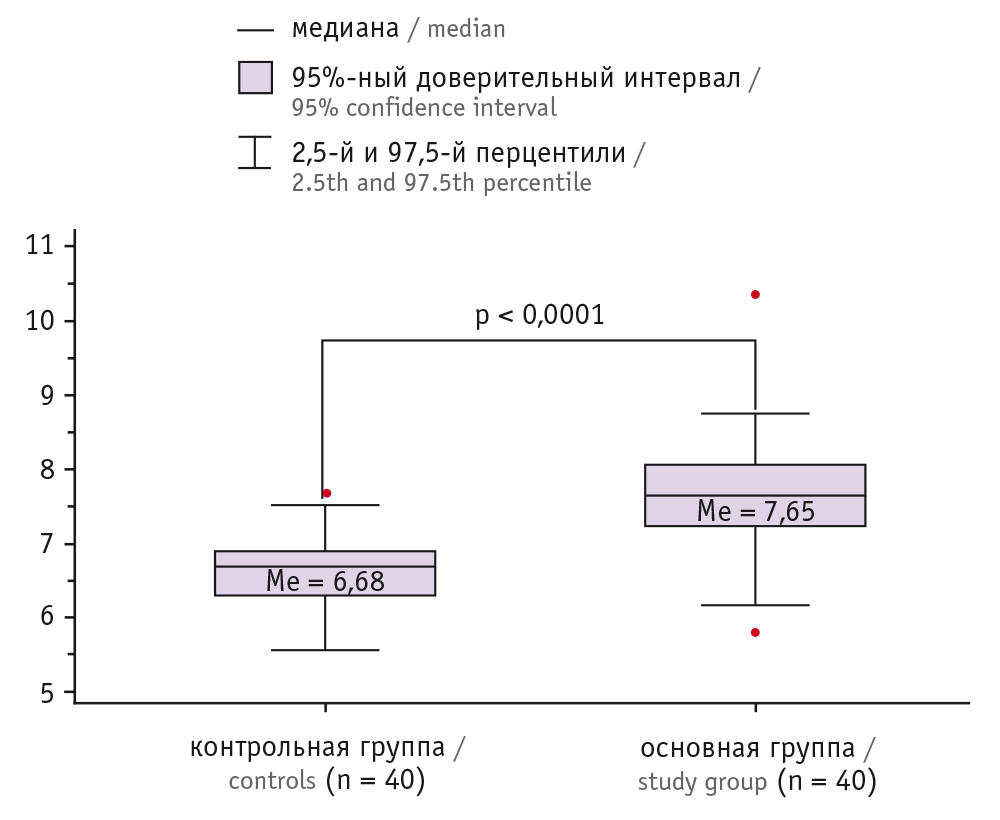
Медиана PRi в контрольной группе равнялась 6,68 мм (95%-ный ДИ: 6,31–6,74 мм; Q1–Q3: 6,31–6,86; 95%-ный референсный интервал: 5,79–7,61), в основной группе — 7,65 (95%-ный ДИ: 7,41–7,75; Q1–Q3: 7,22–8,08; 95%-ный референсный интервал: 5,97–9,56), разница также оказалась статистически значимой (рис. 1).
Рис. 1. Медиана индекса плацентарного отношения, определенного в сроки гестации 19–21 неделя при физиологическом течении беременности (контрольная группа) и при реализации ранней преэклампсии (основная группа)
Поскольку показатели Thp (Ме) и PRi (Ме) статистически значимо различались в группах сравнения, проведен комбинированный ROC-анализ для определения более информативного теста (рис. 2). Согласно нашим расчетам, прогностическая способность PRi (Ме) более значима.
Рис. 2. Результаты комбинированного ROC-анализа показателей толщины плаценты (Ме Thp) и индекса плацентарного отношения (Ме PRi), определенных в сроки гестации 19–21 неделя с целью прогнозирования ранней преэклампсии
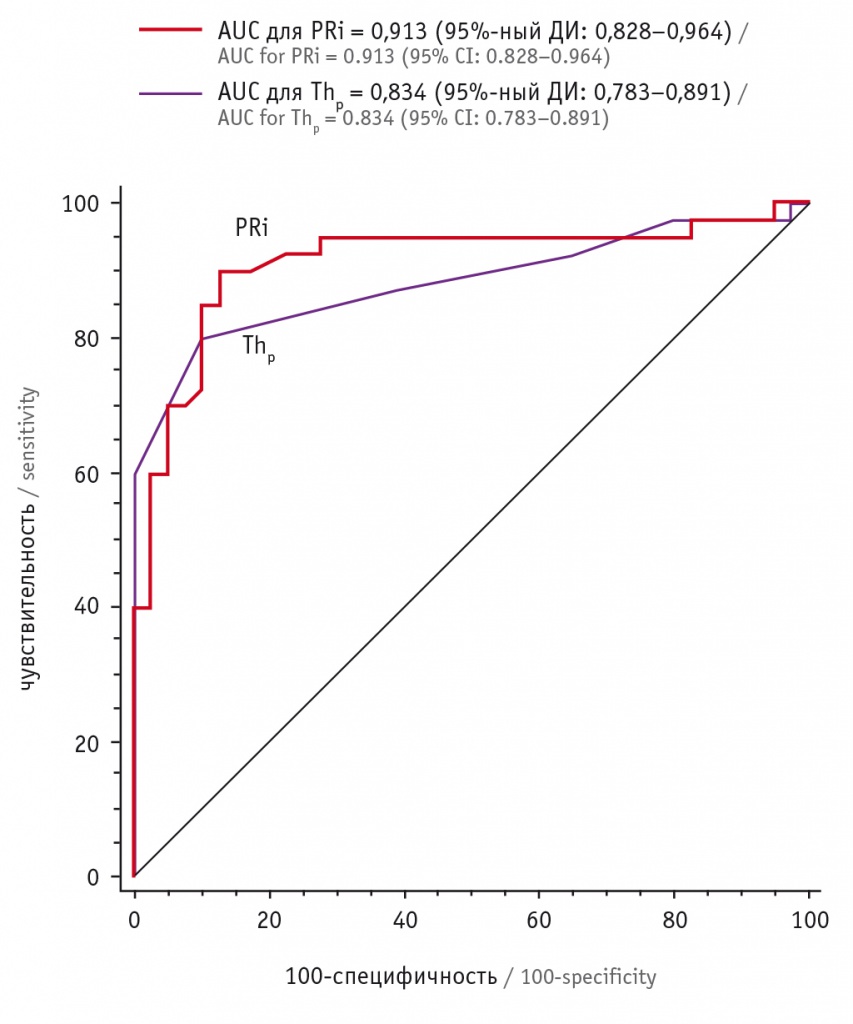
Расчет порогового показателя PRi показал, что при значении PRi ≥ 7 прогностическая способность модели составляет 91,3% при чувствительности теста 90% и специфичности 87,5%.
Валидация предсказательной способности аналитической модели проведена на 150 пациентках низкой группы риска развития ПЭ. Все они проходили скрининговое УЗИ в Центре антенатальной охраны плода на базе КГБУЗ «Алтайский краевой клинический перинатальный центр» г. Барнаула. При проведении первого ультразвукового скрининга и расчете риска акушерских осложнений в программе Astraia1 у всех пациенток риск возникновения ПЭ до 37 недель беременности расценен как низкий (1 из 279–1073). Во время второго ультразвукового скрининга в сроки гестации 19–21 неделя рассчитывался PRi.
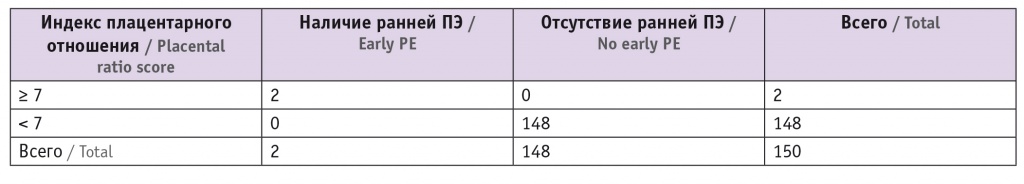
В 148 случаях медиана PRi составила 6,4 (95%-ный ДИ: 6,2–6,6). Из 148 беременностей 140 закончились родами в сроке гестации 38–41 неделя, в 8 случаях зарегистрированы преждевременные роды в сроках 35 и 36 недель, инициированные дородовым излитием околоплодных вод. В 2 (1,3%) наблюдениях PRi превышал пороговый показатель — 8,75 и 7,68 (табл.).
Таблица
Анализ валидации предсказательной способности аналитической модели по прогнозированию ранней преклампсии (ПЭ)
Безусловно, полученные данные преждевременно экстраполировать на всю популяцию беременных женщин. Но простота и доступность представленной технологии, на наш взгляд, требуют внимания, дальнейшего изучения и анализа.
ОБСУЖДЕНИЕ
В настоящее время в качестве факторов высокого риска развития ПЭ рассматриваются гипертензивные расстройства во время предыдущей беременности (ОШ = 7,19; 95%-ный ДИ: 5,85–8,83) и хроническая гипертензия, хронические заболевания почек и СД 1 и 2 типов (ОШ = 3,56; 95%-ный ДИ: 2,54–4,99), а также аутоиммунные заболевания, в частности антифосфолипидный синдром (ОШ = 9,72; 95%-ный ДИ: 4,34–21,75) [9]. Именно такие пациентки подлежат стратификации для проведения дополнительных диагностических и профилактических мероприятий в отношении развития поздней ПЭ. В основе возникновения ранней ПЭ лежат другие патогенетические механизмы, которые в первую очередь реализуются в аномальной сонографической картине плаценты и/или в патологических доплеровских индексах [10, 11].
В представленном исследовании участницы обеих групп не имели традиционных факторов высокого риска ПЭ. При ретроспективном расчете риска акушерских осложнений в программе Astraia2 у всех пациенток риск возникновения ПЭ до 37 недель беременности расценен как низкий (1 из 279–1073).
Проведение ультразвукового скрининга в сроки гестации 19–21 неделя регламентировано Приказом Министерства здравоохранения Российской Федерации от 20.10.2020 г. № 1130н «Об утверждении Порядка оказания медицинской помощи по профилю “акушерство и гинекология”», его проходят все беременные. Анализу подлежат фетометрические и анатомические характеристики плода, локализация плаценты с указанием особенностей ее расположения относительно внутреннего зева и области рубца на матке (при наличии кесарева сечения в анамнезе), количество околоплодных вод, длина цервикального канала, а также область придатков. При этом, несмотря на простоту выполнения, плацентометрия не проводится. В то же время двухмерное ультразвуковое изображение дает достоверную информацию о расположении и размерах плаценты.
В ранее представленных работах сонометрические характеристики плаценты неоднократно рассматривались как маркер неблагоприятных акушерских или перинатальных исходов.
В работе 2010 года исследователи из больницы Пенсильванского университета (Филадельфия) рассчитали различные показатели и коэффициенты отношений, характеризующие плаценту в сроке гестации 11–14 недель. Полученные значения, включая Thp, были значительно ниже у пациенток с последующим развитием ПЭ и задержки роста плода [12].
Положительную ассоциацию между Thp и последующим появлением гестационных осложнений показали в своем исследовании C. Vachon-Marceau и соавт. (2017). Увеличение Thp на УЗИ в сроки 11–13 недель беременности значимо ассоциировалось с риском развития поздней ПЭ, в то время как ее снижение было значимым предиктором задержки роста плода [8]. На умеренную связь Thp с риском ПЭ указывают в своем исследовании W.D. Wan Masliza и соавт. (2017) [13].
Нами также получена статистически значимая ассоциация между снижением Thp, определенной в сроке 19–21 неделя беременности, с риском развития ранней ПЭ, что согласуется с данными A. Hasija и соавт. (2021). Исследователи проводили плацентометрию в сроки гестации 20–24 недели. При этом уменьшение Thp расценено как наиболее значимый и достоверный маркер развития ПЭ (р < 0,0001) [14].
Нами предпринята попытка рассчитать референсные интервалы для Lp во время второго ультразвукового скрининга у пациенток с благоприятным завершением беременности в сроке более 37 недель здоровыми новорожденными. Lp у них составила 125–167 мм при медиане 146,5 мм. При анализе Lp (диаметра плаценты) в группе с реализованной ПЭ 95%-ный референсный интервал был идентичен — 120–167 мм при медиане 149,5 мм. Поскольку Lp (диаметры плаценты) оказались сопоставимыми, это позволило нам считать PRi тем показателем, который имел максимальную прогностическую значимость в отношении развития ПЭ в группе пациенток низкого риска.
Хотя многие исследователи единодушны во мнении, что состояние плаценты напрямую связано с материнскими и перинатальными исходами [7, 15-17], морфологическая оценка плаценты в настоящее время не включена в существующие программы скрининга плацентарных осложнений. Представленное исследование демонстрирует, что УЗИ плаценты может быть полезным для прогнозирования развития ранней ПЭ.
ЗАКЛЮЧЕНИЕ
Проведение плацентометрии в сроки гестации 19–21 неделя с расчетом индекса плацентарного отношения при длине (диаметре) плаценты 120–167 мм позволяет прогнозировать развитие ранней преэклампсии у пациенток низкого риска и своевременно стратифицировать беременных для проведения дополнительных обследований и профилактических мероприятий.
Поступила: 28.10.2021
Принята к публикации: 26.11.2021
________
1 Fetal Medicine Foundation. Risk for preeclampsia. 2021. URL: https://fetalmedicine.org/research/assess/preeclampsia/first-trimester (дата обращения — 20.07.2021).
2 Fetal Medicine Foundation...








