Часть 2 настоящей статьи будет опубликована в журнале «Доктор.Ру» Гинекология. 2020. Т. 19. № 8.
ВВЕДЕНИЕ
Преэклампсия (ПЭ) как одна из главных причин материнской смертности во всем мире относится к важнейшим проблемам акушерства. Схожесть основной симптоматики заставляет проводить клинические параллели между ПЭ и хронической болезнью почек (ХБП). Отмечаются и высокая распространенность обоих заболеваний среди трудоспособной части женского населения, и неблагоприятные отдаленные последствия. Недостаточно изучены патогенетические аспекты изолированных патологических процессов и их сочетаний. Особые диагностические трудности возникают при сочетании этих двух патологических процессов[1, 2].
Наибольшее значение в изучении патогенеза ПЭ имеет расшифровка механизмов реализации процессов эндотелиальной дисфункции, генерализованного сосудистого спазма, системного воспаления и перекисного окисления как основных механизмов, наиболее информативными клиническими признаками которых по-прежнему считаются АГ и протеинурия[2–6]. Интенсивная микроциркуляция в почках обусловливает максимально негативное воздействие вызываемых ПЭ сосудистых изменений.
Фиксация ранних признаков нарушения функции почек и своевременное начало профилактических мероприятий способны улучшить текущие и отдаленные прогнозы ПЭ. Выявление у беременных факторов риска ПЭ, описанных в литературе, позволяет лишь предположить развитие указанных нарушений на более поздних сроках гестации. Использующиеся в клинической практике рутинные лабораторные показатели не отображают минимальные (доклинические) изменения функции почек, обнаружение которых необходимо для предиктивной диагностики и уверенного утверждения о риске развития ПЭ.
С учетом высокой частоты нарушения функции почек во время беременности целесообразно внедрить определение современных биомаркеров повреждения почек в акушерскую практику. В связи с трудностью дифференциальной диагностики между ПЭ и первичными почечными изменениями у беременных на основании только клинической картины необходимо исследовать биомаркеры ангиогенеза (растворимую FMS-подобную тирозинкиназу 1 (sFlt-1), плацентарный фактор роста (PlGF), S-эндоглин), изменение содержания которых патогенетически отражает механизмы возникновения ПЭ.
Цель исследования: оценить прогностическую значимость, чувствительность и специфичность биомаркеров острого повреждения почек (ОПП) и ангиогенных факторов в развитии ПЭ, а также определить их значение в патогенезе ранней и поздней формы ПЭ для ее дифференциальной диагностики с изолированной почечной дисфункцией.
МАТЕРИАЛЫ И МЕТОДЫ
Настоящее исследование проведено в период с сентября 2015 г. по сентябрь 2018 г. в акушерском отделении патологии беременности клиники акушерства и гинекологии ФГБОУ ВО «ПСПбГМУ им. акад. И.П. Павлова» Минздрава РФ на базе кафедры акушерства, гинекологии и неонатологии. Специальные исследования проводились в подразделениях ФГБОУ ВО «ПСПбГМУ им. И.П. Павлова»: центральной межклинической лаборатории, лаборатории гомеостаза НИИ нефрологии.
В первый этап исследования включили 122 беременных, из них у 46 (37,7%) имелась ХБП. У всех исследуемых осуществлены скрининговый забор сыворотки крови и мочи при сроке беременности 10–14 и 16–24 недели, банкирование полученного биоматериала, а также анализ анамнестических данных, выявление факторов риска развития ПЭ.
Целью второго этапа исследования стал поиск дифференциально-диагностического критерия ХБП и ПЭ. Из 122 пациенток у 36 зафиксирована ПЭ, определен средний срок манифестации и произведены забор и банкирование сыворотки крови.
У 46 пациенток с клинически значимой протеинурией (> 0,3 г/24 ч), выявленной до настоящей беременности либо при первом посещении врача и постановке на учет в женской консультации, а также у 40 соматически здоровых женщин с физиологическим течением беременности (контрольная группа) при высчитанном ранее среднем сроке манифестации ПЭ в основной группе и группе сравнения также осуществлены забор и банкирование сыворотки крови. Далее проанализированы концентрации sFlt-1, PlGF в группах, проведен логистический регрессионный анализ, построена ROC-кривая и определены пороговые значения (cutoff point). На основании изменений концентраций ангиогенных факторов выявлен дифференциально-диагностический критерий ПЭ и ХБП.
В связи с продолжающимся сбором материала после получения результатов второго этапа исследования в третий этап удалось включить еще 16 беременных с ХБП. На третьем этапе проведено проспективное исследование.
На основании дифференциально-диагностического критерия и исходов беременности 138 пациенток были разделены на три группы, причем 14 женщин из группы сравнения были переведены в основную группу: I группа (основная) — 66 (47,8%) пациенток с развитием гипертензивных расстройств при беременности (1-я подгруппа — 30 (21,7%) женщин с ХБП, 2-я подгруппа — 36 (26,1%) пациенток без ХБП); II группа (сравнения) — 32 пациентки с ХБП без гипертензивных расстройств; III группа (контрольная) — 40 пациенток с физиологическим течением данной беременности и неосложненным репродуктивным анамнезом.
Критерии включения в основную группу:
- наличие гипертензивных расстройств, впервые выявленных либо прогрессирующих при настоящей беременности после 20 недель гестации, подтвержденное данными клинико-лабораторных исследований (систолическое АД ≥ 140 мм рт. ст. и/или диастолическое АД ≥ 90 мм рт. ст., определенное как среднее в результате как минимум двух измерений, проведенных на одной руке через 15 минут);
- одноплодная беменность, наступившая в естественном цикле, осложненная развитием клинически значимой протеинурии (≥ 0,3 г/24 ч либо ≥ 0,3 г/л в разовой порции мочи, взятой с интервалом 6 часов);
Критерии включения в группу сравнения:
- повреждение почек продолжительностью более 3 месяцев, которое проявлялось структурными или функциональными нарушениями деятельности органа со снижением или без снижения скорости клубочковой фильтрации (СКФ) (наличие данных патоморфологических изменений почечной ткани, маркеров повреждения почек, изменения анатомического строения по данным инструментальной визуализации органа);
- одноплодная беременность, наступившая в естественном цикле.
Критерии включения в контрольную группу:
- отсутствие почечной дисфункции в анамнезе и по данным лабораторного обследования;
- отсутствие гипертензивных расстройств при настоящей беменности;
- одноплодная беменность, наступившая в естественном цикле.
Во всех трех группах критериями исключения являлись:
- многоплодная беременность;
- хромосомные аномалии и пороки развития плода;
- беременность, наступившая в результате использования ВРТ;
- хроническая никотиновая и/или алкогольная интоксикация;
- СД, ревматоидный артрит, бронхиальная астма, ХОБЛ, нейродегенеративные заболевания;
- острое воспалительное или обострение хронического заболевания за 2 недели до включения в исследование;
- анурия;
- резус-конфликт.
Проводились анализ структуры экстрагенитальной заболеваемости и акушерско-гинекологического анамнеза, стандартное лабораторное обследование всех участниц. АД измеряли стандартным методом Н.С. Короткова. Согласно клиническим рекомендациям Минздрава России «Гипертензивные расстройства во время беременности, в родах и послеродовом периоде. Преэклампсия. Эклампсия» (2016)[7], критериями диагностики АГ считали систолическое АД ≥ 140 мм рт. ст. и/или диастолическое АД ≥ 90 мм рт. ст. (среднее в результате как минимум двух измерений на одной руке через 15 минут). При этом умеренную АГ диагностировли при систолическом АД от 140 до 159 мм рт. ст. и/или диастолическом АД от 90 до 109 мм рт. ст., а тяжелую АГ — при систолическом АД ≥ 160 мм рт. ст. и/или диастолическом АД ≥ 110 мм рт. ст.[8].
Содержание цистатина С в сыворотке крови определяли с помощью диагностического набора DiaSys (Германия) иммуно-турбидиметрическим тестом. Нормальные значения — 0,58–1,02 мг/мл. Для оценки фильтрационной функции почек по формуле F.J. Hoek и соавт. (2003) рассчитывали СКФ:
СКФ [мл/мин/1,73 м2] = (80,35/цистатин С [мг/мл]) – 4,32.
СКФ измеряли также с помощью стандартных формул Cockcroft — Gault и MDRD.
Количественное определение нейтрофильного желатиназо-ассоциированного липокалина (NGAL) в сыворотке крови основано на «сэндвич»-методе ИФА BioVendor Human Lipocalin-2/NGAL ELISA. Уровнь α1-микроглобулина в сыворотке крови оценивали с помощью иммуноферментных наборов Immundiagnostik методом ИФА, уровень β2-микроглобулина — при помощи тест-системы ELISA фирмы Cusabio Biotech (количественный ИФА типа «сэндвич»).
Концентрации факторов sFlt-1, PlGF и S-эндоглина в сыворотке крови также измеряли методом твердофазного «сэндвич»-ИФА с использованием коммерческих наборов Elecsys, Cobas e601 (Roche, Германия). Анализ выполнялся в точном соответствии с рекомендациями фирмы-производителя. Проведен анализ всех образцов сыворотки в дублетах, для статистической обработки применялось среднее арифметическое из двух полученных значений оптической плотности.
Содержание эндоглина определялось иммуноферментными наборами R & D systems (США), молекулы повреждения почек 1 (KIM-1) — методом количественного твердофазного «сэндвич»-ИФА (Quantikine Human TIM-1 Immunoassay), уровень подокаликсина в моче — тем же методом при помощи тест-системы ELISA (Cloud-Clone Corp.).
Все данные, полученные в результате сбора анамнеза, объективного, лабораторного, инструментального и специального биохимического обследования вносились в электронную карту, созданную в приложении Microsoft Excel 2016. Статистическая обработка выполнялась на персональном компьютере с применением специального статистического программного обеспечения SPSS Statistics 22.0 для операционных систем Windows.
Для оценки и сравнения средних величин в ходе работы выбран ранговый коэффициент корреляции по Спирмену — он использовался для выявления связи (корреляции) между различными переменными. Для большинства показателей при оценке достоверности между средними значениями выборок, а также для определения степени корреляции рассчитывалась вероятность ошибки р.
Подготовка данных для дальнейшего анализа выполнялась с помощью SNP_tools версии 1.61 — свободно распространяемого расширения для MS Excel. Статистическая обработка определенных данных также осуществлялась в свободно распространяемом программном продукте WINPEPI версии 10.8. Для определения статистической значимости различий применялся критерий Манна — Уитни для несвязанных совокупностей.
РЕЗУЛЬТАТЫ
В таблице 1 приведена клиническая характеристика обследованных женщин. Заболевания почек представлены следующими нозологиями: верифицированное до беременности поражение клубочков (IgA-нефропатия) — 10 (16,1%), диффузные заболевания соединительной ткани — 15 (24,2%), единственная почка — 11 (17,7%), хронический нефритический синдром — 21 (33,9%), трансплантированная почка — 3 (4,9%), мультикистозное поражение почек — 1 (1,6%), гипоплазия почки — 1 (1,6%). На этапе включения беменных в исследование у 38 из них была диагностирована ХБП I стадии, у 4 — ХБП II ст., у 2 — ХБП IIIа ст., у 2 — ХБП IV ст. У 16 включенных в четвертый этап исследования женщин с ХБП диагностирована I стадия заболевания.
Таблица 1
Клиническая характеристика обследованных женщин
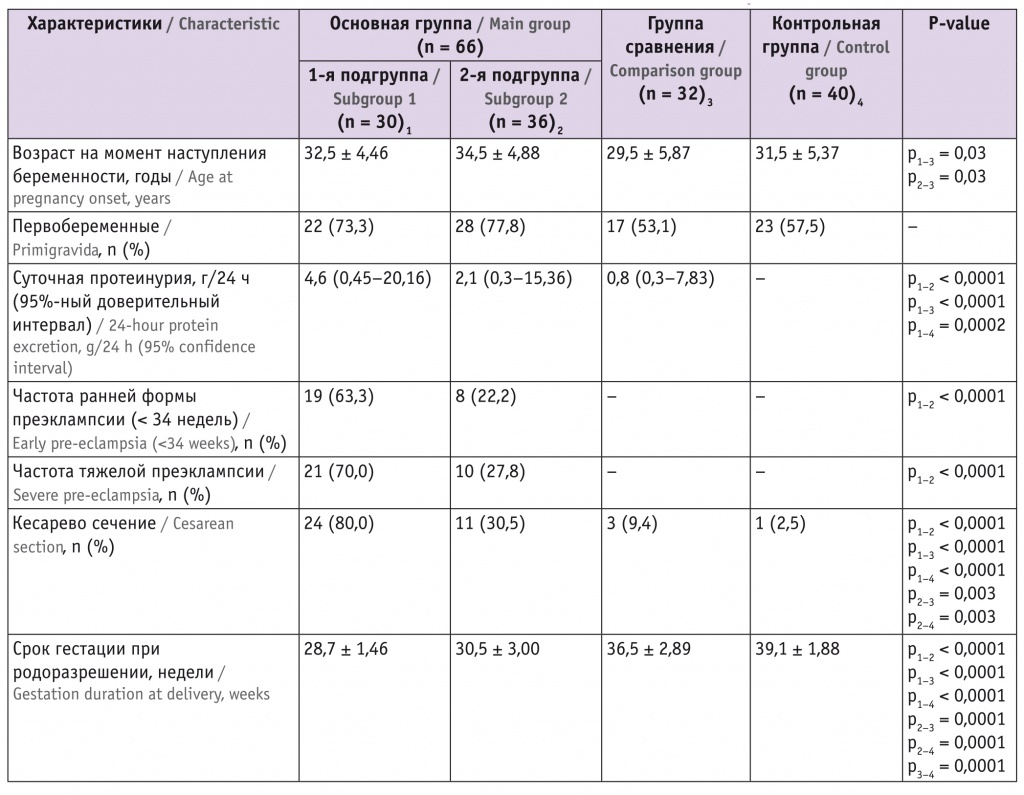
Протеинурии у пациенток контрольной группы не было, в подгруппе пациенток с ХБП, у которых развилась ПЭ, она была значительно выше, чем в группе сравнения (ХБП без ПЭ) и у пациентток с ПЭ без ХБП. Клинические исходы в обеих подгруппах женщин с ПЭ отличались от таковых у участниц контрольной группы и группы сравнения и были менее благоприятными при ПЭ и сопутствующими заболеваниями почек.
Выявление дифференциально-диагностического критерия преэклапсии и хронической болезни почек. С патофизиологической точки зрения логично предположить, что концентрации ангиогенных факторов в сыворотке будут отличаться у пациенток с ХБП от таковых у беременных с развившейся ПЭ. Согласно данной гипотезе, баланс sFlt-1/PlGF должен быть нормальным у беременных с ХБП, несмотря на протеинурию или гипертензию.
Уровень белка sFlt-1 у пациенток с ПЭ был значительно увеличен по сравнению с таковыми в группе сранения и контрольной (в 6,8 и 5,4 раза соответственно), а концентрация сывороточного PlGF — значительно уменьшена (в 13,1 и 8,6 раза соответственно, p < 0,0001). Между группой сравнения и контрольной группой существенные различия не найдены.
Анализ ROC-кривой показал, что пороговая концентрация (cut off point) sFlt-1 для различия ПЭ и ХБП — 7715 пг/мл (чувствительность — 97%, специфичность — 96%), а PlGF — 88,15 пг/мл (чувствительность — 90%, специфичность — 100%).
Отношение sFlt-1/PlGF в основной группе было значимо выше, чем в группе сравнения и контрольной группе (относительная кратность увеличена в 25 раз в обоих случаях, p < 0,0001). При анализе ROC-кривой найдено пороговое значение отношения sFlt-1/PlGF для различия ПЭ и ХБП, равное 150,25 (чувствительность — 100%, специфичность — 100%). Тем не менее, поскольку нет перекрытия пределов, любое значение между 137,69 и 160,9 может быть в равной степени использовано для дифференицального диагноза двух патологических состояний.
Таким образом, проведенное исследование доказало патогенетические различия ассоциированных с беременностью осложнений при ХБП и ПЭ. При ПЭ их патогенез связан с первичным дефектом плацентации, а причиной изменений, характерных для эндотелиоза гломерул в сочетании с признаками их тромботической микроангиопатии, проявляющейся тромбозом капилляров, является генерализованная эндотелиальная дисфункция, развивающаяся на фоне свободной циркуляции в материнском кровотоке избыточно-продуцируемой ишемизированной плацентой sFlt-1.
В совокупности эти патологические процессы ухудшают гломерулярную проницаемость капилляров и уменьшают площадь поверхности фильтрации, что приводит к снижению СКФ с нарушением фильтрационной функции почек и появлением протеинурии.
В случае ХБП патогенез происходящих в почках изменений связан с основным заболеванием, при котором концентрации маркеров плацентации значимо не отличаются от таковых при нормально протекающей беременности.
Сравнительная характеристика концентраций биомаркеров в I триместре беременности, их прогностическое значение для преэклампсии. C целью прогнозирования ПЭ и ее клинических форм у пациенток всех групп в сыворотке крови определены концентрации биомаркеров ОПП и ангиогенных факторов в сроки первого пренатального скрининга (I триместр — 10–14 недель) (табл. 2).
Таблица 2
Концентрации биомаркеров в сыворотке крови пациенток в 10–14 недель беременности, Ме (25-й и 75-й перцентили)
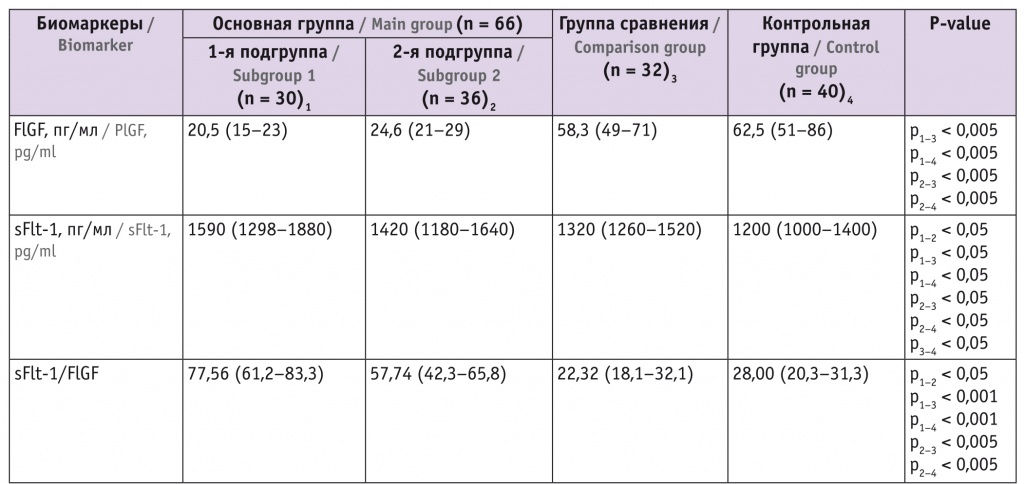
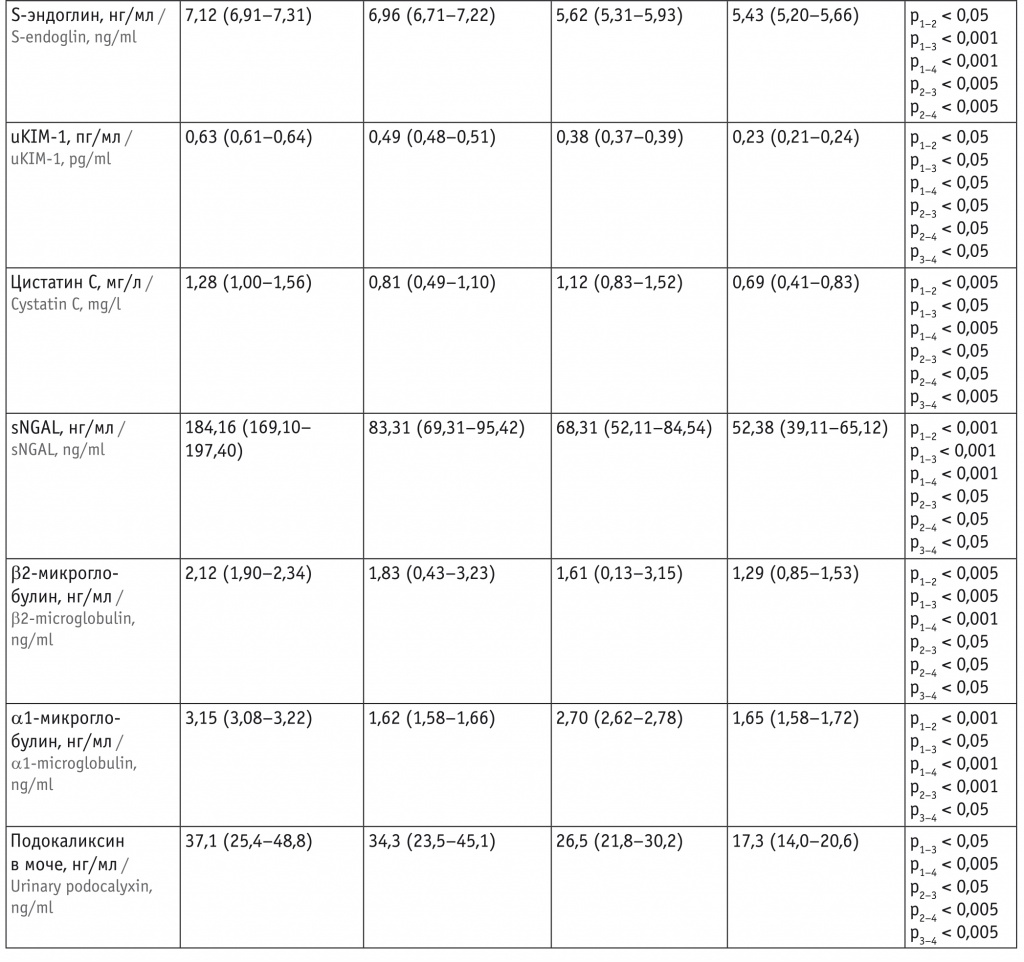
В конце I триместра наблюдались статистически значимое (в 3 раза) снижение содержания PlGF в сыворотке крови беременных 1-й группы, повышение в 1,3 раза концентрации антиангиогенного фактора sFlt-1 по сравнению с показателями контрольной группы. Соотношение sFlt-1/PlGF у женщин 1-й подгруппы с преимущественным развитием ранней формы ПЭ было увеличено в 3,5 раза в сравнении с таковым у пациенток с ХБП без ПЭ. В этой же подгруппе в I триместре зафиксирован значимый рост уровней маркеров ОПП: sNGAL, uKIM-1, α1- и β2-микроглобулина, подокаликсина и цистатина С. Содержание S-эндоглина имело отклонение от показателей пациенток других групп, однако статистически незначимое.
При анализе зависимости исследуемых маркеров от срока клинической манифестации ПЭ выявлено, что совокупность преобладания антиангиогенного компонента (sFlt-1) над проангиогенным (PlGF) и повышенных концентраций маркеров ОПП (uKIM-1, sNGAL, β2- и α1-микроглобулина, подокаликсина мочи) статистически значимо характерна при появлении основных симптомов до 34 недель беременности (р < 0,05).
По результату проведенного ROC-анализа (рис. 1, 2) наибольшей чувствительностью и специфичностью обладает метод определения отношенияя sFlt-1/PlGF при максимальной точности (94%) и значимости отрицательного прогностического значения (95,4%), что не менее важно при прогнозировании, так как нормальное отношение sFlt-1/PlGF у беременных в 10–14 недель с высокой (95,4%) вероятностью свидетельствует об отcутствии риска ПЭ.
Рис. 1. ROC-кривая: ангиогенные факторы (I триместр беременности)
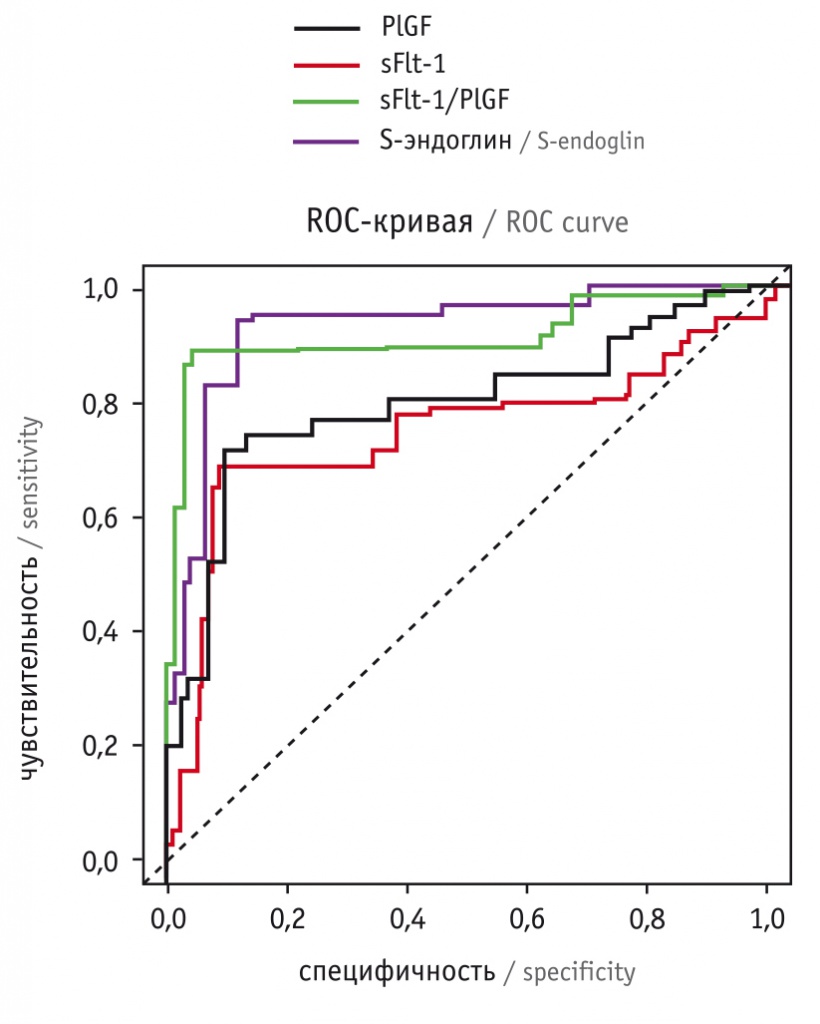
Рис. 2. ROC-кривая: маркеры острого повреждения почек (I триместр беременности)
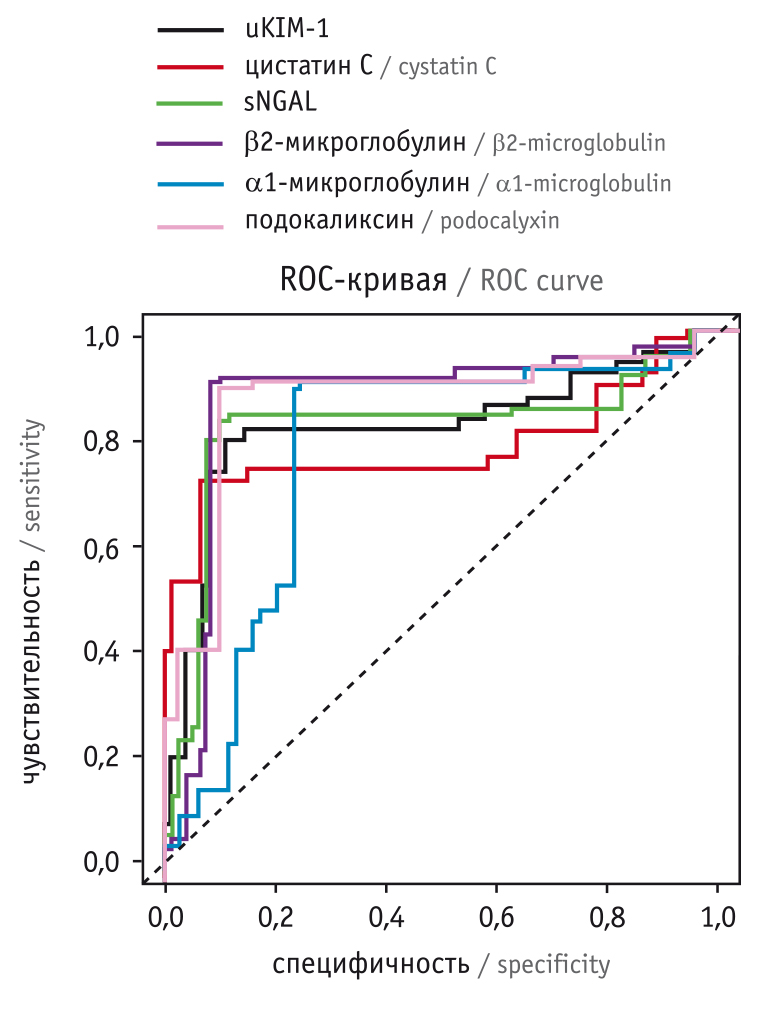
Методы оценки концентрации отдельных ангиогенных факторов (sFlt-1, PLGF, S-эндоглина) на ранних сроках гестации имеют меньшие чувствительность, специфичность, точность, положительное и отрицательное прогностическое значение по сравнению с определением отношения sFlt-1/PlGF. Поэтому для прогнозирования ПЭ в I триместре беременности рекомендовано использование показателя sFlt-1/PlGF.
ЗАКЛЮЧЕНИЕ
Значение sFlt-1/PlGF ≥ 150,25 может являться дифференциально-диагностическим критерием преэклампсии (ПЭ) у пациенток при наличии АГ и клинически значимой протеинурии. Мы предполагаем, что использование выявленного нами дифференциально-диагностического критерия и определение содержания изучаемых маркеров в периферической крови и моче могут быть эффективными как для диагностики уже развившейся ПЭ, так и для прогноза ее возникновения. Это предположение основано на выявлении изменения концентраций изучаемых факторов еще до появления первых клинических признаков заболевания. Многомерный статистический анализ также показал влияние про- и антиангиогенных факторов на клинические проявления ПЭ. Взаимосвязь ангиогенных факторов с основными маркерами острого повреждения почек позволяет нам говорить о роли факторов ангиогенеза в развитии ПЭ и их значении в формировании почечной дисфункции.
Поступила: 16.03.2020
Принята к публикации: 18.05.2020








