ВВЕДЕНИЕ
Преэклампсия (ПЭ) является одной из главных причин материнской смертности во всем мире. Существует сходство основной симптоматики ПЭ и хронической болезни почек (ХБП) — это развитие гипертензии как одного из ключевых клинических симптомов. Фиксация ранних признаков нарушения функции почек и, как следствие, своевременная терапия гипертензивных расстройств, обусловленных ХБП, могут служить профилактикой и улучшить текущий и отдаленный прогноз ПЭ в I и II триместрах беременности.
Дифференциальная диагностика между ПЭ и первичной почечной патологией у беременных на основании клинической картины сложна, поэтому исследование биомаркеров ангиогенеза (растворимой FMS-подобной тирозинкиназы 1 (sFlt-1), плацентарного фактора роста (PlGF), S-эндоглина) позволяет уже в ранние сроки беременности выявить на основании изменений их содержания риски возникновения эндотелиальной дисфункции как ключевого патогенетического механизма развития ПЭ.
Таким образом, изучение раннего патологического изменения функции почек во время беременности при помощи биомаркеров в сыворотке крови (далее — биомаркеры) является актуальным направлением как для акушерства и гинекологии, так и для нефрологии. Оно поможет понять патофизиологические процессы в почках во время беременности при различных состояниях и будет способствовать ранней диагностике ПЭ.
Цель исследования: оценить прогностическую значимость, чувствительность и специфичность биомаркеров острого повреждения почек (ОПП) и ангиогенных факторов в развитии ПЭ во II триместре беременности.
МАТЕРИАЛЫ И МЕТОДЫ
Настоящее исследование проведено в период с сентября 2015 г. по сентябрь 2018 г. в акушерском отделении патологии беременности клиники акушерства и гинекологии ФГБОУ ВО «ПСПбГМУ им. акад. И.П. Павлова» Минздрава РФ на базе кафедры акушерства, гинекологии и неонатологии. Специальные исследования проводились в подразделениях ФГБОУ ВО «ПСПбГМУ им. И.П. Павлова» Минздрава РФ: центральной межклинической лаборатории, лаборатории гомеостаза НИИ нефрологии.
Критерии включения и исключения из исследования, описание пациенток на первом–третьем этапах приведены в части 1 настоящей статьи. Задачами четвертого этапа исследования, представленного в настоящей статье, стали ретроспективный анализ уровней биомаркеров в сыворотке крови, сравнение с полученными в I триместре результатами (см. часть 1 данной статьи) и оценка их прогностической значимости в развитии ПЭ у беременных с ХБП и без нее.
На четвертом этапе (ретроспективно) критерием включения в I (основную) группу стало пороговое значение соотношения sFlt-1/PlGF ≥ 150,25, в группу сравнения — исключение гипертензивных расстройств при беременности на основании дифференциально-диагностического критерия соотношения sFlt/PlGF < 150,25.
Участницы исследования были родоразрешены в клинике акушерства и гинекологии ФГБОУ ВО «ПСПбГМУ им. акад. И.П. Павлова» Минздрава России.
Проведены также клинико-лабораторное обследование всех включенных в исследование пациенток, измерение АД, уровней sFlt-1, PlGF, S-эндоглина, цистатина С, uKIM-1, подокаликсина, α1- и β2-микроглобулинов, выполнены фето- и доплерометрия. Прослежены акушерские и перинатальные исходы.
Статистическая обработка выполнялась на персональном компьютере с применением специального статистического программного обеспечения SPSS Statistics 22.0 для операционных систем Windows. Для оценки и сравнения средних величин использовался коэффициент корреляции по Спирмену. Для большинства показателей при оценке достоверности различий между средними значениями выборок, а также для определения степени корреляции рассчитывалась вероятность ошибки р.
Подготовка данных для проведения дальнейшего анализа выполнялась с помощью SNP_tools версии 1.61 — свободно распространяемого расширения для MS Excel. Статистическая обработка определенных данных также проводилась в свободно распространяемом программном продукте WINPEPI версии 10.8. Для определения статистической значимости различий применялся критерий Манна — Уитни для несвязанных совокупностей.
РЕЗУЛЬТАТЫ
Сравнительная характеристика концентраций биомаркеров в сыворотке крови во II триместре беременности у пациенток основной группы, группы сравнения и контрольной группы, их прогностическое значение в диагностике преэклапсии. C целью прогнозирования ПЭ и ее клинических форм у пациенток всех групп в сыворотке крови определены концентрации биомаркеров ОПП и ангиогенных факторов в сроки второго пренатального скрининга (II триместр — 16–24 недели) (табл. 1). У пациенток основной группы концентрация PLGF в среднем снизилась в 2,5 раза по сравнению с показателем в I триместре беременности (см. часть 1 статьи), концертация sFlt-1 выросла в 2,3 раза в 1-й подгруппе и в 2,1 раза во 2-й по сравнению с таковой в контрольной группе, соотношение sFlt-1/PlGF в 1-й и 2-й подгруппах увеличилось в 2,3 и 1,5 раза по сравнению с показателями в I триместре беременности.
Таблица 1
Концентрации биомаркеров в сыворотке крови пациенток в 16–24 недели беременности, Ме (25-й и 75-й перцентили)
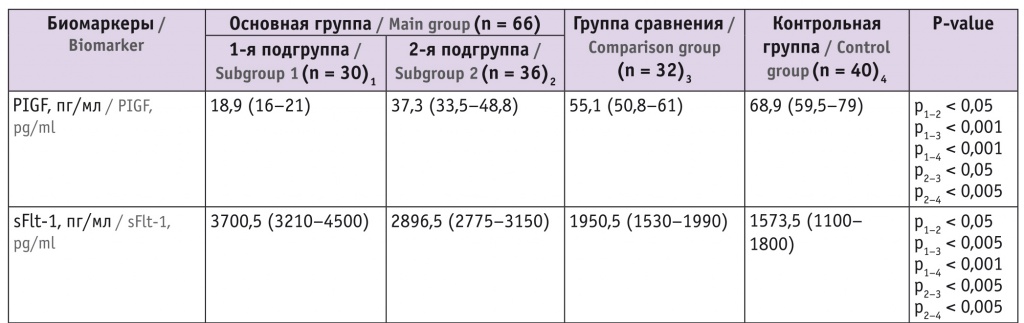
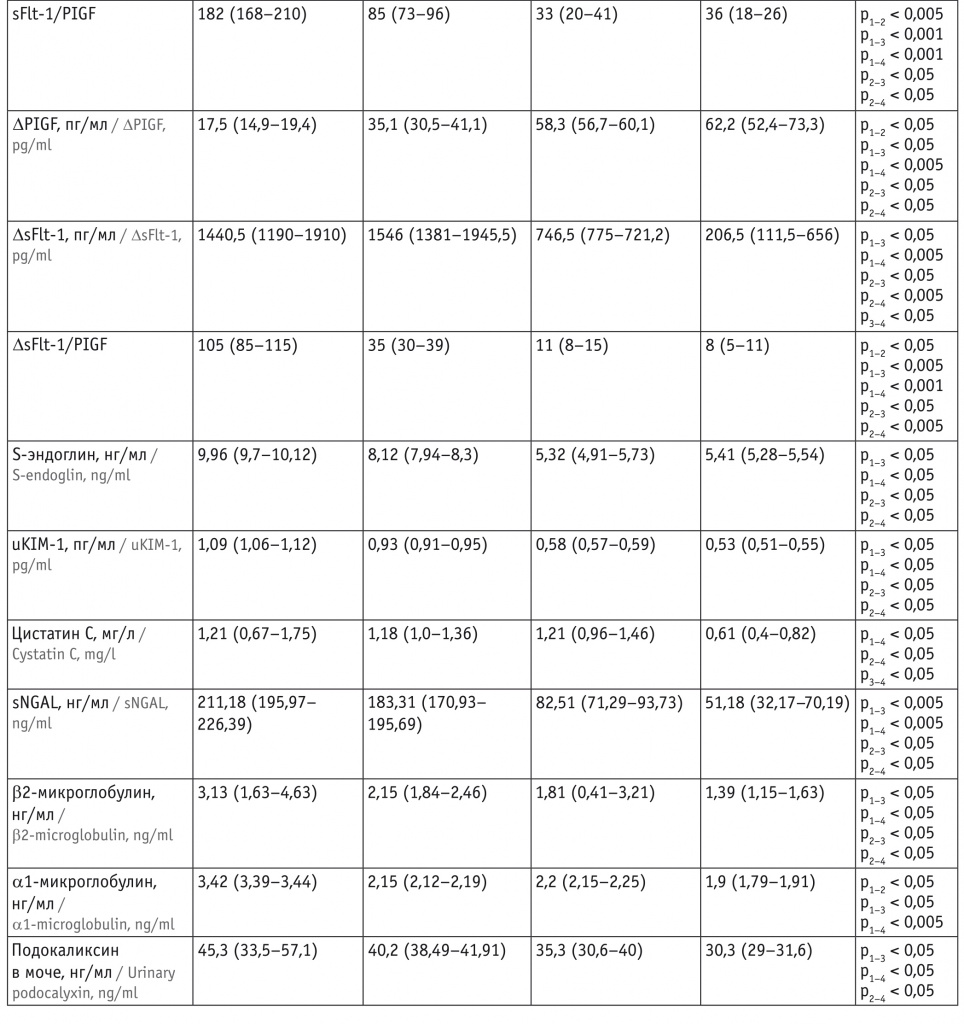 Сравнение динамики уровней маркеров в I и II триместрах показало, что в группе пациенток с ПЭ не происходит увеличение концентрации PlGF к 16–24 неделям в отличие от показателей в контрольной группе и группе сравнения. ΔPlGF (разница между показателями PlGF во II и I триместре) в 1-й подгруппе (17,5 пг/мл) была в 3 раза меньше, чем в группе сравнения (58,3 пг/мл), при значении в контрольной группе 62,2 пг/мл. В то же время уровень sFlt-1 многократно увеличился (почти в 2,4 раза по сравнению с таковым в контрольной группе), соотношение sFlt-1/PlGF было 5 раз выше, чем в контрольной группе, изменение соотношения sFlt-1/PlGF в динамике (ΔsFlt-1/PlGF) повышено в 9,5 и 13,1 раза по сравнению с данным параметром в группе сравнения и контрольной группе соответственно (см. табл. 1).
Сравнение динамики уровней маркеров в I и II триместрах показало, что в группе пациенток с ПЭ не происходит увеличение концентрации PlGF к 16–24 неделям в отличие от показателей в контрольной группе и группе сравнения. ΔPlGF (разница между показателями PlGF во II и I триместре) в 1-й подгруппе (17,5 пг/мл) была в 3 раза меньше, чем в группе сравнения (58,3 пг/мл), при значении в контрольной группе 62,2 пг/мл. В то же время уровень sFlt-1 многократно увеличился (почти в 2,4 раза по сравнению с таковым в контрольной группе), соотношение sFlt-1/PlGF было 5 раз выше, чем в контрольной группе, изменение соотношения sFlt-1/PlGF в динамике (ΔsFlt-1/PlGF) повышено в 9,5 и 13,1 раза по сравнению с данным параметром в группе сравнения и контрольной группе соответственно (см. табл. 1).
Во II триместре беременности во 2-й подгруппе отмечался рост концентраций sFlt-1 и S-эндоглина по сравнению с I триместром. Их уровни статистически значимо отличались от показателей в группе сравнения и контрольной группе.
Выявлено также нарастание по сравнению со значениями в I триместре концентраций маркеров ОПП (sNGAL, uKIM-1, β2- и α1-микроглобулина, подокаликсина мочи) в 1-й подгруппе во II триместре и превышение этих показателей в группе сравнения и контрольной группе: sNGAL — в 2,6 и 4,1 раза; uKIM-1 — в 1,9 и 2,1 раза; β2-микроглобулина — в 1,5 и 1,8 раза; α1-микроглобулина — в 1,7 и 2,2, раза; подокаликсина мочи — в 1,3 и 1,5 раза соответственно. Наиболее выраженные изменения уровней биомаркеров определялись у пациенток с ранним появлением первых симптомов ПЭ, манифестирующих до 34 недель беременности.
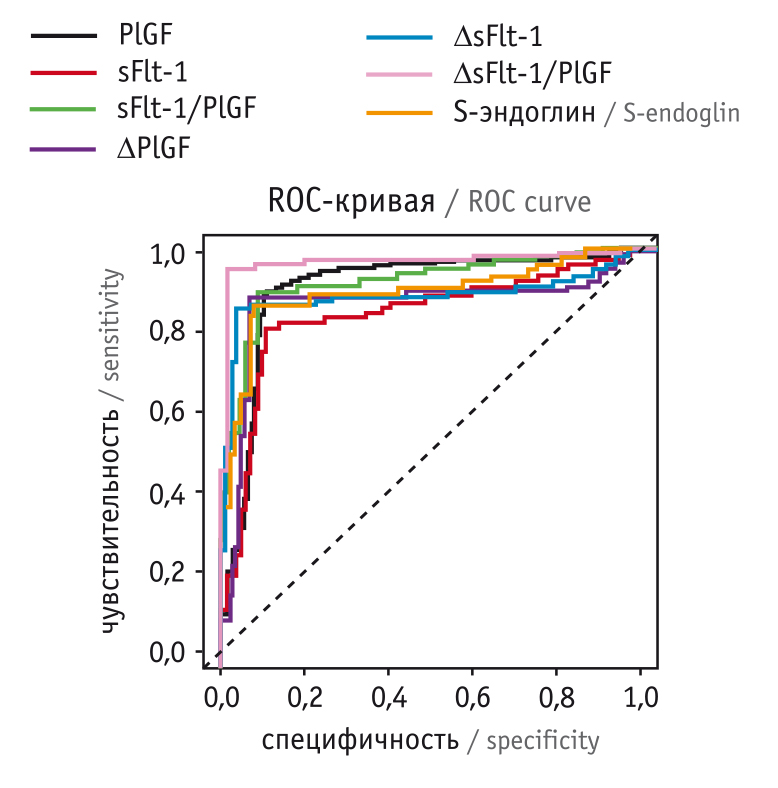
Согласно данным проведенного анализа, наибольшей прогностической значимостью при определении риска развития ПЭ (процент истинно положительных и истинно отрицательных результатов) во II триместре беременности (рис. 1, 2) обладает измерение уровней PlGF (94%), sFlt-1 (92%), sFlt-1/PlGF (94%), ΔPlGF (93,3%), ΔsFlt-1 (92%), ΔsFlt-1/PlGF (94%), S-эндоглина (94%), sNGAL (94%). Чувствительность метода определения отношения sFlt-1/PlGF на этих сроках беременности составила 89,1%, что свидетельствует о перспективности применения показателя в качестве маркера-предиктора ПЭ. В отношении прогноза развития ПЭ, при которой происходит манифестация симптомов до 34 недель (ранняя ПЭ), значимость совокупности исследуемых маркеров более показательна: отмечена более высокая точность прогноза при определении уровней всех исследуемых биомаркеров.
Рис. 1. ROC-кривая: ангиогенные факторы (II триместр беременности)
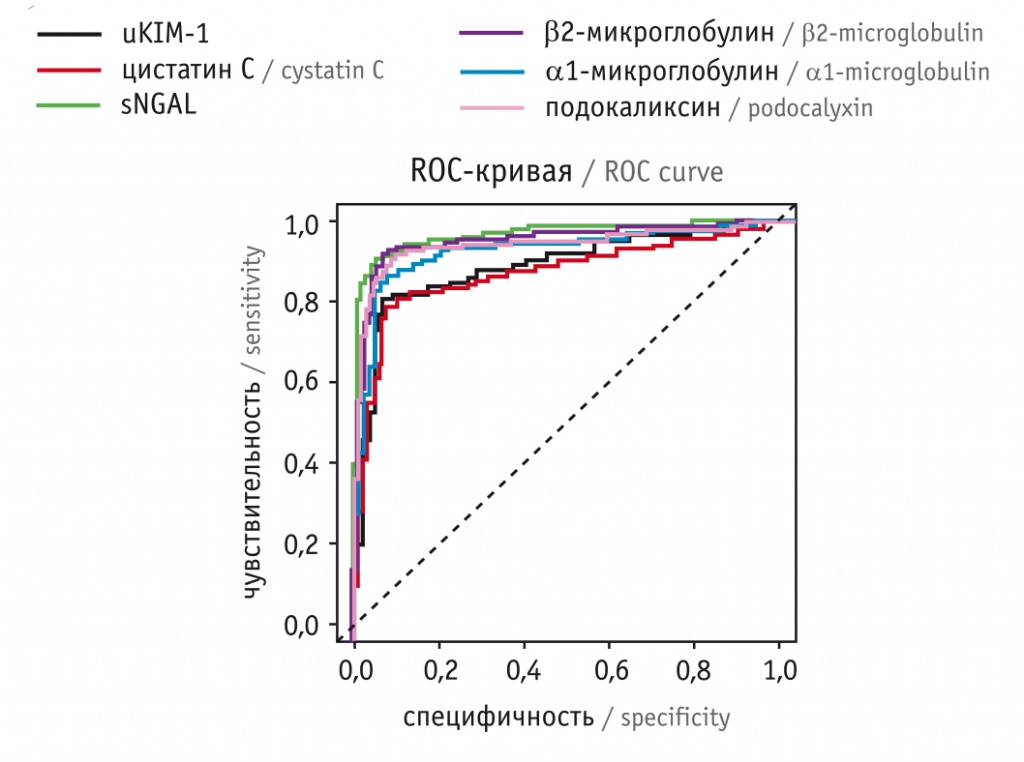
Среди маркеров ОПП наибольшую прогностическую значимость во II триместре беременности в отношении риска развития ПЭ имеет метод определения сывороточной формы NGAL (чувствительность — 89,3%, специфичность — 92,1%).
По данным логистического регрессионного анализа, в I триместре наиболее обосновано измерение sFlt-1/PlGF (при sFlt-1/PlGF ≥ 50 относительный риск (ОР) равен 19,7), а также уровня sNGAL (ОР = 19 при sNGAL ≥ 70,87 мг/мл). Во II триместре наиболее перспективна оценка показателей ΔsFlt-1/PlGF и sFlt-1/PlGF, содержания PlGF, S-эндоглина, uKIM-1, подокаликсина мочи, sNGAL (табл. 2).
Таблица 2
Результаты логистического регрессионого анализа концентраций биомаркеров для прогнозирования развития преэклампсии
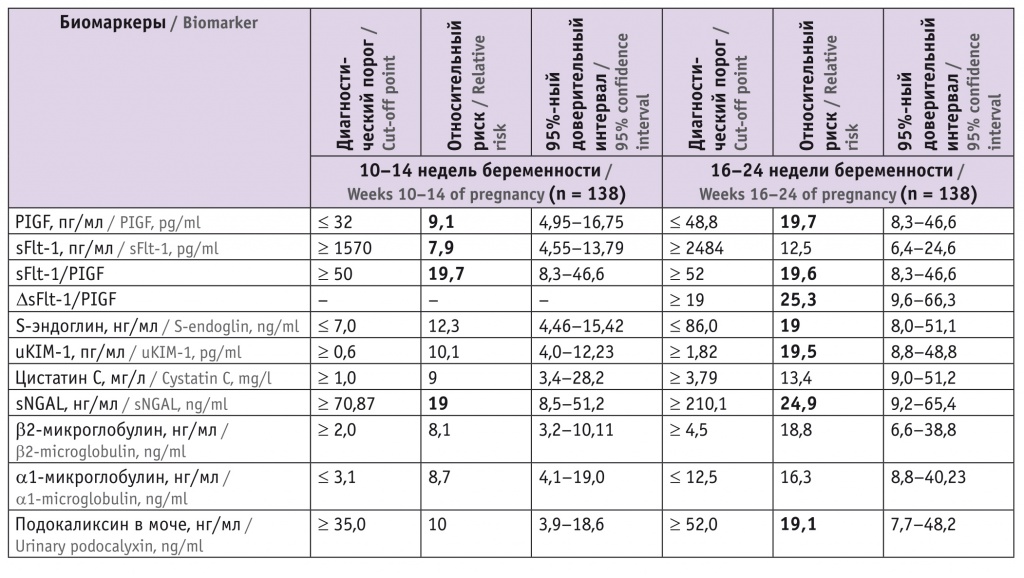
Таким образом, выявление женщин из групп высокого риска развития ПЭ должно быть основано не только на анамнестических и клинико-инструментальных характеристиках, но и на измерении уровней маркеров, свидетельствующих о развитии эндотелиальной дисфункции и обладающих максимальной чувствительностью и специфичностью в ее диагностике.
Течение беременности и перинатальные исходы. Причиной того, что масса новорожденных (1271 ± 531,9 г) в 1-й подгруппе женщин была меньше, чем во 2-й подгруппе, группе сравнения и контрольной группе, являлась не только высокая частота преждевременных родов — 25 (83,3%), но и такое проявление хронической плацентарной недостаточности, как синдром задержки роста плода (СЗРП), который встречался при каждой второй беременности в 1-й подгруппе. Обращает на себя внимание, что частота СЗРП во 2-й подгруппе пациенток (47,2%) была сопоставима с таковой в 1-й. Исходя из этого возможно предположить, что наличие хронической почечной патологии у пациенток с ПЭ не влияет на степень плацентарных нарушений.
В обеих подгруппах женщин с ПЭ наблюдались критические нарушения гемодинамики в функциональной системе «мать — плацента — плод»: 6 (20%) и 8 (22,2%) случаев в 1-й и 2-й подгруппах соответственно.
Досрочное родоразрешение у пациенток с исходным СЗВРП послужило причиной развития респираторного дистресс-синдрома плода с последующей ИВЛ у 22 (73,3%) новорожденных в 1-й и 7 (19,4%) во 2-й подгруппе (p < 0,0001). Стоит отметить, что в основной группе отсутствовали такие осложнения ПЭ, как HELLP-синдром, эклампсия, преждевременная отслойка нормально расположенной плаценты, антенатальная гибель плода.
ОБСУЖДЕНИЕ
Современные тенденции диагностики большинства заболеваний в настоящее время заключаются в прогнозировании их развития и выявлении ранних доклинических форм. Целесообразность использования уровней маркеров прогнозирования риска ПЭ в качестве инструментов скрининга обоснована данными исследований об эффективности профилактики [1], а также первыми успехами в разработке патогенетической терапии, направленной на восполнение дефицита проангиогенных факторов [2, 3]. В настоящее время разработано множество математических моделей, основанных на совокупности сразу нескольких предикторов и факторов риска ПЭ, однако прогностическая ценность этих моделей недостаточно высока (44–68%) [4–6].
Наиболее успешным оказался метод, предложенный F. Audibert и соавт., показавшими практически 100%-ную прогностическую ценность при небольшом количестве ложноположительных результатов [7]. Несмотря на это, ВОЗ говорит об отсутствии клинически достоверных и воспроизводимых тестов для определения ПЭ у женщин с предрасположенностью к синдрому и без нее [8].
И.С. Сидорова и соавт. разработали двухэтапную систему обследования беременных для выделения степеней риска развития ПЭ с учетом превентивности, персонифицированного и партнерского подхода. Однако авторы признают, что в практическом акушерстве еще нет официально рекомендованного маркера, занимающего центральное место в патогенезе ПЭ, определяющегося до ее клинической манифестации, коррелирующего с тяжестью течения и отсутствующего при нормально протекающей беременности [9].
Полученная нами частота встречаемости ранней ПЭ (данные представлены в части 1 настоящей статьи) несколько превышает литературные данные [10]: за изучаемый период 27 (19,6%) беременностей протекали на фоне ранней ПЭ разной степени тяжести. Высокую частоту ранней формы ПЭ мы объясняем профилем клиники, ориентированной на экстрагенитальную патологию. В структуре экстрагенитальных заболеваний у беременных с ПЭ основную долю составили заболевания сердечно-сосудистой системы (47,6%), среди которых преобладала гипертоническая болезнь, что согласуется с результатами многих исследований, посвященных обсуждаемой проблеме.
Сердечно-сосудистые заболевания приводят к срыву адаптации, преобладанию нагрузочных факторов гемодинамического и механического характера, что при действии предрасполагающих факторов находит свое отражение в клинике ПЭ. Кроме того, при хронической АГ, как первичной, так и вторичной, изначально имеет место эндотелиальная дисфункция, которая прогрессирует при нарушении имплантации и иммунопатологическом воспалении и некрозе эндотелиоцитов, которые наблюдаются при ПЭ [11].
Почти у половины (45,5%) пациенток основной группы анамнез был отягощен заболеваниями почек, что свидетельствует об их участии в качестве одного из основных патогенетических звеньев в развитии ранней ПЭ.
Анализ акушерского анамнеза показал, что первые роды предстояли 50 (75,8%) беременным с развитием в последующем ПЭ. В настоящее время этот показатель относят к независимым основным факторам развития ПЭ, у таких пациенток риск ПЭ возрастает от 2,4 до 5,4 раза по сравнению с таковым у рожавших ранее женщин. Это объясняется разным ангиогенным профилем перво- и повторнородящих и отличающейся у них иммунной адаптацией к качественно новому состоянию, которым является беременность [12].
При исследовании определено, что у 20% ранее рожавших беременных с тяжелой ПЭ в анамнезе было обсуждаемое осложнение. Данный факт можно объяснить тем, что, несмотря на завершение прошлой патологической беременности, эндотелиальные структуры восстанавливаются не полностью. Кроме того, известно, что концентрации в крови антиангиогенных факторов у них превышает таковые у женщин с физиологической беременностью в анамнезе [13, 14]. Таким образом, эти факторы с самого начала беременности препятствуют адекватной инвазии и нормальному ангиогенезу.
Наши результаты совпадают с данными других исследователей о частоте кесарева сечения при тяжелой ПЭ до 80% [15]. Следует отметить, что причиной повышения частоты оперативного родоразрешения при умеренной степени ПЭ являлось наличие сопутствующей экстрагенитальной патологии.
Ключевым этапом нашего исследования стало определение уровней главных факторов, инициирующих (PlGF, S-эндоглин), сдерживающих (sFlt-1) ангиогенез и имплантацию, а также маркеров ОПП (sNGAL, uKIM-1, β2- и α1-микроглобулина, подокаликсина мочи, цистатина С). В литературе в основном приводятся результаты исследований изолированного содержания отдельных проангиогенных агентов и их антагонистов, маркеров клеточного воспаления, факторов инвазии трофобласта. Работы, посвященные изучению маркеров ОПП, совместного их действия в комплексе с ангиогенными факторами, не найдены.
Интересно рассмотреть связь sFlt-1/PlGF c молекулами ОПП. Повышенные уровни этих молекул отражают изменение свойств эндотелия и могут являться маркером эндотелиальной дисфункции, что на ранних сроках гестации проявляется в минимальных нарушениях функции почек. По нашему мнению, указанные взаимоотношения связаны с участием sFlt-1 в сосудистом воспалении, эндотелиозе сосудов почечных клубочков, повышении внутрисосудистого свертывания, имеющем место при ПЭ. Почки как орган с наибольшим объемом микроциркуляторного русла при всех характерных для ПЭ сосудистых изменениях становятся наиболее рано реагирующим органом.
Минимальные нарушения функции повышают концентрации маркеров ОПП. При наличии же предсуществующей почечной патологии в нашем исследовании на фоне ПЭ отмечалось нарастание содержания всех маркеров ОПП, что свидетельствует о прогрессировании почечной дисфункции.
Нами получены значимые различия в концентрациях sNGAL, uKIM-1, β2- и α1-микроглобулина в сыворотке крови, подокаликсина в моче беременных между основной, контрольной группой и группой сравнения, уровни цистатина С в группах также различались, однако статистически незначимо.
Обращает на себя внимание высокая прямая взаимосвязь между этими маркерами ОПП, она объясняется повреждением эндотелия почечных клубочков, имеющим место из рассматриваемых групп только при ПЭ. Подобная связь ранее в литературе не описана.
В то же время другие значимые отношения sNGAL, uKIM-1, β2- и α1-микроглобулина, подокаликсина с остальными клинико-лабораторными характеристиками не найдены, поэтому, вероятно, стоит рассматривать данные маркеры только как вспомогательные, например в соотношении с показателем sFlt-1/PlGF.
Не обнаружена также значимая взаимосвязь данных факторов с критериями тяжелой ПЭ, но выявлена их корреляция c частотой возникновения наименее благоприятной ранней формы ПЭ.
ЗАКЛЮЧЕНИЕ
Данные динамического анализа концентраций ангиогенных факторов и марекров острого повреждения почек (ОПП) свидетельствуют о прогрессировании как эндотелиальной, так и почечной дисфункции в виде гломерулопатии, заключающейся в эндотелиозе почечных гломерул, вторичном развитии тубулопатии на этапе отсутствия клинических признаков преэклампсии (ПЭ). Предшествуя клинической манифестации ПЭ, в сроки 16–24 недели беременности имеют место изменения функции плаценты в виде возникновения ангиогенного дисбаланса, представленного снижением либо несущественным нарастанием уровня PlGF и повышением концентрации sFlt-1; увеличивается содержание маркеров ОПП: sNGAL, uKIM-1, β2- и α1-микроглобулинов, подокаликсина мочи. Полученные клинические данные о перинатальных исходах косвенно подтверждают роль патологического каскада реакций при генерализованной эндотелиальной дисфункции в развитии хронической плацентарной недостаточности, гломеруло- и тубулопатии.
Мы предполагаем, что у пациенток с хронической болезнью почек декомпенсация функции эндотелия происходит быстрее, чем у беременных без исходной почечной патологии, что приводит к более агрессивному течению ПЭ, ранней манифестации заболевания и высокой частоте критических нарушений гемодинамики в функциональной системе «мать — плацента — плод». При оценке прогностической значимости, чувствительности и специфичности ангиогенных факторов и биомаркеров ОПП во II триместре беременности наибольшая точность метода выявлена при определении уровней PlGF (94%), sFlt-1 (92%), sFlt-1/PlGF (94%), ΔPlGF (93,3%), ΔsFlt-1 (92%), ΔsFlt-1/PlGF (94%), S-эндоглина (94%), sNGAL (94%), что свидетельствует о перспективности применения данных показателей в качестве маркеров-предикторов ПЭ.
Часть 1 настоящей статьи опубликована в журнале «Доктор.Ру» Гинекология. 2020. Т. 19. № 6. С. 23–29. — Прим. ред.
Поступила: 16.03.2020
Принята к публикации: 04.06.2020








