ВВЕДЕНИЕ
Одной из важнейших проблем современного акушерства является профилактика осложненного течения беременности и репродуктивных потерь в группах высокого риска [1–4]. В последнее десятилетие во многих странах мира отмечается все большее количество бесплодных браков. По данным литературы, в мире насчитывается более 70 млн человек, страдающих бесплодием и нуждающихся в лечении. В России бесплодны 4,0–4,5 млн супружеских пар [5–8]. Несмотря на успехи современной медицины, бесплодие остается острой медико-социальной проблемой [9, 10].
Среди методов лечения бесплодия наиболее эффективны ВРТ. Однако наступление беременности в программах ЭКО является лишь начальным этапом, перед акушерами стоит задача обеспечить благоприятное течение беременности и рождение здоровых детей. Беременность, наступившая в результате ЭКО, нередко бывает многоплодной и имеет высокий риск развития, невынашивания и преждевременных родов, преэклампсии, плацентарной недостаточности и низкой массы тела новорожденного [11–13]. Данные акушерские осложнения, как правило, связывают с поздним репродуктивным возрастом женщин, с отягощенным соматическим и акушерско-гинекологическим анамнезом, влиянием стимуляции суперовуляции на гормональный фон и параметры гемостаза [14–17]. Несмотря на значительные успехи в области прогнозирования, лечения и профилактики акушерских осложнений беременности после ВРТ, вопросы, связанные с развитием и коррекцией многих из них, требуют дальнейших исследований [11].
Один из путей снижения частоты преждевременных родов состоит в своевременном выявлении и устранении симптомов угрозы прерывания беременности. Исследования, посвященные этой проблеме, в основном проводятся на этапе с 18–19 до 23 недель гестации с акцентированием внимания на укорочении шейки матки по данным транcвагинальной цервикометрии. Между тем уменьшение длины шейки матки может начинаться с 14–16 недель, то есть с первой половины второго триместра, особенно при наличии истмико-цервикальной недостаточности (ИЦН), характеризующейся бессимптомным укорочением шейки матки [18].
Цель исследования: оптимизировать ведение беременности и улучшить исход родов у пациенток с эндокринным фактором бесплодия, в отношении которых были применены ВРТ.
МАТЕРИАЛЫ И МЕТОДЫ
Работа выполнена сотрудниками кафедры акушерства и гинекологии № 2 Омского государственного медицинского университета Минздрава России (заведующий кафедрой — Баринов С.В.) на базе Омской областной клинической больницы, отделения репродуктивной и перинатальной медицины (главный врач — Полежаев К.Л.) в период 2016–2018 гг. и на базе Группы компаний «Медси», КДЦ на Солянке, отделения урогинекологии (главный врач — Евдокимова Н.В.) в период 2018–2019 гг.
Под наблюдением находились 120 женщин с одноплодной беременностью. Основную группу (группу I) составили 74 женщины с эндокринным фактором бесплодия, перенесшие ЭКО. В контрольную группу (группу II) были включены 46 практически здоровых женщин с самостоятельно наступившей беременностью.
Критерии включения в исследование:
-
возраст 18–45 лет;
-
беременность после ЭКО у женщин с эндокринным фактором бесплодия;
-
отягощенный акушерский и гинекологический анамнез;
-
одноплодная беременность.
Критерии исключения:
-
мужской и трубный факторы бесплодия;
-
внематочная беременность после ВРТ;
-
беременность с хромосомными аномалиями и врожденными пороками развития плода;
-
наследственные тромбофилии в анамнезе;
-
многоплодная беременность;
-
пролабирование плодного пузыря;
-
дородовое излитие околоплодных вод;
-
признаки острой инфекции;
-
злоупотребление алкоголем и наркотиками.
В процессе исследования в зависимости от тактики ведения беременности основная группа была разделена на две подгруппы: IA (n = 44) с комплексным подходом (все беременные этой подгруппы получали микронизированный прогестерон при формировании ИЦН, а при укорочении шейки матки до 15–25 мм накладывался акушерский пессарий Dr. Arabin с целью ее коррекции) и IB (n = 30) с применением только микронизированного прогестерона. В нашем исследовании ИЦН сформировалась у 59,4% (44/74) беременных основной группы.
Перфорированный силиконовый пессарий Dr. Arabin для коррекции ИЦН в подгруппе IA вводили в сроках 14–24 недель. Для каждой пациентки размер пессария подбирался индивидуально в соответствии с инструкцией. Микронизированный прогестерон беременные основной группы получали вагинально согласно клиническим рекомендациям: с 5-й по 8-ю неделю гестации по 600 мг/сут, с 8-й по 12-ю неделю по 400 мг/сут, далее до 32-й недели беременности в суточной дозе 200 мг [19].
В исследовании изучали данные анамнеза, особенности течения беременности и родов, лабораторные показатели и клинические признаки, результаты УЗИ и доплерометрии. УЗИ выполняли на аппарате Voluson ТМЕ8/Е8 Expert (GE Healthcare Austria GmbH & Co OG, Австрия), при этом оценивали состояние шейки матки (цервикометрия), состояние плода, околоплодных вод и плаценты.
Статистическая обработка результатов проводилась с применением интегральной системы для комплексного статистического анализа и обработки данных Statistica 10.0 и Microsoft Excel. Критический уровень значимости при проверке статистических гипотез принимался равным 0,05.
Для выявления статистической взаимосвязи между факторами применяли непараметрические методы с использованием коэффициента Спирмена. Сравнение относительных величин проводили с помощью точного критерия Фишера или критерия хи-квадрат (χ2) с поправкой Йейтса. Статистически значимые различия констатировали при значениях χ2 ≥ 3,84. Для парного сравнительного анализа по качественным переменным использовали критерий Манна — Уитни.
Этические принципы. Работа выполнена на основе информированного добровольного согласия на участие в исследовании в соответствии с Правилами клинической практики (англ. Good Clinical Practice) в Российской Федерации1 и одобрена этическим комитетом Омского государственного медицинского университета Минздрава России (выписка из протокола № 46/1 от 18.11.2019).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для реализации поставленной цели проведен анализ течения беременности и исходов родов у пациенток исследуемых групп. Все женщины имели одноплодную беременность, находились в репродуктивном возрасте. Средний возраст составил 32,1 ± 5,6 года (в подгруппе IA — 31,1 года, IB — 31,8, в группе контроля — 33,3 года). Большинство пациенток основной группы были первородящими — 82,4% (61/74). Среди беременных группы контроля преобладали повторнородящие — 69,6% (32/46). Статистически значимых различий в социальном статусе между группами не выявлено, преобладали работающие пациентки с высшим образованием: 73,0% (54/74) в основной группе, 76,1% (35/46) — в контрольной.
Показаниями для проведения процедуры ЭКО в основной группе были факторы эндокринных нарушений: синдром поликистозных яичников наблюдался у 68,9% (51/74) женщин, гиперандрогенемия надпочечникового генеза — у 10,8% (8/74), гиперандрогенемия смешанного генеза — у 20,3% (15/74). Сочетанный фактор бесплодия (сочетание с эндометриозом, хроническим эндометритом) отмечался в 35,1% (26/74) случаев.
Все пациентки основной группы имели отягощенный акушерский и/или гинекологический анамнез: преждевременные роды были зарегистрированы в 9,4% (7/74) случаев; частота рубцов на матке от предыдущих оперативных вмешательств составила 10,8% (8/74); миома матки больших размеров выявлена у 10,8% (8/74) женщин; воспалительными заболеваниями женских половых органов страдали 40,5% (30/74) обследуемых. В группе контроля осложненный акушерско-гинекологический анамнез встречался значительно реже: преждевременные роды были зарегистрированы в 6,5% (3/46) случаев; воспалительными заболеваниями женских половых органов страдали 17,4% (8/46) женщин, эндометриозом — 4,3% (2/46); в 6,5% (3/46) наблюдений беременность сочеталась с миомой матки малых размеров.
Группы I и II были сопоставимы по экстрагенитальной патологии. В структуре последней ведущее место занимали хроническая железодефицитная анемия (31,1% (23/74) в группе I и 30,4% (14/46) в группе II), болезни мочевыделительной системы (40,5% (30/74) и 34,8% (16/46) соответственно) и сердечно-сосудистой системы (50,0% (37/74) и 30,4% (14/46) соответственно). Признаки инфицирования герпес-вирусами встречались у 29,7% (22/74) женщин основной группы и 19,6% (9/46) — контрольной. Патология органов пищеварительной системы у пациенток основной группы отмечалась в 16,2% (12/74) случаев, а в группе контроля — в 15,2% (7/46). Заболевания щитовидной железы выявлены у 18,9% (14/74) и 15,2% (7/46) женщин соответственно.
Анализ частоты осложнений беременности в группах (табл. 1) показал отсутствие статистически значимых различий в частоте возникновения внутриутробных инфекций во время беременности, умеренной и тяжелой преэклампсии, неспецифического вагинита. В то же время выявлены статистически значимые отличия от группы контроля обеих подгрупп основной группы по частоте угрозы прерывания беременности (IA: χ2 = 5,704, p = 0,017; IB: χ2 = 5,700, p = 0,029) и подгруппы IB по частоте кровотечений во время беременности (χ2 = 7,163; p = 0,008). В целом в группе I кровотечения наблюдались у 9,4 (7/74) беременных, в группе II кровотечений во время беременности не было.
Таблица 1
Осложнения беременности у женщин сравниваемых групп
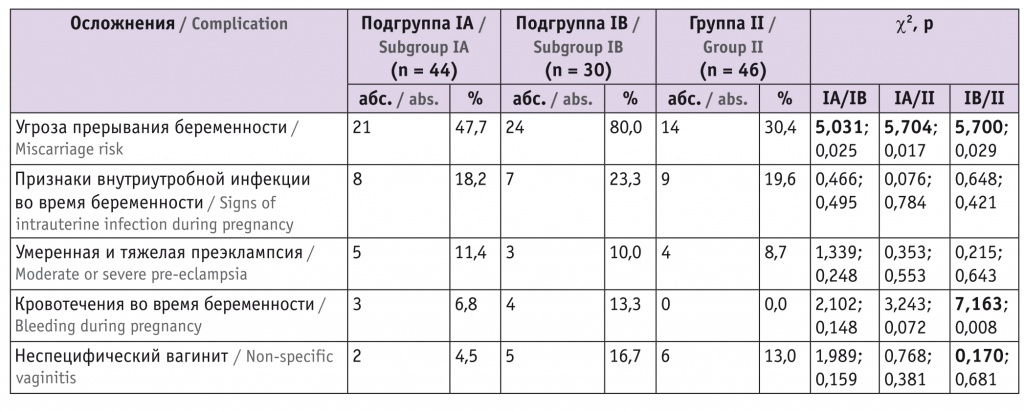
Как видно из таблицы 1, в подгруппе IВ частота угрозы прерывания беременности была максимальной — 80,0%, что в 2,6 раза больше, чем в группе контроля (30,4%), и на 67,7% больше, чем в подгруппе IА (47,7%). В подгруппе IВ отмечена также наибольшая частота кровотечений во время беременности — 13,3%. По нашему мнению, высокие показатели по этим нозологиям в подгруппе IB связаны с особенностью течения беременности после ЭКО. В данной подгруппе беременных не проводилась коррекция ИЦН акушерским пессарием Dr. Arabin.
Как отмечено выше, группы не имели статистически значимых различий в частоте возникновения умеренной и тяжелой преэклампсии. При этом данная патология чаще наблюдалась в основной группе исследования, а наибольший ее процент отмечен в подгруппе IA — 11,4% против 10,0% в подгруппе IB и 8,7% в группе контроля (см. табл. 1). Полагаем, что повышенная частота преэклампсии в основной группе связана с тем, что формирование плацентации в ней часто происходило на фоне характерных для пациенток после ЭКO пониженных значений плацентарного фактора роста (англ. Placental Growth Factor, PlGF) [20].
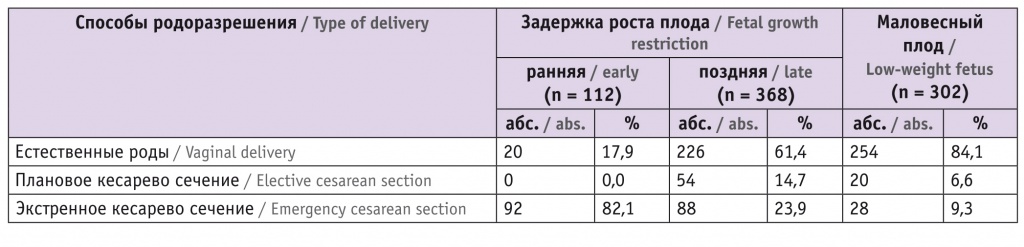
Анализ частоты кровотечений в родах в основной и контрольной группах (табл. 2) выявил, что в основной группе данную патологию диагностировали у 8,1% (6/74) женщин. Показатель в основном сформирован за счет подгруппы IА — на эту подгруппу пришлись 5 из 6 случаев кровотечения, а частота кровотечений в ней составила 11,4%, что в 3,45 раза чаще, чем в подгруппе IВ (3,3%). В группе контроля кровотечений в родах отмечено не было (при сравнении с подгруппой IA: χ2 = 5,535; р = 0,019). В подгруппе IА обнаружен также высокий процент оперативного родоразрешения — 38,6% в сравнении с 13,0% в группе контроля (χ2 = 6,257; р = 0,013).
Таблица 2
Осложнения в родах у женщин сравниваемых групп
Предполагаем, что высокие показатели частоты кровотечений в родах и оперативных родов в подгруппе IA связаны с особенностями анамнеза беременных и осложнениями течения беременности после ЭКО у женщин с эндокринным фактором бесплодия.
Беременность закончилась срочными родами у 75,7% (56/74) пациенток в основной группе и 95,7% (44/46) в группе контроля. Преждевременные роды регистрировались у 24,3% (18/74) женщин в основной группе и статистически значимо реже — у 4,3% (2/46) в контрольной (χ2 = 4,915; p = 0,027). Наибольшая разница отмечена между подгруппой IВ и группой II: 40,0% и 4,3% соответственно, показатель подгруппы IB превысил контрольный в 9,3 раза (χ2 = 10,156; p = 0,004). Частота преждевременных родов в разные сроки гестации представлена в таблице 2. Средний срок родоразрешения в группах I и II составил 31,4 ± 3,64 и 30,2 ± 3,94 недели соответственно.
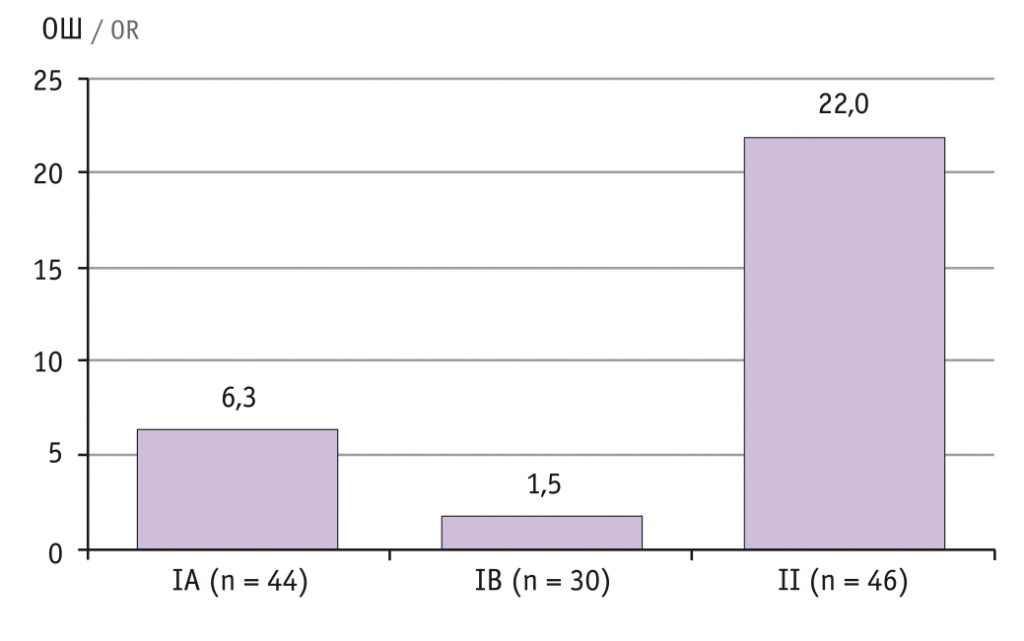
При анализе отношения шансов (ОШ) срочных родов в группах в зависимости от способа получения беременности выявлено, что ОШ срочных родов в группе контроля в 7,2 раза выше, чем в основной группе. ОШ рождения доношенных новорожденных в подгруппе А основной группы (с коррекцией ИЦН акушерским пессарием Dr. Arabin) в 4,2 раза выше, чем в подгруппе B (с применением только микронизированного прогестерона), но в 3,5 раза ниже, чем в группе контроля (рис.).
Рис. Отношение шансов срочных родов в исследуемых группах
Обнаружена отрицательная корреляция между использованием пессария в сочетании с микронизированным прогестероном и вероятностью возникновения преждевременных родов (r = 0,6).
Анализ состояния новорожденных выявил статистически значимые различия между основной и контрольной группами по показателям как доношенных, так и недоношенных детей. Средний вес доношенного новорожденного в основной группе составил 3210,4 ± 744,5 г, в группе контроля — 3276,0 ± 413,2 г (p = 0,009). Средний вес недоношенного новорожденного в группах I и II равнялся 1428 ± 531,5 г и 1953,8 ± 305,9 г соответственно (p = 0,003).
В основной группе исследования живыми родились 73 ребенка. В одном случае (1,4%) произошла антенатальная гибель плода (весом 3150 г), причиной явилась преждевременная отслойка нормально расположенной плаценты в сроке 38 недель. Ранняя неонатальная смерть в основной группе зарегистрирована в 2,7% (2/73) случаев, причинами были внутриутробная инфекция и врожденный порок сердца. В группе контроля ни одного случая антенатальной гибели плода и ранней неонатальной смерти не было.
ЗАКЛЮЧЕНИЕ
Проведенное исследование показало, что беременность и роды после ВРТ у женщин с эндокринным фактором бесплодия сопряжены с такими осложнениями, как угроза прерывания беременности, преэклампсия умеренной и тяжелой степени, кровотечения во время беременности.
У 59,4% (44/74) беременных после ВРТ с эндокринным фактором бесплодия происходило формирование истмико-цервикальной недостаточности. В сравнении с использованием только вагинального микронизированного прогестерона комплексный подход к ведению беременных с применением также акушерского пессария Dr. Arabin позволил пролонгировать беременность, снизить частоту преждевременных родов в 2,9 раза (в том числе ранних преждевременных родов в 5,8 раза) и получить доношенную беременность в 86,4% (38/44) случаев, что на 26,4% чаще, чем в подгруппе беременных с назначением только микронизированного прогестерона (60,0%).
Поступила: 12.05.2020
Принята к публикации: 17.06.2020
______________
1 Утверждены Приказом Минздрава России от 19.06.2003 № 266. — Прим. авт.








