Патологическая плацентация, обусловленная дисбалансом про и антиангиогенных факторов, приводит к недостаточной трансформации спиральных артерий и плацентарной ишемии [1–4]. Уменьшение плацентарной перфузии, в свою очередь, вызывает высвобождение в кровоток матери повреждающих факторов (продуктов ПОЛ, провоспалительных цитокинов, антиангиогенных факторов, обломков апоптоза трофобласта), что способствует развитию воспалительного ответа и оксидантного стресса.
Прогрессирование беременности в таких условиях создает предпосылки для вазоконстрикторных реакций со стороны эндотелия, неадекватной перфузии многих органов и систем, увеличению тромбогенного потенциала [1, 4–6]. При поздней ПЭ существовавшие ранее АГ, метаболические нарушения, а также аутоиммунные состояния приводят к сверхактивной воспалительной реакции при «нормальный» плацентации.
Сложность патогенетических процессов обусловливает неэффективность лечения и неблагополучные исходы для матери и плода, что делает проблему прогнозирования и своевременной диагностики ПЭ особенно актуальной. Разработка точных и легко воспроизводимых предикторов ПЭ позволяет своевременно выделить группу риска и провести целенаправленные профилактические мероприятия.
Целью исследования явилось определение объективных прогностических критериев ПЭ в первой половине беременности.
Материалы и методы
За период 2012–2016 гг. в ОБУЗ «Курский городской клинический родильный дом» (главный врач — Ильченко К. Н.) проведено комплексное динамическое обследование 209 пациенток (18–43 года), имевших одноплодную беременность и родивших живых доношенных детей. В исследование не включали женщин с многоплодной беременностью, пороками сердца, СД 1 типа и после ЭКО. Ретроспективно в зависимости от исходов беременности и родов были сформированы две группы. В контрольную группу вошли 84 женщины с неосложненным течением беременности и родов, в основную — 125 беременных с умеренной и тяжелой ПЭ. Степень тяжести ПЭ устанавливали в соответствии с клиническими рекомендациями «Гипертензивные расстройства во время беременности, в родах и послеродовом периоде. Преэклампсия. Эклампсия» 2015 г. [7].
Всем пациенткам проведено 2кратное комплексное обследование в первой половине беременности, совпадавшее по времени с периодами завершения первой и второй волн инвазии трофобласта (11–13 и 17–20 недель), включавшее общепринятое акушерское обследование, эхокардиографическое исследование центральной материнской гемодинамики с учетом параметров ударного (УО) и минутного (МО) объемов, ударного (УИ) и сердечного (СИ) индексов, общего периферического сосудистого сопротивления (ОПСС), ЧСС, АД с последующим вычислением типов центральной гемодинамики (эу, гипер или гипокинетический тип).
Функцию эндотелия определяли по степени выраженности эндотелийзависимой вазодилатации плечевой артерии (ПА) матери после проведения манжеточной пробы с реактивной гиперемией [8] ультразвуковым прибором Aloka SSD 1700 (Япония). Значения показателя вазодилатирующей функции эндотелия, полученные на сроке 11–13 недель, расценивали как исходные (функция эндотелия исходная), на сроке 17–20 недель — как конечные (функция эндотелия конечная). По результатам двух исследований проводили оценку прироста вазодилатирующей функции эндотелия в динамике первой половины беременности (ФЭ = ФЭК – ФЭИ) (патент на изобретение № 2485894) [9]. Кроме того, на сроке 11–13 недель измеряли содержание сывороточных маркеров беременности — РАРРА, βХГЧ, ПАМГ1.
Статистическую обработку результатов производили с использованием программы Statistiсa 6.0 (StatSoft, США). Для изучения взаимосвязи переменных применяли методы корреляционного анализа (коэффициент Спирмена). Достоверность различия для зависимых и независимых выборок между двумя средними оценивали по tкритерию Стъюдента. Различия между средними величинами в сравниваемых группах считали достоверными при р < 0,05. Для определения прогностической значимости изучаемых параметров проводили однофакторный и многофакторный регрессионный анализ с использованием модели пропорционального риска Кокса; в многофакторный регрессионный анализ были включены факторы, которые статистически значимо (или на грани статистической значимости) влияли на развитие ПЭ. Достоверным считали различия при р < 0,05.
Результаты
Проведенный анализ показал, что более половины обследованных (63,6%) были в возрасте от 23 до 35 лет. При анализе течения предыдущих беременностей и родов выявлено, что ранее клинические проявления ПЭ имели 5,9% пациенток из контрольной и 23,2% из основной группы (p > 0,05).
У беременных с ПЭ достоверно чаще (р ≤ 0,05) отмечались экстрагенитальные заболевания: сердечнососудистые, воспалительные заболевания мочеполовых органов, нарушения обмена веществ (Е70–Е90). Повышенное кровяное давление при отсутствии диагноза гипертензии (R03.0) диагностировали у 34,4%, гипертоническую болезнь — у 11,2% женщин. Хронический пиелонефрит в анамнезе имели 20,0% участниц основной группы.
У беременных с ПЭ хронические воспалительные заболевания матки и придатков с частыми обострениями регистрировали значительно чаще, чем в контрольной группе, — 24% против 6% (р < 0,05). Практически каждая пятая женщина с ПЭ имела эндокринные заболевания (синдром поликистозных яичников, гипофункцию щитовидной железы, гиперпролактинемию). Метаболический синдром и алиментарное ожирение диагностированы у 14,4% участниц основной группы.
Течение первой половины настоящей беременности у пациенток с ПЭ характеризовалось симптомами угрожающего раннего выкидыша (60,0%), отслойки хориона (43,2%), а также рецидивирующей угрозы прерывания в течение всей беременности (33,6%). Сочетание относительного многоводия с наличием эхопозитивных включений в амниотической жидкости, которое интерпретировали как ультразвуковые симптомы амнионита, было выявлено у 36,8% женщин с ПЭ и 19,0% беременных контрольной группы. Ультразвуковые и доплерометрические признаки плацентарной недостаточности наблюдали у 48,8% пациентки с ПЭ.
У беременных с умеренной ПЭ отеки нижних конечностей впервые были зафиксированы на сроке 28–31 неделя с последующим присоединением гипертензии через 2–3 недели. При тяжелой ПЭ клинические симптомы регистрировали раньше на 2–4 недели, при этом сначала повышалось АД, затем присоединялись отечный синдром и протеинурия. Оперативное родоразрешение по показаниям со стороны плода или матери было проведено у 68,0% беременных, из которых у 12,0% имелись признаки тяжелой ПЭ.
Средняя масса тела плода у матери с ПЭ составила 2874 ± 294 г, оценка по шкале Апгар при рождении — 5,6 ± 2,6 балла, они были ниже по сравнению с контрольной группой (3357 ± 310 г и 8,3 ± 0,4 балла). В раннем неонатальном периоде гипоксическиишемические повреждения диагностированы у 51,2% новорожденных основной группы.
Проведенный однофакторный и многофакторный регрессионный анализ не выявил прогностическую значимость анамнестических данных, наличия экстрагенитальных заболеваний и особенностей течения предыдущих беременностей для прогнозирования ПЭ.
Оценка функциональной активности основных элементов плодного яйца и децидуальной ткани показала, что у пациенток с ПЭ концентрации РАРРА и βХГЧ были ниже (0,89 ± 0,19 МОМ против 1,49 ± 0,15 МОМ и 0,87 ± 0,31 против 1,69 ± 0,21 МОМ соответственно), а уровень ПАМГ1 выше (23,1 ± 4,2 нг/мл против 12,6 ± 3,4 нг/мл), чем в контрольной группе (для всех параметров р ≤ 0,05).
Анализ исходных типов центральной гемодинамики показал, что при развитии ПЭ частота встречаемости гипокинетического (21,4%) была вдвое, а гиперкинетического (39,3%) типа втрое выше в сравнении с таковой в контрольной группе (для обоих показателей р < 0,05).
Динамика УИ и СИ в обеих группах не отражала характер гестационных преобразований, так как в большей степени зависела от колебаний массы тела пациентки в этот период беременности.
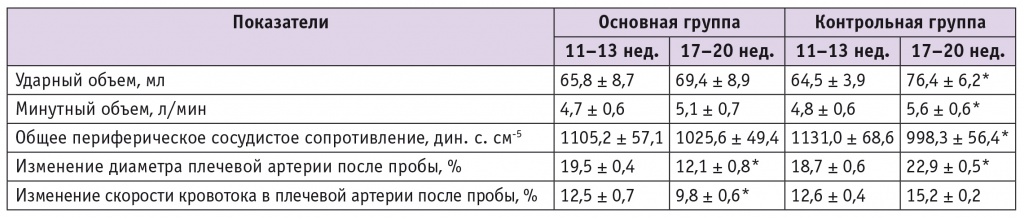
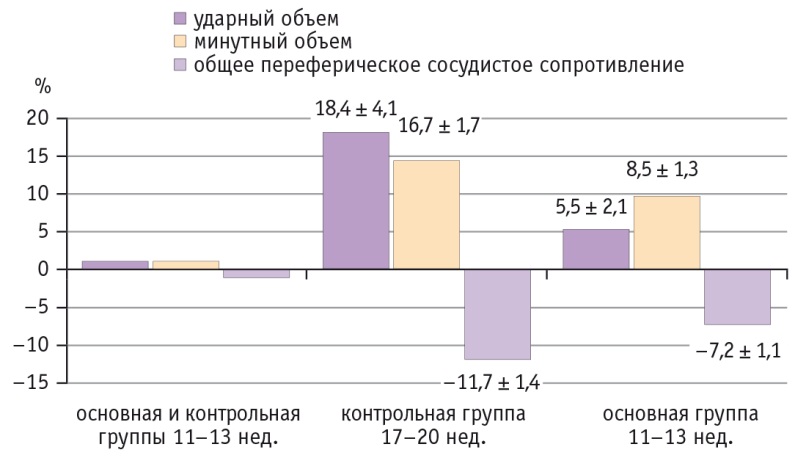
Анализ изменения эхокардиографических показателей в контрольной группе в период с 11–13 до 17–20 недель выявил значимое повышение УО и МО, а также существенное снижение ОПСС (табл., рис. 1). У беременных с ПЭ к 17–20 неделям прирост УО и МО составил менее 10%, (см. табл., рис. 1), ОПСС незначительно снизилось.
Таблица
Показатели центральной материнской гемодинамики и вазодилатирующей функции эндотелия у обследованных женщин (М ± m)
* Отличия от показателей 11–13 недель достоверны (р < 0,05).
Рис. 1. Изменение показателей центральной материнской гемодинамики на протяжении первой половины беременности в группах исследования, %
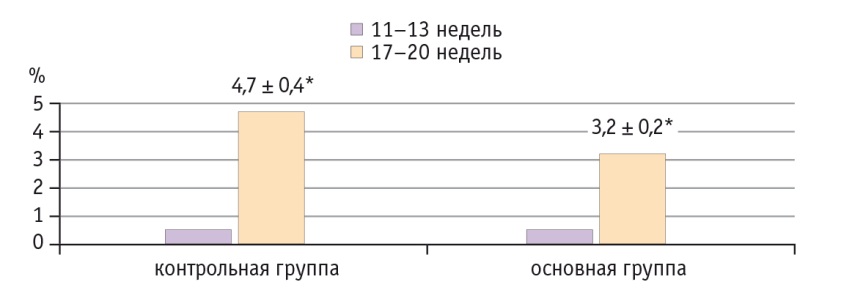
Изменения функции эндотелия показали, что при неосложненной беременности на сроке 11–13 недель после проведения манжеточной пробы диаметр ПА увеличился с 3,5 мм до 4,3 мм (в среднем на 18–24%), скорость кровотока возросла на 11–13% (см. табл.). На сроке беременности 17–20 недель после компрессионной пробы расширение диаметра ПА стало более выраженным (на 25–26%) с параллельным увеличением скорости кровотока. Общий рост функциональной активности эндотелия за период динамического наблюдения (с 11 до 20 недель) в контрольной группе составил 4,7 ± 0,4% (рис. 2).
Рис. 2. Гестационные изменения вазодилатирующей функции эндотелия в группах исследования
* Отличия от показателей 11–13 недель достоверны (р < 0,05)
Оценка вазодилатирующей функции эндотелия на сроке гестации 11–13 недель у пациенток с ПЭ не выявила различий с контрольной группой (р > 0,05). После манжеточной пробы диаметр ПА увеличился на 18–22%, скорость кровотока — на 12–14%. Значительные отличия функциональной активности эндотелия от таковых в контрольной группе выделены на сроке 17–20 недель. После манжеточной пробы диаметр ПА изменялся незначительно — с 33 мм до 37 мм (не более чем на 11–12%), скорость кровотока увеличилась примерно на 9–10% (см. табл.).
Следует отметить, что выявленная реакция сосудов в ответ на компрессионную пробу была разнонаправленной. В основной группе 28,8% женщин имели адекватную реакцию на пробу в виде увеличения диаметра ПА, у 40,0% не выявлено изменения диаметра сосуда в динамике, а у 31,2% отмечена парадоксальная реакция в виде уменьшения диаметра ПА после компрессионной пробы. Общий прирост вазодилатирующей активности эндотелия на протяжении первой половины гестации составил 3,2 ± 0,2% (р ≤ 0,05) (см. рис. 2).
Обсуждение
В настоящее время отсутствуют реальные возможности профилактики и лечения ПЭ, поэтому раннее выявление беременных с повышенным риском развития этого осложнения может способствовать улучшению исходов беременности [10].
Проведенный анализ анамнестических данных и результатов объективного исследования на ранних сроках гестации (10–13 нед.) показал, что ни один отдельно рассматриваемый параметр или сочетание нескольких параметров нельзя считать прогностическими предикторами ПЭ изза их низкой прогностической значимости. Вместе с тем существует прямая корреляционная зависимость между заболеваниями сердечнососудистой системы, почек, СД, хроническими воспалительными заболеваниями и плацентозависимыми осложнениями беременности, ассоциированными с плацентарными нарушениями.
В патогенетическом аспекте заболевания сердечнососудистой системы сопровождаются выраженными изменениями материнской гемодинамики и микроциркуляции, проявляющимися преимущественно артериолоспазмом и гиповолемией, что создает благоприятный преморбидный фон для развития ПЭ. Соматические заболевания воспалительного генеза (хронические бронхиты, тонзиллиты, пиелонефриты), безусловно, повышали риск неблагоприятного влияния инфекционных агентов, как бактериальных, так и вирусных, на становление и развитие материнскоплодовоплацентарного комплекса. Токсичные вещества могут вызывать различные эффекты и реакции как на уровне клеточных структур, так и на межсистемном и межорганном уровнях (активацию калликреинкининовой системы, коагуляции и фибринолиза и др.) [1]. В итоге такие изменения приводят к нарушению сосудистого тонуса, капиллярной перфузии, реологических свойств крови, водного и электролитного баланса, к гиповолемии, тромбозам и т. д. Сопутствующая гипоксия вызывает поражение эндотелия сосудов с нарушением его тромборезистентных и вазоактивных свойств, выделением медиаторов (эндотелина, серотонина, циркулирующего фактора эклампсии, тромбоксана), играющих ключевую роль в регуляции гемостаза и сосудистого тонуса.
Согласно современной теории развития ПЭ, развитие этого заболевания разделяют на две стадии: первую — плацентарную, бессимптомно протекающую на ранних сроках гестации, и вторую — материнскую, манифестирующую клиническими симптомами во второй половине беременности. Первая стадия возникает вследствие иммунной дезадаптации организма матери в ответ на влияние различных агентов плодного яйца с ранних сроков беременности и проявляется недостаточностью инвазии трофобласта в спиральные артерии. Это ведет к формированию первичной плацентарной недостаточности, нарушению плацентарной перфузии, гипоксии, усилению апоптоза и некрозу плацентарной ткани.
Степень выраженности негативных процессов в трофобласте оказывает влияние на развитие всех эмбриональных и экстраэмбриональных структур плодного яйца, что отражается на уровне экспрессии белков беременности, факторов роста, гормонов и других биологически активных веществ [2, 11, 12]. В своем исследовании мы проанализировали взаимосвязь изменения концентраций βХГЧ и белков беременности ПАМГ1, РАРРА у пациенток с ПЭ и при физиологически протекающей беременности. При ПЭ было отмечено значительное снижение уровней βХГЧ и РАРРА относительно нормативных значений (0,8–1,0 МОМ) и увеличение в 1,8–2 раза содержания ПАМГ1, что указывает на патологическое течение первой волны инвазии трофобласта и нарушение формирования ранней плаценты.
Было также отмечено, что во всех случаях манифестирования ранней ПЭ уровни РАРРА и βХГЧ были достоверно ниже 0,8 МОМ, а концентрация ПАМГ1 превышала 18 нг/мл. У беременных с поздней ПЭ четкой взаимосвязи результатов первого биохимического скрининга с особенностями течения беременности не найдено. Поэтому использовать уровни гормона βХГЧ и белков беременности для прогнозирования всех вариантов ПЭ нецелесообразно.
Развитие второй (материнской) стадии ПЭ связывают с гипоксией плаценты, нарушением ее перфузии, сформировавшейся на ранних сроках гестации. Клинические проявления ПЭ во второй половине беременности появляются тогда, когда развивается дисфункция эндотелия, нарушается микро и макроциркуляция, происходит активация воспалительных реакций в материнском организме [13]. Следует отметить, что наличие выраженной первичной плацентарной недостаточности не всегда приводит к развитию ПЭ, а может закончиться преждевременными родами, а также задержкой роста плода [2, 5, 12]. Становится понятным, что только сочетание нарушения плацентарного кровотока с генетическими, экологическими, конституциональными особенностями матери, наличием у нее предрасполагающих факторов к сердечнососудистым заболеваниям, эндотелиальной дисфункции может привести к ПЭ.
Соответственно, поиск объективных прогностических критериев неосложненного или осложненного течения беременности следует проводить с учетом выраженности гестационных изменений сердечнососудистой системы матери в соответствии с особенностями функционирования фетоплацентарного комплекса. Учитывая то, что клинические проявления ПЭ возникают после 20 недель беременности, мы провели оценку гестационных изменений центральной гемодинамики матери на протяжении второй волны инвазии трофобласта (в период с 11–13 до 17–20 недели).
В результате исследования установлено, что при неосложненной беременности происходит адекватная адаптационная перестройка материнской гемодинамики, направленная на удовлетворение постоянно возрастающих потребностей растущего плода. На протяжении второй волны инвазии трофобласта величины УО и МО возрастают примерно на 17–19% при одновременном снижении ОПСС на 11,7% и стабильных показателях систолического и диастолического АД.
У беременных с ПЭ выявлено нарушение гестационной адаптации материнской гемодинамики. Отмечено, что в период с 11–13 по 17–20 недель прирост объемных показателей работы сердца составил менее 10%, а ОПСС снизилось менее чем на 7%. Эти параметры могут служить прогностическими критериями дезадаптации гестационной гемодинамической перестройки сердечнососудистой системы матери и возможного развития ПЭ.
Низкий гестационный прирост УО и МО в начале беременности способен привести к гиповолемии, уменьшению маточноплацентарного кровотока, нарушению периферической микроциркуляции, микроструктуры и функции плаценты. Прогрессирование беременности в таких условиях является одним из факторов риска нарушения плацентарной перфузии и формирования плацентарной недостаточности, задержки роста и гипоксии плода, что ведет к росту количества новорожденных с перинатальными ишемическигипоксическими повреждениями.
Изучение эндотелийзависимой вазодилатации показало, что имеется прямая взаимосвязь между развитием ПЭ и выраженностью нарушений функции эндотелия. Установлено, что при физиологическом течении беременности активизация функции эндотелия к периоду завершения второй волны инвазии трофобласта составляет более 4%. Увеличение вазодилатирующей функции эндотелия в первой половине беременности характеризует адаптационные изменения материнской гемодинамики и соответствует гестационной норме.
Прогностическими критериями дезадаптации гемодинамических процессов и проявлениями дисфункции эндотелия к сроку 17–20 недель следует считать парадоксальный сосудистый ответ, проявляющийся вазоконстрикторными реакциями сосудистой стенки на проведение компрессионной пробы, а также низкий суммарный прирост вазодилатирующей функции эндотелия (менее 4%). Описанные реакции могут подтверждать наличие эндотелиальной дисфункции и совпадают с концепцией патогенеза ПЭ как проявления генерализованного эндотелиоза [9, 14]. Согласно этой теории, патологическая плацентация с формированием сниженной плацентарной перфузии стимулирует выброс в кровь ряда субстанций, активирующих или повреждающих клетки эндотелия сосудов матери.
Разбалансировка вазорегуляторных систем пациенток с ПЭ в сочетании с низким сердечным выбросом и высоким периферическим сосудистым сопротивлением способствует формированию гипертензивногиподинамической диссоциации.
Заключение
В соответствии с современным взглядом на патогенез преэклампсии (ПЭ) на ранних сроках гестации можно выделить группу риска развития плацентозависимых осложнений, в первую очередь первичной плацентарной недостаточности. Критериями для выделения групп риска следует считать наличие в анамнезе заболеваний сердечнососудистой системы, хронических воспалительных заболеваний, метаболических нарушений, указание на ПЭ в предыдущих беременностях, осложненное течение первого триместра настоящей беременности, а также объективные данные первого биохимического скрининга.
При уровнях РАРРА и βХГЧ менее 0,8 МОМ, содержании ПАМГ1 более 18 нг/мл беременным нужно рекомендовать дополнительные исследования, позволяющие оценить гестационную перестройку материнской гемодинамики на протяжении второй волны инвазии трофобласта. С этой целью необходимо двукратное обследование пациенток на сроках 11–13 и 17–20 недель с определением объемных показателей центральной гемодинамики матери — ударного (УО) и минутного (МО) объемов, общего периферического сосудистого сопротивления (ОПСС) — и вазодилатирующей функции эндотелия.
Если у беременных к сроку 17–20 недель прирост МО составит более 13–14%, ОПСС снизится более чем на 10–11%, а функциональная активность эндотелия увеличится на 4% и более, то можно предполагать неосложненное течение беременности (без проявлений ПЭ).
В тех ситуациях, когда в конце первой половины беременности гестационный прирост МО не превышает 10%, снижение ОПСС составляет не более 7% по сравнению с исходными, а функциональная активность эндотелия снижается или незначительно увеличивается (менее чем на 4%), прогнозируется возникновение ПЭ.








