ВВЕДЕНИЕ
Прошло больше 20 лет с того времени, как в России был внедрен метод индуцированной мокроты (ИМ) для оценки интенсивности воспаления дыхательный путей у взрослых пациентов, и более 10 лет с тех пор, как в практику врачей-аллергологов г. Челябинска внедрили метод ИМ и анализа цитологии ИМ для диагностики и мониторирования бронхиальной астмы (БА) у детей [1-3].
Ценность данной методики заключается в том, что она позволяет более достоверно и неинвазивно провести раннюю диагностику БА у детей раннего возраста, а также оценить эффективность проводимой базисной терапии [1]. Благодаря анализу цитологии ИМ стало возможным определить воспалительный фенотип на уровне слизистой оболочки бронхов [3-6].
У врачей появилась возможность получать цитологическую картину воспалительных изменений на уровне слизистой оболочки бронхов и наблюдать, как она меняется в разные периоды течения БА на фоне базисной терапии и без нее [4, 7].
Цель исследования: проследить динамику лабораторных показателей у детей с легкой персистирующей БА в разные периоды заболевания на фоне базисной терапии и без нее.
МАТЕРИАЛЫ И МЕТОДЫ
В проспективном когортном исследовании приняли участие 42 пациента с легкой персистирующей БА в возрасте от 5 до 16 лет: 28 мальчиков, 14 девочек. Исследование проводилось на базе детского аллергологического отделения МАУЗ ОТКЗ «Городская клиническая больница № 1» (г. Челябинск) с 2014 по 2019 г. Набор детей и последующее наблюдение осуществлялись в течение 5 лет, каждый ребенок наблюдался в течение 3 лет. Все дети состояли на диспансерном учете у врача-аллерголога в поликлинике, приходили на контрольные осмотры в декретированные сроки и при обострении.
В начале исследования и при каждом обращении у всех участников определяли содержание эозинофилов общего анализа крови (ОАК), назального секрета (НС) и ИМ, эозинофильного катионного протеина сыворотки крови (ЭКП), референсные значения которого в 0–12 лет — 0–10 нг/мл, более 12 лет — 0–24 нг/мл; исследовали ФВД и показатель ОФВ1.
Диагностически значимым считалось количество эозинофилов в НС ≥ 5%, в ИМ ≥ 2,5% [3].
В начале исследования также измеряли концентрации общего IgE (референсные значения с 1 года до 6 лет — 0–60 МЕ/мл, с 6 до 10 лет — 0–90 МЕ/мл, с 10 до 16 лет — 0–200 МЕ/мл) и специфических IgE. При постановке диагноза детям назначалась базисная терапия низкими дозами ингаляционных и назальных ГКС. На 1-м году наблюдения 18 детям, помимо базисной терапии, была назначена аллерген-специфическая иммунотерапия (АСИТ) причинно-значимым аллергеном.
Период исследования разделен нами на нижеследующие этапы, которые подверглись анализу.
Этап I (начало исследования) — у детей впервые выставлен диагноз БА легкого персистирующего течения: на момент обследования есть симптомы БА (обострение), базисную терапию они не получают.
Этап II (1-й год наблюдения) — на момент осмотра базисную терапию дети получают, симптомов БА нет (БА контролируемая).
Этап III (2-й год наблюдения) — на момент осмотра базисную терапию не получают, симптомов БА нет (период ремиссии БА).
Этап IV (3-й год наблюдения) — на момент осмотра зафиксировано обострение БА, базисную терапию дети не получают.
Этап V (3-й год наблюдения) — на момент осмотра симптомов БА нет, базисную терапию получают (БА контролируемая).
Статистический анализ полученных результатов проводился при помощи пакетов статистических программ Statistica 6.0. Для описания количественных признаков в выборке рассчитывались медиана и интерквартильный размах (Me; 25–75%).
Для сравнительного анализа данных при отличном от нормального распределении количественных признаков использовался непараметрический тест с критерием Вилкоксона. Оценку различий между группами по качественным признакам проводили с применением критерия χ2 и точного критерия Фишера.
Связь признаков исследовали с помощью вычисления коэффициента ранговой корреляции Спирмена. Статистически значимыми считались различия при p < 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Наследственность по аллергическим заболеваниям была отягощена у 31 (73,8%) ребенка. Атопический дерматит диагностирован у 24 (57,1%) детей, сопутствующий аллергический ринит — у 100% пациентов. Растительная сенсибилизация была выявлена у 34 (80,9%), бытовая — у 31 (73,8%), эпидермальная — у 29 (69,0%), пищевая — у 27 (64,3%), грибковая — у 15 (35,7%), поливалентная — у 30 (71,4%) детей.
У всех обследованных детей определялся эозинофильный воспалительный фенотип. Динамика полученных лабораторных показателей представлена в таблице.
Таблица
Лабораторные показатели обследованных детей в зависимости от клинической ситуации, %, Ме [25; 75]
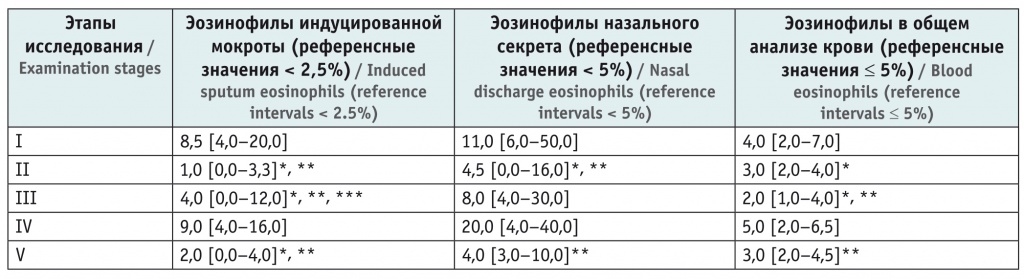
* Отличия от этапа I статистически значимы (р < 0,05).
** Отличия от этапа IV статистически значимы (р < 0,05).
*** Отличие от этапа II статистически значимо (р = 0,05).
Этап I (начало исследования). Как видно из таблицы, количество эозинофилов НС и ИМ у детей было выше референсных значений [3], причем повышенный уровень эозинофилов НС имели 35 (83,3%), а эозинофилов ИМ — 36 (85,7%) человек. У 20 (47,6%) пациентов было увеличено содержание эозинофилов в ОАК.
Выявленные изменения вполне закономерны, так как у пациентов с БА преобладает эозинофильный фенотип [8-10]. При анализе иммунологических показателей обнаружено, что уровень ЭКП повышен у 38 (90,5%), уровень общего IgE — у 33 (78,6%) больных.
При исследовании ФВД ОФВ1 был снижен только у 6 (14,3%) пациентов. По данным других исследователей, показатели ФВД у детей с БА часто бывают в пределах возрастной нормы, особенно при легком или контролируемом течении [11, 12].
Этап II (БА контролируемая). Как видно из таблицы, уровни эозинофилов ИМ, НС и ОАК статистически значимо снизились по сравнению с таковыми на этапе I и достигли референсных значений. Уменьшение ОФВ1 наблюдалось у 1 (2,4%) ребенка. Положительная динамика показателей может быть объяснена действием препаратов базисной терапии — ингаляционных ГКС.
Этап III (период ремиссии БА). У детей в период ремиссии БА показатели эозинофилов ИМ и НС превышали норму, количество эозинофилов ИМ стало выше, чем на фоне базисной терапии (этап II) (р = 0,05) (см. табл.). У 3 (7,1%) детей отмечалось снижение ОФВ1. Концентрация ЭКП была увеличена у 14 (33,3%) детей (рI–III < 0,05).
Этап IV (3-й год наблюдения, обострение БА). Уровни эозинофилов ИМ, НС, ОАК существенно повысились по сравнению с таковыми на фоне контролируемого течения БА (этап II) и ремиссии БА (этап III), они стали сопоставимыми со значениями этапа I. У 22 (52,4%) детей зафиксирован рост концентрации ЭКП (рIII–IV < 0,05), у 6 (14,3%) — уменьшение ОФВ1.
Этап V (3-й год наблюдения, контролируемая БА). Уровни эозинофилов ИМ, НС и ОАК находились в пределах референсных значений. Повышение содержания ЭКП отмечено у 14 (33,3%) пациентов, снижение ОФВ1 — у 4 (9,5%).
На 1-м году наблюдения 18 детям была назначена АСИТ причинно-значимым аллергеном, соответственно, 24 ребенка АСИТ не получали. У нас появилась возможность определить, влияет ли сопутствующая АСИТ на лабораторные показатели пациентов.
Среди получавших базисную терапию и терапию АСИТ на фоне контролируемого течения БА детей с повышенным уровнем эозинофилов ИМ было 7 (38,9%), НС — 6 (33,3%), ОАК — 3 (16,7%), среди детей без АСИТ — 10 (41,7%), 13 (54,2%) и 4 (16,7%) соответственно. На фоне контролируемого течения БА у детей с и без АСИТ полученные данные были сопоставимыми (р > 0,05) [13].
В периоде ремиссии детей, получавших АСИТ (n = 18), с повышенным уровнем эозинофилов ИМ было 7 (38,9%), НС — 12 (66,7%), ОАК — 2 (11,1%); без АСИТ (n = 24) — 9 (37,5%) и 13 (54,2%) соответственно, увеличение количества эозинофилов ОАК отсутствовало (во всех случаях р > 0,05).
Во время обострения БА в группе АСИТ было 16 (88,9%) детей с повышенным уровнем эозинофилов ИМ, НС — 16 (88,9%), ОАК — 10 (55,6%); в группе детей без АСИТ — 20 (83,3%), 19 (79,2%), 6 (25,0%) соответственно. Таким образом, в нашем исследовании не выявлены отличия в лабораторных показателях у детей, получавших и не получавших АСИТ, на фоне терапии низкими дозами ингаляционных и назальных ГКС.
Далее нами проанализирован уровень эозинофилов ИМ, на фоне которого появлялись симптомы БА, он составил 8,0% [3,0–16,0%]. По данным иностранных исследователей, сам по себе эозинофильный фенотип является более значительным фактором риска обострения БА, чем остальные фенотипы [5, 14]. У пациентов с эозинофильным воспалительным фенотипом обострения в течение года случаются чаще, чем у больных с нейтрофильным фенотипом [14]. Мы предлагаем при уровне эозинофилов ИМ 8,0% [3,0–16,0%] в зависимости от клинической ситуации либо повышать ступень базисной терапии, если ребенок ее получал, либо возобновлять базисную терапию, если в этот момент был перерыв.
Нами также проведен корреляционный анализ изучаемых показателей, по результатам которого вне зависимости от периода заболевания имеется слабая положительная корреляционная связь (r = 0,28, р < 0,05) между уровнем эозинофилов крови и ИМ и умеренной силы положительная корреляционная связь (r = 0,32, р < 0,05) между концентрациями эозинофилов мокроты и ЭКП крови, что не противоречит данным других исследователей [6].
ЗАКЛЮЧЕНИЕ
По результатам нашего исследования, количественно эозинофильный воспалительный фенотип у пациентов не менялся в зависимости от стажа заболевания и проведенных курсов базисной терапии ингаляционными и назальными ГКС и аллерген-специфической иммунотерапии (АСИТ), что вызывает вопросы у многих исследователей, занимающихся детской астмой [7, 15]. Это нехарактерно для взрослых пациентов, у которых воспалительный фенотип может меняться в зависимости от стажа заболевания, частоты обострений и курения [5].
Терапия ингаляционными и назальными ГКС на фоне обострения бронхиальной астмы (БА) способствовала нормализации количества эозинофилов индуцированной мокроты (ИМ) и назального секрета (НС).
У детей в период ремиссии БА отмечалось повышение содержания эозинофилов НС и ИМ, хотя симптомы ринита и БА пациентов не беспокоили.
Не выявлены отличия в лабораторных показателях у детей, получающих и не получающих АСИТ.
Уровень эозинофилов ИМ, на фоне которого происходило обострение БА, составил 8,0% [3,0–16,0%]. Этот показатель можно использовать как дополнительный предиктор необходимости увеличения объема терапии (переход на ступень вверх).
Поступила: 02.07.2020
Принята к публикации: 23.09.2020








