Болезнь Вильсона — Коновалова (БВК), гепатолентикулярная дегенерация, генетически обусловленное нарушение обмена меди — одно из серьезнейших заболеваний, протекающих под маской гепатита невыясненной этиологии (ГНЭ). В последнее время проблема БВК актуализировалась в связи с расширением возможностей диагностики и появлением эффективных методов лечения.
Заболевание характеризуется годами бессимптомного течения, проявляясь клинически лишь на стадии необратимых изменений печени (цирроза) и лентикулярных структур мозга.
До настоящего времени данные о частоте БВК у детей практически отсутствуют, а диагностические возможности остаются предметом дискуссий. При этом раннее распознавание болезни, до развития выраженных клинических проявлений, и своевременное назначение специфической терапии способны полностью изменить судьбу ребенка: предотвратить неизбежные трагические события с развитием прогрессирующего цирроза печени и тяжелого поражения мозга.
Цель данной статьи: дать представление о современном состоянии проблемы БВК у детей и изучить клинико-лабораторные проявления, частоту и значение выявления болезни среди детей с ГНЭ.
Проведен обзор и анализ имеющихся данных мировой литературы по БВК в детском возрасте, а также обследованы 103 ребенка 3–16 лет с диагнозом ГНЭ (длительность наблюдения — 3–7 лет). Наряду с показателями общеклинических исследований определялись показатели обмена меди в крови и в суточной моче. Генетические исследования включали выявление мутаций в гене АТР7В с изучением от 12 до 34 аллелей.
БВК впервые описана S.A.K. Wilson в 1912 г., а в дальнейшем на протяжении 1927–1960 гг. на большом клиническом материале Н.В. Коноваловым досконально изучены ее патоморфология, патофизиология и биохимические проявления [1].
По современным воззрениям, БВК — тяжелая наследственная патология, генетически детерминированная с аутосомно-рецессивным типом наследования, жестко привязанная к гену АТР7В, кодирующему транспортирующую медь АТФазу печени, но имеющая высокую аллельную гетерогенность (более 500 мутаций). При этом возможно как гомо-, так и гетерозиготное состояние.
Патогенез БВК обусловлен дефектом медь-АТФазы в мембране гепатоцитов, который вызывает нарушение выведения меди с желчью, неуклонное накопление меди в печени, головном мозге, почках, роговице глаза с повреждением этих органов. В зависимости от основного органа-мишени различают печеночную и неврологическую формы. Изредка встречаются смешанные формы, но преобладают печеночные.
Последние данные о распространенности БВК в мире представлены в 2019 г. в работе [2], в которой проведен систематический поиск всех соответствующих исследований распространенности болезни. Авторы отмечают, что предыдущие сведения такого рода были получены в 1984 г. (оценка Шейнберга — Штернлиба). Частота БВК была равна 1 : 30 000, но эти сведения основывались на ограниченных тогда данных. Хотя оценка Шейнберга — Штернлиба предполагает большое количество пропущенных случаев с потенциально фатальными последствиями, она все еще широко используется.
В настоящее время доступны клинические и генетические исследования более высокого качества. В нашу работу включены эти данные для обновления оценки и получения современного представления о распространенности заболевания.
В общей сложности в окончательный анализ вошли 59 исследований (50 клинических и 9 популяционно-генетических), проведенных на основе требований доказательной медицины. Выделены четыре недавних клинических исследования, основанных на общенациональных базах данных высокого качества, с оценками частоты БВК от 1 : 29 000 до 1 : 40 000. Болезнь более распространена в отдельных популяциях благодаря частым бракам двоюродных братьев и сестер и/или более высокой частоте мутаций. При расчете распространенности на основе заболеваемости, связанной с числом рождений, она составляла от 1 : 40 000 до 1 : 50 000.
Клинические скрининговые исследования, включая исследование на наличие кольца Кайзера — Флейшера или уровень церулоплазмина в крови, не улучшили эти оценки из-за недостаточного размера выборки, а также недостаточной специфичности показателя церулоплазмина или позднего и нечастого появления при печеночных формах болезни колец Кайзера — Флейшера.
Результаты популяционных генетических исследований в США и Великобритании не расходились с клиническими оценками распространенности заболевания. Однако возникает вопрос, является ли пенетрантность действительно 100%-ной, как это принято считать.
Мы допускаем, что первоначальная характеристика частоты БВК (1984) от 1 : 30 000 до 1 : 50 000 все еще кажется действительной, по крайней мере для США, Европы и Азии. Однако обращаем внимание на то, что в некоторых популяционных исследованиях генетическая распространенность была в 3–4 раза выше, чем клинические оценки. Проблема требует дальнейшего изучения.
Работ, специально рассматривающих частоту встречаемости БВК в детском возрасте, мы не встретили. Это положение напрямую соотносится с проблемой поздней диагностики заболевания. Она представляет собой очень важную, но чрезвычайно сложную задачу. По данным клиницистов, имеющих огромный опыт наблюдения больных БВК, в том числе детей, диагноз непоправимо запаздывает — как минимум на 4–15 лет [3, 4].
Это связано с клиническими особенностями заболевания, которое характеризуется, с одной стороны, многолетним отсутствием симптомов, «клинической тишиной», с другой — редкой многоликостью, позволяющей клиницистам давать ему такие названия, как «великий имитатор» [5], «хамелеон» [6], «чемпион камуфляжа» [7]. Возраст манифестации широко варьирует — от менее 1 года до более 70 лет [5]. Клинические симптомы неспецифичны и многообразны, а наиболее частыми клинико-лабораторными проявлениями становятся «необъяснимое» упорное повышение активности трансаминаз и непостоянное и умеренное увеличение размеров печени [3, 7].
Поэтому любое неясное поражение печени — повод для поиска или исключения БВК в любом возрасте [7, 8].
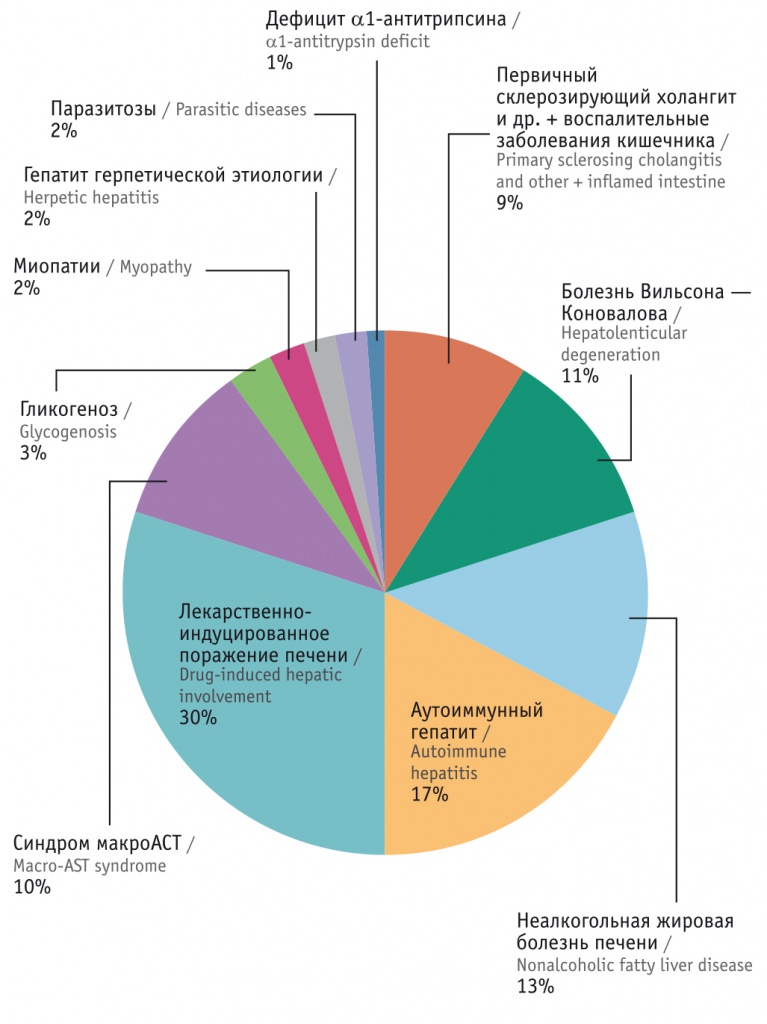
По нашим данным (рис.), БВК занимает заметное место (11%) среди наиболее часто диагностируемых заболеваний в группе детей, обследуемых по поводу ГНЭ, уступая лишь наиболее часто встречающимся патологиям — лекарственному и аутоиммунному гепатитам и неалкогольной жировой болезни печени (НАЖБП) [9]. Самым ранним симптомом было необъяснимое повышение активности АЛТ и АСТ. Аналогичные данные приводят и другие исследователи [3, 10], настаивая на недостаточной специфичности большинства используемых тестов [6, 10-12].
Рис. Этиология поражения печени у детей с диагнозом гепатита невыясненной этиологии
Алгоритм распознавания БВК, естественно, требует параллельного исключения вирусного, инфекционного, паразитарного поражения печени, НАЖБП, аутоиммунного и лекарственного гепатита.
Если рассмотреть современные диагностические критерии БВК и значимость отдельных диагностических параметров в исторически-хронологическом порядке их появления в клинической практике, получаем следующие данные [7, 8, 10-13].
Кольцо Кайзера — Флейшера у детей до 6 лет отсутствует при всех формах. Чувствительность этого симптома — 72,2%, при печеночной форме низкая — 63,3%, при неврологической высокая — 93,4%. Специфичность его высокая, но появление весьма позднее (чаще всего на фоне уже сформировавшихся тяжелых и необратимых изменений в органах), в связи с чем он не может служить для ранней диагностики БВК.
Снижение уровня церулоплазмина в крови — биохимический тест, когда-то считавшийся главным, на основании которого ставился или снимался диагноз БВК. В настоящее время его значимость в этом качестве подвергается сомнению, так как показано, что при умеренной чувствительности (71%) специфичность его очень низка — 50%.
Повышение уровня меди в суточной моче — более чувствительный (86,7%) и специфичный (78%) тест. Он до настоящего времени служит первым ориентировочным и, в случае положительных результатов, одним из подтверждающих диагноз исследованием.
Тест с D-пеницилламином менее чувствителен (78%), но высоко специфичен (97%), в связи с чем полезен как дополнительный, подтверждающий результаты анализа на уровень меди в суточной моче.
Медь в ткани печени при гистологическом исследовании биопсийного материала (окраска биоптата на содержание меди родамином) — при довольно высокой чувствительности (91%) недостаточно специфичный тест (65,4%) и может не выявить увеличение ее количества в препарате. Отсутствие или слабая выраженность данных о повышении содержания меди в биоптате не должны служить основанием для снятия диагноза БВК, тем более что подобное наблюдается, как правило, на ранних стадиях заболевания, когда диагноз особенно важен и судьбоносен. Поэтому диагностическая необходимость пункционной биопсии печени у детей при подозрении на БВК недостаточно оправдана, а результаты не абсолютны. При большинстве заболеваний печени, особенно в педиатрии и на фоне внедрения эластографии, указанное инвазивное исследование перестает быть «золотым стандартом» диагностики.
Генетическое обследование (прямое секвенирование ДНК) представляет собой в настоящее время основу диагностики БВК. Но даже это самое современное диагностическое исследование при практически 100%-ной специфичности не имеет 100%-ной чувствительности и пенетрантности (90%).
Сегодня можно утверждать, что три главных фактора своевременной диагностики БВК следующие:
1) постоянная настороженность в отношении заболевания, «высокий индекс подозрительности» [5, 7] при любом неясном поражении печени;
2) учет всей совокупности клинико-лабораторных параметров при целенаправленном обследовании, включая генетические;
3) осторожная оценка пороговых и/или отрицательных значений тестов в плане отказа от диагноза БВК, поскольку ни один из них в отдельности, даже генетический (неполный охват аллелей), не может служить для этого достаточным основанием.
В очень сложных случаях допустимо прибегнуть к пробному лечению (ex juvantibus) специфическими препаратами (D-пеницилламином и др.) в течение 1–3 месяцев.
Подобный подход диктуется тем, что лечение хелаторами меди высокоэффективно и способно предотвратить тяжелые органные поражения и летальный исход, но лишь при своевременной постановке диагноза в доцирротическую фазу заболевания [3, 5-9].
Соотношение клинического и генетического диагнозов хорошо продемонстрировано в работе J. Usta и соавт. [14], где представлено распределение гена БВК в одной ливанской семье. Обследованы 76 членов семьи, в которой зарегистрированы 7 единокровных браков и 9 больных клинически выраженной БВК. Печеночная форма была у 6 человек, неврологическая — у 2, смешанная — у 1. При генетическом обследовании найдены 33 носителя мутации гена АТР7В.
По нашим данным за 5 лет (2012–2017), у 12 детей в возрасте 3–17 лет с подозрением на БВК генетическое подтверждение получено в 100% случаев, при этом гомозигота — у 9, гетерозигота — у 3 (3 : 1), классическая мутация (12 аллелей) выявлена у 10 детей, а у 2 обследованных мутации, подтвердившие диагноз, обнаружены лишь при расширенном поиске (34 аллели). На момент обследования в связи с диагнозом ГНЭ доцирротическая стадия была у 10 детей, а цирроз печени классов А, В по Чайльд — Пью — у 2 детей. Эффективность лечения, начатого у 10 пациентов в доцирротическую фазу, достигла 100%.
Приведем два клинических примера.
Больной С., 1989 года рождения, Республика Беларусь
15.10.2013 г. — упал в метро, доставлен в больницу, где впервые обнаружено резкое увеличение и плотность печени и селезенки. Общий анализ крови: снижение уровня гемоглобина (87 г/л), числа лейкоцитов (2,1 × 109/л) и тромбоцитов (90 × 109/л). Активность АЛТ и АСТ — 3N, уровень γ-глютамилтранспептидазы (ГГТ) — 2N, содержание общего белка и альбумина снижено в 1,5 раза, γ-глобулина — увеличено до 30%. Анализ на маркеры гепатитов В, С отрицательный.
Диагноз: Цирроз печени невыясненной этиологии.
Выписан домой.
На приеме. Учится в институте и работает в Москве. Вредных привычек нет. Считал себя здоровым. В анамнезе: в 9 лет впервые обнаружены увеличение печени и повышение активности трансаминаз в 1,5–2 раза. Диагноз — вирусный гепатит А, которым и пытались объяснять в последующем неоднократно (в течение 15 лет!) периодические рост активности трансаминаз и увеличение печени. При дополнительном обследовании — фиброз печени при эластографии (F-4). Уровень церулоплазмина в 2 раза ниже нормы, проба с D-пеницилламином в суточной моче резко положительна.
Диагноз: Болезнь Вильсона — Коновалова.
Направлен на обследование с целью решения вопроса о трансплантации печени.
Больная Р., 2003 года рождения, Пермский край, г. Березники
Беременность матери и роды — без особенностей. Ранний анамнез: частые ОРВИ, бронхиты, 2 раза пневмония.
Июль 2005 г. Впервые на УЗИ — умеренная гепатоспленомегалия при нормальных биохимических пробах, которая безосновательно объяснялась частыми заболеваниями.
Октябрь 2009 г. Боли в животе, печень выступает на 2 см из-под края реберной дуги, активность АЛТ и АСТ увеличена в 1,5–2 раза. Выявляются анти-IgG к хламидиям. Диагноз: Хламидиоз с поражением печени. Лечение азитромицином, ИФН α-2b. Активность АЛТ и АСТ временно нормализовалась.
Март 2010 г. Активность АЛТ — 2–5N, АСТ — 1,5–13N, содержание щелочной фосфатазы — 1,5N, ГГТ — 6N. Выявлены антитела к вирусу Эпштейна — Барр и герпесу 6-го типа. Пролечена с минимальным и кратковременным улучшением проб.
Май 2010 г. Впервые обследована на БВК: уровень церулоплазмина оказался равным 10,1 г/дл при норме 19–49 г/дл, уровень меди в крови — 10,0 мкг/л при норме 13–25 мкг/л, содержание меди в суточной моче (без пробы с D-пеницилламином) в норме.
При генетическом обследовании в Медико-генетическом научном центре им. акад. Н.П. Бочкова найдена мутация с.3207 С > А в гетерозиготном состоянии.
Диагноз: Болезнь Вильсона — Коновалова. Начато лечение D-пеницилламином в дозе 250 мг/сут.
Ноябрь 2010 г. Госпитализация в Российскую детскую клиническую больницу (РДКБ) ФГАОУ ВО «РНИМУ им. Н.И. Пирогова». Активность АЛТ и АСТ — 2–2,5N, концентрация церулоплазмина в 2 раза ниже нормы, проба с D-пеницилламином в суточной моче резко положительная (52,3 мг до и 236 мг после приема D-пеницилламина), на УЗИ — умеренная гепатомегалия, однако пункционная биопсия печени, выявившая нарушение архитектоники, порто-портальные септы, дискомплексацию балок, но не давшая положительной реакции на медь (Biooptica), послужила основанием для снятия диагноза БВК (?!) и отмены D-пеницилламина.
Июнь 2011 г. На фоне отмены D-пеницилламина ситуация резко ухудшилась. Повторная госпитализация в РДКБ. Активность АЛТ и АСТ повысилась до 3N, проба с D-пеницилламином — 330,4 мг против 61,0 мг, УЗИ-диффузные изменения паренхимы печени, эластография — F-2. Диагноз БВК подтвердился, снова назначен D-пеницилламин, на этот раз в адекватной дозе (500 мг/сут).
2012–2015 гг. Общий анализ крови, биохимические пробы стойко в норме, УЗИ без отклонений. Фиброз — F-0.
Март 2016 г. (на приеме). Тринадцатилетняя девочка, жалоб нет, интеллектуальное и физическое развитие в норме. Состояние органов без отклонений. Все лабораторные показатели в норме.
На МРТ головного мозга — единичные очаги глиоза при отсутствии отклонений в неврологическом статусе.
У матери ребенка при генетическом обследовании также выявлена БВК в гетерозиготном состоянии (бессимптомная форма).
Заместительное лечение препаратами, способствующими выведению меди (D-пеницилламином, препаратами цинка и др.), назначается на всю жизнь и при адекватных дозах дает выраженный положительный эффект уже через 6–12 месяцев [3]: снижается активность трансаминаз, нормализуется суточная экскреция меди с мочой, уменьшаются размеры и степень фиброза печени.
По мере накопления опыта лечения больных БВК выясняется, что, кроме своевременности назначения терапии, важную роль играет приверженность пациента к лечению. Целый ряд работ последнего времени посвящен специально этому вопросу.
Так, W. Maselbas и соавт. в 2019 г. [15] отмечают, что у пациентов с хроническими заболеваниями, как правило, низкая комплаентность к медикаментозному лечению, что влияет на его эффективность. Целью исследования было оценить степень приверженности к многолетнему лечению пациентов с БВК, проанализировать ее влияние на исход заболевания и выявить факторы, способные воздействовать на комплаентность к терапии.
Ретроспективно проанализированы 170 пациентов с БВК, которые начали лечение между 1995 и 2005 г., для оценки постоянства или непостоянства терапии. Последнее было определено как по крайней мере один зарегистрированный перерыв продолжительностью более 3 месяцев или минимум два перерыва продолжительностью более 2 месяцев.
Выяснилось, что только 74,1% пациентов непрерывно продолжали лечение в течение 11,7 года наблюдения. Регулярность лечения серьезно влияла на клинические результаты. У «постоянных» больных улучшение состояния и отсутствие прогрессирования БВК наблюдались существенно (в 2–20 раз) и высоко значимо чаще, чем у «непостоянных» (29,4% и 68,3% против 2,3% и 45,5%; р < 0,001 в обоих случаях). Напротив, у «непостоянных» пациентов намного чаще отмечалось ухудшение течения БВК (52,3% против 2,4%).
Тип лечения БВК, пол, фенотипические особенности и даже нежелательные явления, связанные с приемом лекарств, существенно не влияли на приверженность к лечению. Зато уровень образования (высшее, среднее) и внимательное отношение семьи стали наиболее важными факторами, связанными с поддержанием комплаентности к терапии.
Подобного же мнения придерживаются отечественные педиатры [3, 9].
Педиатр, столкнувшийся с неясными клинико-лабораторными проявлениями поражения печени, обязательно должен подумать о возможности БВК, провести целенаправленное обследование и в случае ее распознавания назначить адекватную терапию хелаторами меди, объяснив родителям важность и необходимость пожизненного лечения.
ЗАКЛЮЧЕНИЕ
Болезнь Вильсона — Коновалова (БВК) у детей — нередкая причина поражения печени, встречающаяся среди гепатитов невыясненной этиологии с частотой 11–12%.
Диагностика трудна и обеспечивается преимущественно совокупностью таких тестов, как оценка уровня меди в суточной моче и генетическое исследование на БВК при исключении других известных и распространенных причин поражения печени (вирусных, неалкогольной жировой болезни печени, аутоиммунного гепатита, первичного склерозирующего холангита на фоне воспалительных заболеваний кишечника и др.).
Ключевыми моментами, определяющими предотвращение тяжелых органных поражений и летального исхода у детей с БВК, являются высокая настороженность в отношении этого заболевания и максимально раннее выявление болезни, обеспечивающее своевременное начало терапии и благоприятную судьбу пациента.
Поступила: 04.03.2020
Принята к публикации: 20.03.2020








