ВВЕДЕНИЕ
Бронхиальная астма (БА) является гетерогенным заболеванием, характеризующимся хроническим воспалением дыхательных путей, наличием респираторных симптомов (свистящих хрипов, одышки, заложенности в груди, кашля), которые проявляются вследствие вариабельной обструкции дыхательных путей и изменяются во времени и по интенсивности1 [1].
В последнее время ученые все чаще сходятся во мнении, что формирование различных фенотипов зависит от особенностей взаимодействия организма с окружающей средой, выделяя различные паттерны хрипов (ранние, транзиторные, персистирующие, поздние), различные виды воспаления (эозинофильное, нейтрофильное) и разный ответ на лечение1.
У детей БА чаще всего относится к атопическому Тh-2 типу с высокой экспрессией цитокинов 2-го типа и ассоциированных воспалительных клеток, представляя собой классический эозинофильный фенотип. Второй вариант, с низкой экспрессией цитокинов 2-го типа и преобладанием нейтрофильного воспаления дыхательных путей, у детей встречается редко1 [2, 3].
Выделение фенотипов и эндотипов имеет решающее значение для назначения персонифицированной терапии. Целью терапии является достижение полного контроля астмы, определяемого как нормальная функция легких, отсутствие симптомов и риска обострений в будущем. На сегодняшний день для контроля симптомов и снижения риска серьезных обострений всем пациентам с БА рекомендовано использование ингаляционных ГКС (ИГКС) либо по требованию (при легкой астме), либо для базисной противовоспалительной терапии.
Для безопасности терапии Global Initiative for Asthma (GINA) больше не рекомендует лечение только β2-агонистами короткого действия (КДБА). Хотя препараты этой группы и обеспечивают кратковременное облегчение симптомов астмы, существуют убедительные доказательства, что применение КДБА не предотвращает серьезные обострения, а регулярное или частое использование этих препаратов увеличивает риск обострений1 [4].
Согласно инструкции, ИГКС в сочетании с β2-агонистами длительного действия (ДДБА) назначаются с 6 лет1. У детей с легкой БА альтернативой могут быть антагонисты лейкотриеновых рецепторов (АЛР).
Одно из важнейших направлений в мониторинге БА — исследование биомаркеров воспаления. На сегодняшний день доступно лишь несколько биомаркеров, свойственных Th-2 типу БА. К ним относятся количественное определение эозинофилов в крови и мокроте, уровень IgE и периостина в сыворотке крови, уровень оксида азота в выдыхаемом воздухе (FeNO). В большинстве случаев они используются в исследовательских работах, при диагностике сложных вариантов БА, а также при назначении персонифицированного, таргетного лечения [5].
Одним из изучаемых и, что немаловажно в детской практике, неинвазивных маркеров БА, помогающих в оценке состояния воспаления дыхательных путей, является определение уровня FeNO. По данным Американского торакального сообщества (АТС), FeNO признан показателем эозинофильного воспаления дыхательных путей [6].
Оксид азота (NO) синтезируется во всех отделах респираторной системы. Основное количество NO синтезируется в эпителиальных клетках нижних дыхательных путей, которые секретируют NO в просвет дыхательных путей, где он смешивается с альвеолярным NO во время выдоха, что приводит к усреднению его концентрации в выдыхаемом воздухе [7]. Необходимо учитывать, что на уровень FeNO может влиять множество факторов, таких как табачный дым, вирусные респираторные инфекции, раса, пол и т. д. [8].
Методика проведения и результаты исследования FеNO стандартизованы. В соответствии с рекомендациями АТС, уровень FeNO > 50 ppb указывает на наличие эозинофильного воспаления и может использоваться в оценке ответа на кортикостероидную терапию [9, 10]. Значения FeNO между 20 ppb и 50 ppb рекомендовано интерпретировать в соответствии с клинической симптоматикой, с учетом предыдущих уровней FeNO и наличием или отсутствием терапии ИГКС. Содержание FeNO < 20 ppb свидетельствует о маловероятном наличии эозинофильного воспаления или нормализации в ответ на терапию ГКС.
В последних исследованиях предполагается использование значения 20 ppb в качестве разумной нижней границы нормы. Это значение может варьировать в зависимости от возраста ребенка и его анамнеза [8]. Так, у детей с атопией базовые показатели могут быть повышены, а у подростков-курильщиков — понижены.
Согласно рекомендациям GINA (2019), FeNO не является единственным параметром для определения или исключения диагноза астмы, однако его высокие значения повышают вероятность диагноза БА, а низкие не исключают его.
Цель исследования: оценить показатели FeNO у детей с легкой БА в зависимости от достигаемого контроля заболевания и динамику уровня FeNO после 3-месячного курса лечения АЛР или низкими дозами ИГКС.
МАТЕРИАЛЫ И МЕТОДЫ
На базе Клинического института детского здоровья им. Н.Ф. Филатова ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет) в 2018–2020 гг. проведено проспективное рандомизированное контролируемое исследование. В него включены 120 детей в возрасте 5–15 лет, из которых у 90 детей основной группы установлен диагноз легкой персистирующей БА (диагноз был поставлен не менее чем за 12 месяцев до настоящего исследования). Контрольную группу составили 30 практически здоровых детей сходного возраста без острых и хронических заболеваний.
Проведен анализ данных анамнеза, аллергологического статуса, показателей спирометрии и FeNO, опросника по контролю над астмой (Asthma Control Questionnaire 5, ACQ-5). ACQ-5 является валидизированным опросником, включающим оценку наиболее часто встречающихся симптомов астмы. Каждому из пунктов опросника присваивается значение от 0 до 6. Общий балл ACQ-5 вычисляется как среднее арифметическое для пяти ответов: < 0,5–0,74 — хороший контроль, 0,75–1,5 — частичный контроль, > 1,5 — неконтролируемая астма. Анкета использовалась в форме, предусматривающей самостоятельное заполнение без помощи врача.
Статистическая обработка результатов проводилась с использованием базовых методов описательной статистики, универсальных непараметрических алгоритмов программы PAST, в которой реализованы современные построения ДИ и статистических сравнений на основе процедур бутстрэпа и Монте-Карло. Для статистического описания этих признаков проверяли их согласие с нормальным распределением и оценивали средние значения, медианы с 95%-ми ДИ.
Для статистических сравнений в двух независимых и связанных выборках (группах) применяли F-критерий Снедекора — Фишера и критерии Левина для проверки равенства дисперсий, t-критерий Стьюдента, критерий Уэлча. Сравнение данных основывали не только на P-значениях, но и на 95%-ных ДИ для разности сравниваемых средних значений.
У всех пациентов основной группы исходно и в ходе наблюдения проведены общий анализ крови с определением количества эозинофилов, уровня общего IgE в сыворотке крови и ФВД с оценкой форсированной жизненной емкости легких (ФЖЕЛ), ОФВ1 и ОФВ1/ФЖЕЛ.
Уровень FeNO оценивался с помощью портативного прибора NOBreath (Великобритания) до и после лечения.
У участников контрольной группы данные исследования проводились однократно.
РЕЗУЛЬТАТЫ
Отягощенный семейный аллергологический анамнез был у 89,6% пациентов, из них у 59,8% один из родителей имел аллергическое заболевание (у 30,1% — мать, у 29,7% — отец), у 3,5% аллергическими заболеваниями страдали одновременно оба родителя. У других родственников аллергические проявления отмечались в 26,3% случаев.
У всех больных выявлена сенсибилизация к различным группам аллергенов (пыльцевым, бытовым, пищевым, эпидермальным, лекарственным, инфекционным): у 9,5% наблюдалась сенсибилизация только к одной группе аллергенов, у 36,7% — к двум, у 29,1% — к трем, у 24,7% — более чем к трем группам аллергенов.
Анализ базисной терапии пациентов с БА показал, что в течение последнего года до включения в исследование 38% детей получали ИГКС (будесонид, флутиказон) курсами по 2–3 месяца, 29% детей — АЛР (монтелукаст) курсами от 1 до 3 месяцев, 20% — низкие дозы комбинированных ИГКС + ДДБА (будесонид + формотерол) курсами до 2–3 месяцев, 13% — ИГКС и АЛР курсами до 3 месяцев.
При включении в исследование все дети и/или их родители заполняли опросник ACQ-5. Согласно проанализированным данным, у 36,6% пациентов из основной группы результат составил < 0,75, что расценивалось как полностью контролируемое течение БА на момент включения в исследование. У 63,4% больных результат — 0,75–1,25, что интерпретируется как частичный контроль заболевания. На основании данных E.D. Bateman и соавт., риск обострений в группах соответственно составлял 13–18% и 23–24% [11].
Исходно показатели FeNO были повышены у 56,6% пациентов с БА. При этом 86,2% из них составили больные с частично контролируемым течением БА и 13,8% с так называемым полным контролем. В контрольной группе у всех участников уровень FeNO был в пределах нормы.
Основную группу (90 детей) рандомизировали на подгруппы А и В методом конвертов. Подгруппу А составили 50 детей с легкой БА, получавшие АЛР (монтелукаст) в течение 3 месяцев, подгруппу В — 40 детей с легкой БА, которым были назначены низкие дозы ИГКС: флутиказона пропионат в дозе 50–125 мкг (n = 25) или будесонида Турбухалер в дозе 100 мкг 1 или 2 раза в день (n = 15).
Исходно дети в подгруппах А и В были сопоставимы по основным оцениваемым показателям — ФВД и FeNO (табл.).
Таблица
Показатели оксида азота в выдыхаемом воздухе (FeNO) и спирографии до лечения у детей с бронхиальной астмой
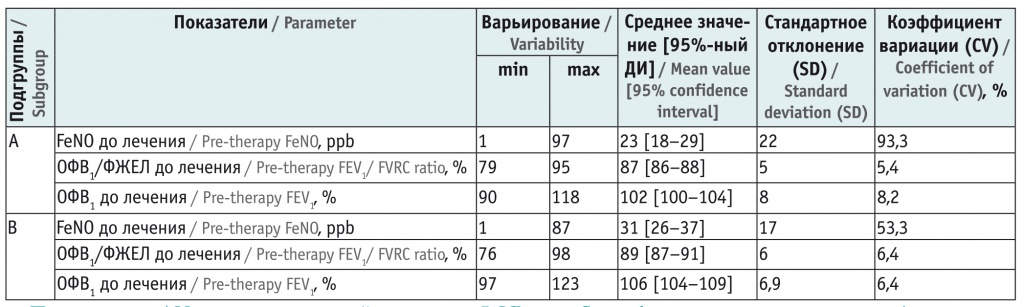
Примечание: ДИ — доверительный интервал, ОФВ1 — объем форсированного выдоха за 1-ю секунду, ФЖЕЛ — форсированная жизненная емкость легких.
Исходно показатель FeNO был повышен у 28 (70%) пациентов подгруппы В (38,4 ± 14,2 ppb), а в подгруппе А только 20 (40%) больных имели значимое увеличение уровня FeNO (42,83 ± 21,9 ppb, p < 0,05 при сравнении между подгруппами по количеству пациентов с повышенным уровнем FeNO). После 3-месячного курса лечения АЛР у детей в подгруппе А и низкими дозами ИГКС у детей в подгруппе В уровень FeNO был измерен повторно. Выявлено значительное уменьшение показателей FeNO в обеих подгруппах: в подгруппе А они нормализовались у 76,6% детей, в подгруппе В — у 66,6%.
Однако средний показатель FeNO снизился в подгруппе А с 42,83 ppb до 11,9 ppb (р < 0,05), в подгруппе В — c 38,4 ppb до 14,95 ppb (р < 0,05). Таким образом, cнижение было более выражено у детей, получавших низкие дозы ИГКС (р < 0,05). Сохраняющееся повышение у 33,4% из них уровня FeNO вследствие персистирующего минимального воспаления свидетельствует о необходимости продолжения терапии низкими дозами ИГКС (рис. 1).
Рис. 1. Уровень оксида азота выдыхаемого воздуха у участников исследования

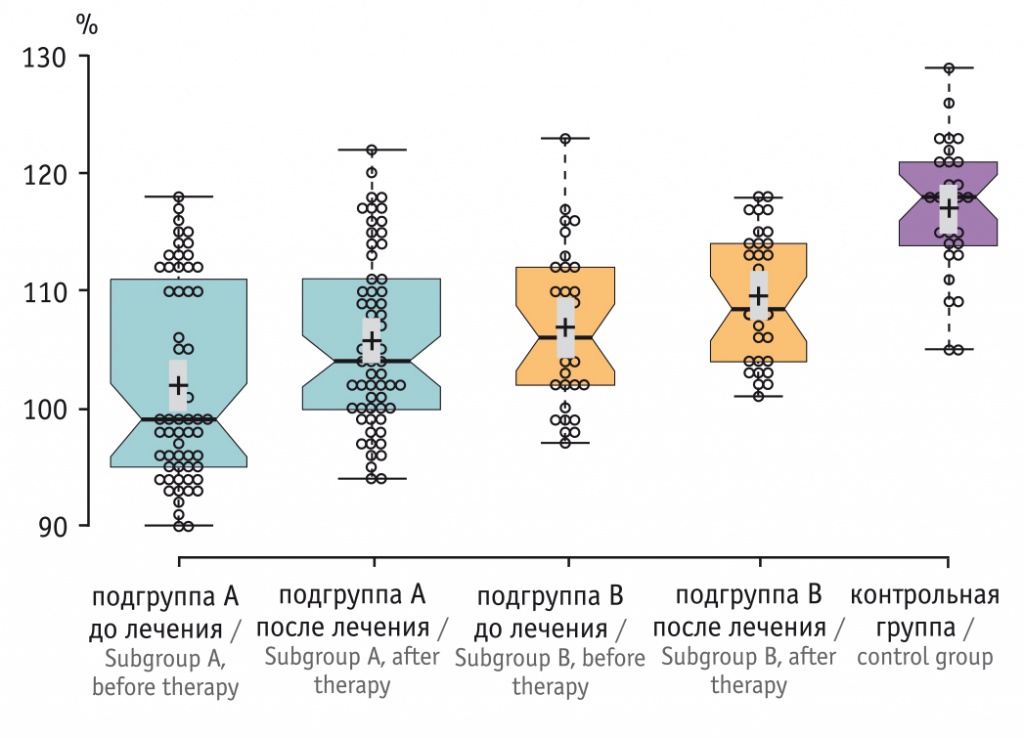
Параметры ФВД до начала лечения находились в пределах нормы у большинства участников подгрупп А и В. Однако у некоторых пациентов с частично контролируемым течением БА показатели были ниже нормы, что характеризует наличие обструктивных проявлений. Через 3 месяца терапии показатели нормализовались в обеих подгруппах, однако в подгруппе получавших ИГКС — быстрее (рис. 2).
Рис. 2. Показатели объема форсированного выдоха за 1-ю секунду у участников исследования
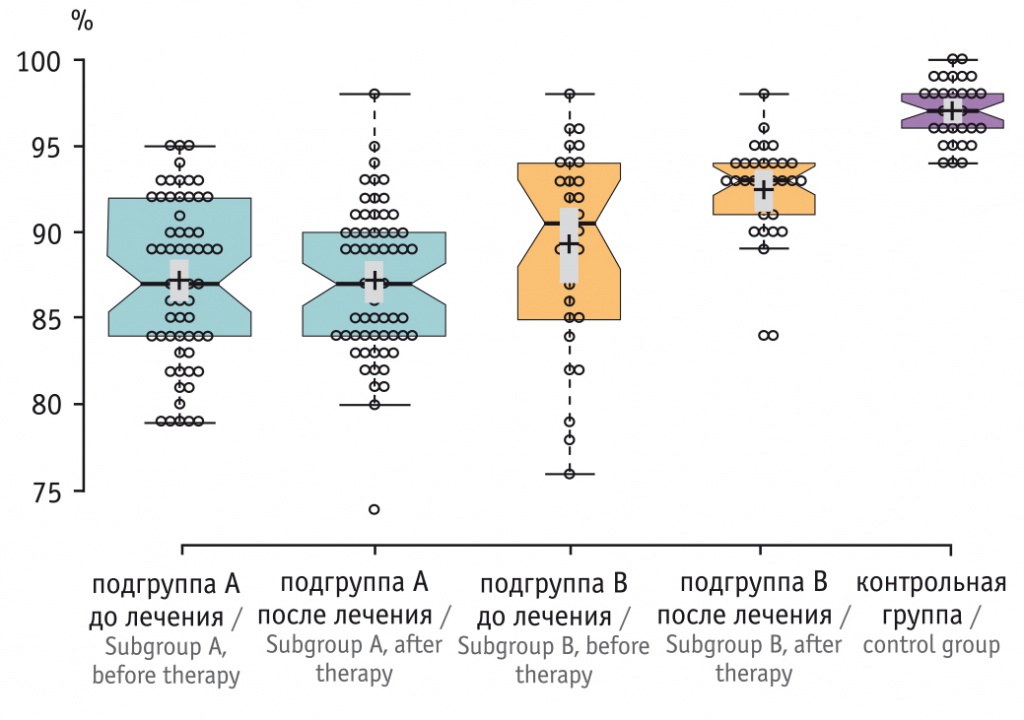
Оценка ОФВ1/ФЖЕЛ показала, что значимое улучшение показателей произошло в группе пациентов, получавших ИГКС (p < 0,05) (рис. 3).
Рис. 3. Соотношение объема форсированного выдоха за 1-ю секунду и форсированной жизненной емкости легких у участников исследования
Проведенный корреляционный анализ выявил обратную корреляционную связь между уровнем FeNO и показателями ФВД. Полученные коэффициенты корреляции — умеренно статистически значимые (наблюдаемый уровень значимости: 0,005 < p-value < 0,05).
ОБСУЖДЕНИЕ
Согласно GINA и клиническим рекомендациям по диагностике и лечению БА, основным принципом лечения БА является ступенчатый подход. У детей с легкой БА старше 5 лет регулярная терапия может начинаться с низких доз ИГКС и/или монотерапии АЛР, а с 6 лет рекомендуют лечение комбинацией ИГКС с ДДБА1 [1, 12]. Известно, что ГКС уменьшают эозинофильное воспаление, характерное для большинства фенотипов астмы. FeNO обладает потенциальными свойствами для мониторинга реакции на ингаляционное лечение ГКС у больных с БА.
Нормализация уровня FeNO отмечалась у большинства пациентов на фоне базисной терапии (подгруппы А и В) через 3 месяца и была сходной в обеих подгруппах. Однако на фоне лечения ИГКС нормализация показателя происходила быстрее.
Полученные ранее данные продемонстрировали, что более высокие исходные уровни FeNO действительно способны предсказать ответ на терапию ИГКС в виде улучшения функции легких у детей [13, 14].
Некоторые исследователи показали быстрое и устойчивое снижение содержания FeNO на фоне лечения АЛР [15], в то время как другие не смогли найти эту ассоциацию [16]. По нашим данным, уровень FeNO при легкой БА также существенно снижался при адекватной терапии.
ЗАКЛЮЧЕНИЕ
Исследование оксида азота выдыхаемого воздуха — это неинвазивный, чувствительный, современный метод оценки воспаления дыхательных путей, который улучшает диагностику и мониторинг терапии астмы у детей и является надежным предиктором чувствительности к ингаляционным ГКС.
Поступила: 12.11.2020
Принята к публикации: 23.11.2020
__________
1 Global Initiative for asthma (GINA). Global strategy for asthma management and prevention. Updated 2019. URL: http://www.ginasthma.org (дата обращения — 15.10.2020).








