Синдром Швахмана — Даймонда (СШД; Shwachman — Diamond syndrome, OMIM 260400) — редкое мультисистемное заболевание, характеризующееся преимущественно нарушением гемопоэза, экзокринной недостаточностью поджелудочной железы, задержкой физического развития и аномалиями костной системы [1-3]. Помимо вышеописанных симптомов, при СШД имеются иммунологические нарушения, поражение печени в виде повышения активности трансаминаз, повреждение эмали зубов, нейрокогнитивные расстройства и другие симптомы [4, 5]. СШД ассоциируется с высоким риском развития миелодиспластического синдрома (МДС) и злокачественных трансформаций, особенно в острый миелоидный лейкоз (ОМЛ) [6, 7].
Болезнь названа в честь врачей Гарри Швахмана (Harry Shwachman) и Луиса Даймонда (Louis Diamond), которые в 1964 г. описали сочетанную патологию недостаточности экзокринной функции поджелудочной железы с гипоплазией костного мозга у трех детей из одной семьи [1].
Распространенность СШД составляет 1 на 76 тыс. населения [8]. Заболеваемость СШД в итальянской популяции составила 1 на 168 тыс. новорожденных [9].
В регистре National Cancer Institute Inherited Bone Marrow Failure Syndromes среди 530 пациентов с недостаточностью костного мозга (анемией Фанкони, врожденным дискератозом, анемией Даймонда — Блекфена и СШД) лишь у 35 (6,6%) человек зарегистрирован СШД [10]. В Канадском регистре из 125 пациентов с недостаточностью кроветворения с СШД наблюдались 34 (27,2%) [11].
Распространенность СШД в России неизвестна. При анализе эпидемиологических показателей из 2728 больных, зарегистрированных в базе первичных иммунодефицитных состояний, в регистр включены 38 детей с СШД [12].
Около 90% пациентов с клиническими симптомами СШД имеют биаллельные патогенные варианты в высоко консервативном гене SBDS, который локализован на длинном плече 7 хромосомы (7q11) [2]. Этот ген состоит из 5 экзонов, кодирующих белок SBDS из 250 аминокислотных остатков [2]. Соседний псевдоген SBDSP на 97% гомологичен с геном SBDS, но содержит делеции и изменения нуклеотидов, которые препятствуют образованию функционального белка. Приблизительно у 75% больных СШД выявлены патогенные варианты, возникающие в результате конверсии гена с псевдогеном [2].
Наиболее частыми мутациями в гене SBDS являются с.258+2Т>C и c.183_184delTAinsCT [13-15]. Мутация 258+2T>C нарушает донорский сайт сплайсинга в интроне 2, в то время как изменение динуклеотида 183–184TA→CT приводит к стоп-кодону в рамке считывания (K62X) и, как следствие, укорочению белка SBDS. На сегодняшний день не идентифицирован ни один человек, гомозиготный по динуклеотидному варианту (183-184TA→CT), так как эта патогенная мутация ведет к полному отсутствию функционального белка SBDS и несовместима с жизнью [2]. Эти данные согласуются с результатами исследований на мышах, у которых аблация белка SBDS была для эмбрионов смертельной [16].
Помимо патогенных вариантов с.258+2Т>C и c.183_184delTAinsCT, описаны различные делеции, инсерции, миссенс-, нонсенс-варианты и точечные мутации в гене SBDS [14, 17, 18].
У 10–20% пациентов с СШД не идентифицируются мутации в гене SBDS [2, 4, 11, 18], что послужило причиной поиска других генов-кандидатов.
В настоящее время описаны патогенные варианты в генах DNAJC21 или EFL1 у пациентов с клиническим фенотипом СШД [19-21]. У 4 больных с костномозговой недостаточностью, задержкой внутриутробного роста и/или низким ростом выявлены биаллельные мутации в гене DNAJC21. У одного из этих пациентов в возрасте 12 лет развился ОМЛ (мегакариоцитарный подтип, ОМЛ-М7) [20]. В другом исследовании у 4 человек из трех неродственных семей, которым был поставлен клинический диагноз СШД, также обнаружены биаллельные мутации в гене DNAJC21 [21].
В исследовании P. Stepensky и соавт. (2017) у 6 пациентов с панцитопенией, экзокринной недостаточностью поджелудочной железы и скелетными аномалиями выявили мутации в гене EFL1: 4 пациента были гомозиготными по варианту p.R1095Q и 2 пациента — гомозиготными по варианту p.M882K в EFL1 [22].
В 2017 г. R. Carapito и соавт. описали вариант миссенс-мутации de novo в гене SRP54 у 3 различных пациентов с врожденной нейтропенией и другими клиническими проявлениями, характерными для СШД. У этих больных уровень матричной РНК SRP54 в костном мозге был в 3,6 раза ниже, чем у здоровых людей. У них также отмечались снижение количества нейтрофилов, нарушение хемотаксиса и уменьшение размеров экзокринной части поджелудочной железы. У 2 пациентов содержание эластазы кала было менее 15 мкг/г при норме более 200 мкг/г [23].
В исследовании, проведенном C. Bellanne-Chantelot и соавт. (2018), патогенные варианты в гене SRP54 выявлены у 66 пробандов из французского регистра пациентов с врожденными нейтропениями. В общей сложности идентифицированы 23 мутации (16 спорадических, 7 семейных) с 7 различными патогенными вариантами в гене SRP54. Почти у всех пациентов нейтропения была с рождения менее 0,5 × 109 г/л, носила персистирующий характер, сочеталась с нарушением созревания промиелоцитов и требовала длительной терапии высокими дозами гранулоцитарного колониестимулирующего фактора.
Нейтропения иногда ассоциировалась с патологией нервной системы (n = 7), низким ростом (n = 3) и/или экзокринной недостаточностью поджелудочной железы, при которой требовалась ферментозаместительная терапия (n = 3). На основании полученных данных авторы сделали вывод, что патогенные варианты в гене SRP54 вызывает не СШД, а СШД-подобный синдром [24].
Все вышеописанные мутации ведут к нарушению биогенеза и/или функций рибосом (рис.). Биогенез рибосом включает скоординированную экспрессию и сборку 80 рибосомных белков, 4 рибосомных РНК (рРНК) и 76 малых ядрышковых молекул РНК с помощью 200 факторов сборки и 300 snoРНК (small nucleolar ribonucleoproteins), выполняющих специфические ковалентные модификации (метилирование, ацетилирование и псевдоуридилирование) [25, 26]. Синтез рибосом начинается с транскрипции двух прерибосомальных РНК: один синтез для 5S рРНК, второй — для 18S, 5.8S и 28S рРНК. В цитоплазме синтезируются все рибосомные белки и транс-активирующие факторы, которые поступают в ядрышко и принимают участие в биогенезе рибосом. Сборка рибосом заканчивается после выхода прерибосомных частиц из ядрышка в цитоплазму [27].
Рис. Рибосомный цикл [23]
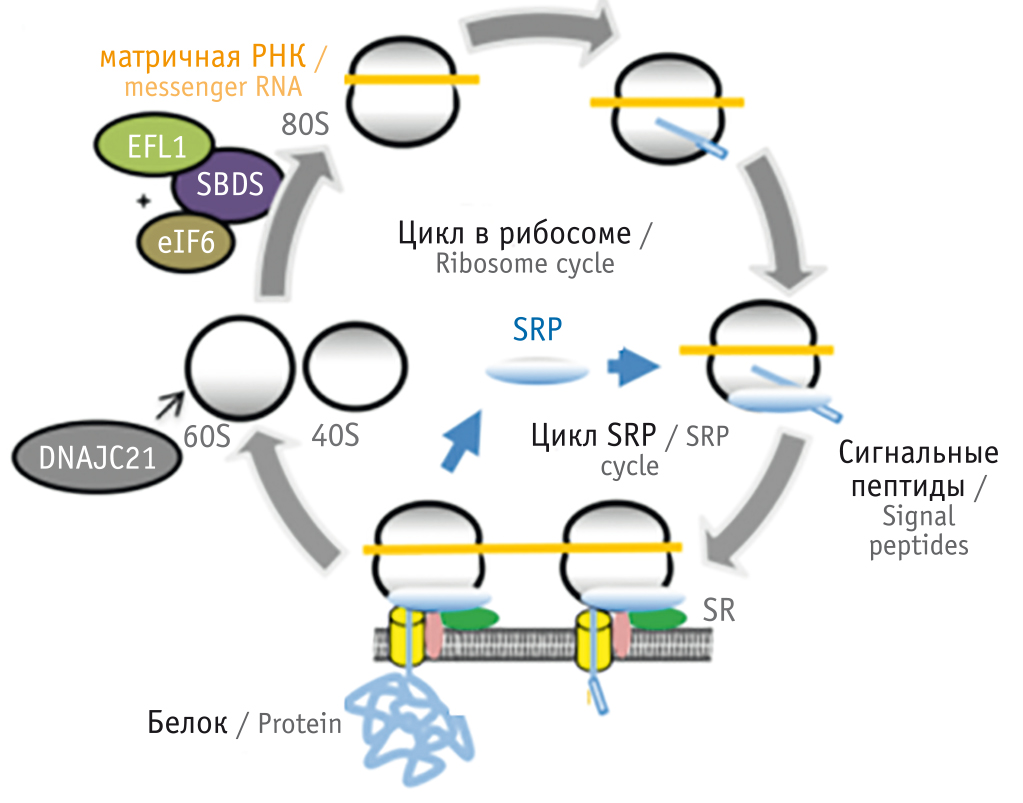
Структура рибосомы включает две субъединицы — субъединицу 40S, состоящую из цепи 18S рРНК и 33 видов рибосомальных белков (small ribosomal subunits, RPS), и субъединицу 60S, состоящую из цепи 28S, 5S и 5.8S рРНК и 47 видов рибосомальных белков (large ribosomal subunit, RPL) [27]. Вместе 40S и 60S образуют зрелую рибосому 80S.
Известно, что белок SBDS играет важную роль в биогенезе рибосом и стабильности митотического веретена [28]. В исследовании A.J. Finch и соавт. (2011) показано, что SBDS функционирует на поздней стадии цитоплазматического созревания субъединиц 60S рибосом [29]. Транс-действующим фактором, который удерживает зарождающуюся субъединицу 60S в функционально неактивном состоянии, является эукариотический фактор инициации 6 (eIF6). Белок eIF6 связывается с интерсубъединичным мостиком [30] и должен быть удален до того, как субъединица 60S сможет присоединиться к субъединице 40S для инициирования трансляции.
В исследовании A.J. Finch и соавт. также показано, что SBDS способствует высвобождению eIF6, стимулируя GTPase-активность EFL1 [29]. Локализация белка SBDS зависит от клеточного цикла, с преимущественной локализацией в ядрышке во время митоза в фазы G1 и G2 и в ядре во время S-фазы [31].
Белки DNAJC21 и EFL1 тоже участвуют в созревании 60S до начала сборки трансляции 80S рибосомы (см. рис.) [32, 33].
Таким образом, мутации в генах SBDS, DNAJC21 и EFL1 ведут к нарушению созревания 60S субъединицы, что вызывает схожие клинические проявления у различных пациентов.
Во время биогенеза и инициации трансляции белка рибосома взаимодействует со многими молекулами-партнерами, и из них наиболее важной является частица распознавания сигналов (signal recognition particle, SRP) (см. рис.). SRP — это рибонуклеопротеидный комплекс, способствующий ориентации образующихся полипептидов, несущих сигнальную последовательность на поверхность эндоплазматического ретикулума [34]. SRP млекопитающих состоит из одной молекулы РНК (длиной ~300 нуклеотидов 7SL РНК) и 6 полипептидов: SRP9, SRP14, SRP19, SRP54, SRP68 и SRP72 [35].
Как было изложено выше, SRP54 играет центральную роль в рибонуклеопротеидном комплексе, мутации в SRP54 ассоциируются с врожденной нейтропенией и СШД-подобными симптомами [23].
Благодаря своей роли в регулировании качества и количества белков в клетке, биогенез рибосом является неотъемлемой частью клеточного роста, пролиферации и дифференцировки. Нарушение транскрипции рибосомных белков приводит к остановке клеточного цикла, преждевременному старению, апоптозу или аутофагии в зависимости от типа клеток и, как следствие, к нарушению кроветворения и высокому риску онкологических заболеваний [36-38].
На сегодняшний день к наследственным заболеваниям, связанным с дефектами созревания, нарушением структуры или функции рибосом и рибонуклеопротеиновых комплексов, помимо СШД, относят анемию Даймонда — Блекфена (OMIM 105650), гипоплазию хрящей и волос (метафизарную хондродисплазию, тип Мак-Кьюсика; OMIM 250250), врожденный дискератоз (OMIM 127550 и 305000), 5q-синдром (синонимы: МДС с изолированной del(5q), МДС) и другие синдромы [39-44].
Эти синдромы имеют общие характеристики с СШД. Все заболевания связаны с костномозговой недостаточностью по меньшей мере одной линии гемопоэза. Все пять перечисленных синдромов ассоциируются с повышенным риском развития рака. Синдром гипоплазии хрящей и волос, анемия Даймонда — Блекфена и СШД имеют схожие скелетные фенотипы, которые различаются как по тяжести проявлений, так и по пенетрантности [3, 40, 45-47].
ЗАКЛЮЧЕНИЕ
Синдром Швахмана — Даймонда (СШД) — это генетически детерминированное заболевание из группы рибосомопатий. Рибосомопатии обусловлены мутациями в генах, участвующих в синтезе рибосомальных белков и факторов, которые функционируют на различных стадиях их сборки, вызывают широкий спектр клинических фенотипов, включая злокачественные гематологические заболевания и рак.
В клинической практике традиционно диагноз СШД устанавливают по характерным клиническим симптомам и при наличии патогенных мутаций в гене SBDS. Относится ли СШД к генетически гетерогенным заболеваниям из группы рибосомопатий, или мутации в других генах, приводящих к нарушению биогенеза рибосом, вызывают СШД-подобные симптомы, остается вопросом дискутабельным и требует дальнейших исследований.
Поступила: 25.09.2020
Принята к публикации: 16.10.2020








