Эозинофилы считаются основными клетками, способствующими запуску и поддержанию аллергического воспаления дыхательных путей при БА. Высвобождаемые ими биологически активные субстанции — эозинофильный катионный протеин (ЭКП), большой основной протеин — приводят к повреждению и нарушению функции реснитчатого эпителия, развитию неспецифической бронхиальной гиперреактивности и поддерживают процесс ремоделирования дыхательных путей [1, 2, 5]. Эозинофилы определяются в жидкости бронхоальвеолярного лаважа, мокроте и биопсийном материале не только во время обострения, но и в период ремиссии заболевания [1, 5–7]. В настоящее время некоторыми учеными принято выделять воспалительные фенотипы БА, в основу их разделения положен клеточный состав индуцированной мокроты (ИнМ) [5, 7].
Цель исследования: изучить в динамике особенности воспалительного фенотипа и цитоиммунологических показателей индуцированной мокроты у детей дошкольного возраста с бронхиальной астмой легкого персистирующего течения.
МАТЕРИАЛЫ И МЕТОДЫ
В двухлетнее проспективное когортное исследование включались дети, поступившие на обследование и лечение в детские аллергологическое и кардиологическое отделения Городской клинической больницы № 1 (г. Челябинск).
В группу БА входили 53 ребенка в возрасте от 1,5 года до 5 лет (средний возраст — 3,0 ± 1,3 года) с легкой персистирующей БА. Эта группа была сформирована методом случайной выборки из пациентов, которым по результатам обследования у аллерголога-иммунолога был выставлен диагноз «бронхиальная астма, легкое персистирующее течение» с назначением базисной терапии низкими дозами ингаляционных и назальных глюкокортикостероидов [1]. Пациенты с БА регулярно осматривались аллергологом с целью оценки эффективности базисной терапии и, при необходимости, ее пересмотра (step-down). Контролируемость БА оценивалась с помощью опросника TRACK, разработанного для оценки респираторных симптомов и контроля БА у детей младше 5 лет [1].
Группу сравнения составили 20 детей того же возраста без аллергических заболеваний и без эпизодов острого обструктивного бронхита в анамнезе.
На всех детей была заполнена персональная анкета, в начале исследования (перед назначением базисной терапии) и в конце исследования (во время перерыва в приеме базисной терапии) проводилось определение уровней эозинофилов общего анализа крови, общего IgЕ крови, клеточного состава назального секрета (НС) и ИнМ, иммунологических факторов ИнМ (IgG4, IgE, IL-1β, IL-4, IL-8, IL-13, TNF-α, IFN-γ, NOx — суммарное количество нитритов и нитратов).
Статистический анализ полученных результатов проводили при помощи пакетов статистических программ Statistica 6.0 (StatSoft, США, 2001). Для описания количественных признаков в выборке рассчитывали медиану и интерквартильный размах (Me [25%–75%]). Для сравнительного анализа данных при распределении количественных признаков, отличном от нормального, использовали непараметрический U-тест Манна — Уитни. Сравнительный анализ данных в двух зависимых группах при распределении количественных признаков, отличном от нормального, выполняли с применением критерия Вилкоксона (Pwilk). Для всех видов анализа статистическую значимость различий констатировали при значениях p < 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
За время наблюдения БА у детей была контролируемой, т. е. у всех пациентов по опроснику TRACK насчитывалось не менее 80 баллов. У 17 из 53 (32,1%) детей БА за время наблюдения не обострялась, у 20 (37,7%) детей было отмечено одно обострение, у 16 (30,2%) детей наблюдались 2 обострения. Обострения протекали в виде приступа БА легкой степени тяжести, не требовавшего госпитализации. В 14 из 52 (26,9%) случаев заболевание обострялось на фоне респираторной инфекции, в одном случае (1,9%) провоцирующим фактором был аллерген, в 37 (71,2%) наблюдениях обострение БА происходило на фоне респираторной инфекции и действия триггерного аллергена. Обострения возникали в период перерыва в приеме базисной терапии.
При анализе лабораторных показателей в начале исследования повышенный уровень эозинофилов крови (≥ 5%) был выявлен у 30 (56,6%) детей группы БА и 3 (15,0%) детей группы сравнения (p < 0,05). У детей с БА высокий уровень общего IgE крови (> 100 МЕ/мл) отмечался в 54,7% случаев (n = 29), высокий уровень ЭКП (> 10 нг/мл ) — в 39,6% (n = 21), высокий уровень эозинофилов НС (≥ 5%) — в 83,0% (n = 44), высокий уровень эозинофилов ИнМ (≥ 2,5%) — в 79,2% случаев (n = 42). У детей группы сравнения эти показатели были в пределах принятой нормы.
В конце исследования статистически значимых изменений лабораторных маркеров в группе БА выявлено не было. Высокий уровень эозинофилов НС сохранялся у 33 (62,3%) детей, высокий уровень эозинофилов ИнМ был отмечен у 43 (81,1%) обследованных (p > 0,05).
При анализе воспалительного фенотипа по данным ИнМ [5] в начале исследования у 60,4% детей (n = 32) был выявлен эозинофильный воспалительный фенотип, у 30,2% (n = 16) — смешанный воспалительный фенотип, у 5,7% (n = 3) — нейтрофильный воспалительный фенотип и у 3,8% детей (n = 2) — малогранулоцитарный воспалительный фенотип.
Через 2 года распределение воспалительных фенотипов статистически значимо не изменилось: частота эозинофильного фенотипа составила 60,4%, смешанного — 34,0%, нейтрофильного — 1,9%, малогранулоцитарного фенотипа — 3,8% (p > 0,05). Полученные результаты соотносятся с данными других исследователей [5–7].
В таблице 1 лабораторные показатели обследованных детей представлены в виде Me [25%–75%]. Как видно из этой таблицы, уровень эозинофилов крови (%) у детей группы БА статистически значимо (p < 0,05) превышал таковой в группе сравнения. Значения общего IgE крови и эозинофилов НС (%) у детей с БА были статистически значимо выше показателей в группе сравнения (p < 0,05) и нормы (до 100 МЕ/мл и до 5% соответственно; p < 0,05).
Таблица 1
Лабораторные показатели обследованных детей, Ме [25%–75%]
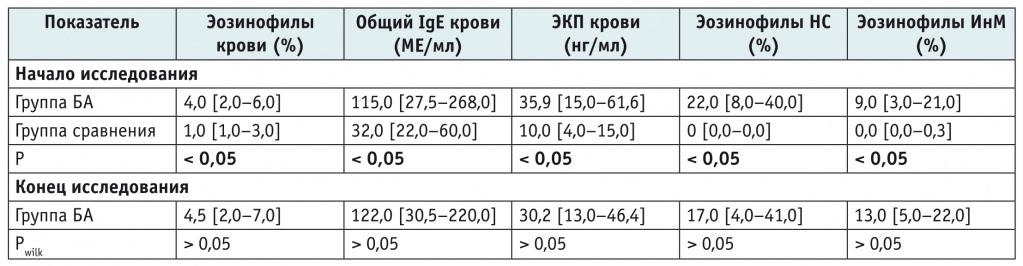
Примечание. БА — бронхиальная астма; ИнМ — индуцированная мокрота; НС — назальный секрет; ЭКП — эозинофильный катионный протеин; Ig — иммуноглобулин.
Наличие воспалительных изменений на уровне слизистой оболочки бронхов выявлялось по данным клеточного состава и иммунологических показателей ИнМ [8]. Как видно из таблицы 1, уровень эозинофилов ИнМ (%) у детей группы БА был выше показателя группы сравнения и превышал 2,5% (показатель, принятый нами за верхнюю границу нормы), в обоих случаях различия статистически значимы (p < 0,05). Это соотносится с данными других исследователей [9–11].
Следующим этапом работы было определение иммунологических показателей ИнМ в динамике. У детей первых пяти лет жизни происходит поэтапное становление клеточного и гуморального звеньев иммунитета, продолжаются рост и дифференцировка органов респираторной системы, ввиду чего на эту возрастную группу нельзя транспонировать результаты, полученные у старших пациентов. Именно незрелость иммунной системы и анатомо-физиологические особенности респираторного тракта определяют течение БА у детей дошкольного возраста. Поэтому представлялось актуальным исследование иммунологических факторов мокроты у детей с БА и их ровесников из группы сравнения (табл. 2).
Таблица 2
Иммунологические показатели индуцированной мокроты обследованных детей, Ме [25%–75%]
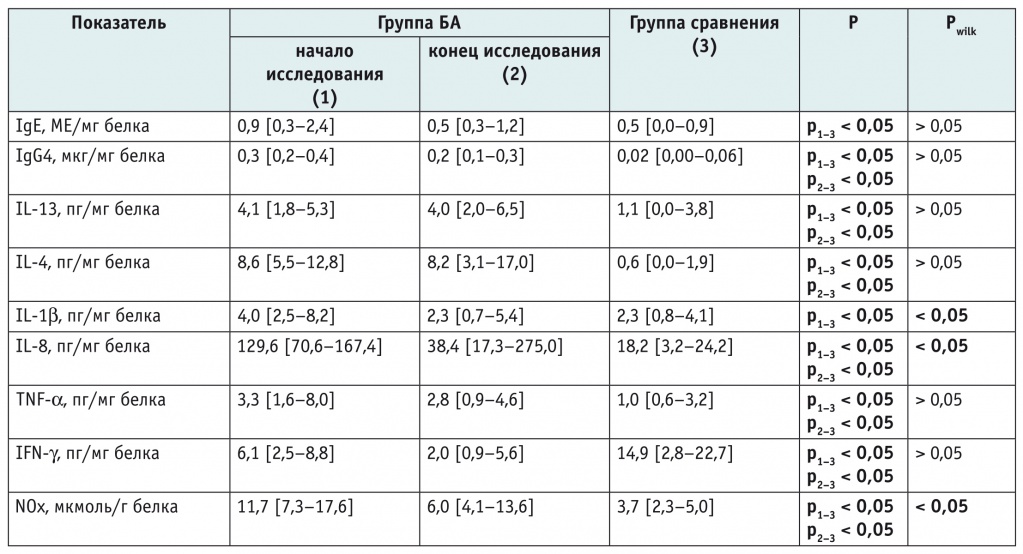
Примечание. IFN — интерферон; Ig — иммуноглобулин; IL — интерлейкин; NOx — суммарное количество нитрнитов и нитратов; TNF — фактор некроза опухоли.
В начале исследования уровень IgE ИнМ у детей с БА был в 1,8 раза выше, чем в группе сравнения, к концу исследования эта разница нивелировалась. Повышение содержания IgE в крови считается маркером атопии, многие ученые рассматривают его в качестве биологического маркера БА [6, 12–14].
Уровень IgG4 ИнМ у детей группы БА был стабильно высоким: в начале и в конце исследования он превышал таковой в группе сравнения в 15 и 10 раз соответственно. Подкласс IgG4, в отличие от IgE, не является реагином, но он может участвовать в аллергическом ответе, многими исследователями выявлено повышение этого показателя в мокроте у больных БА [6, 13, 15].
Значение IL-13 ИнМ у детей с БА превышало таковое у детей группы сравнения в начале и в конце исследования в 3,7 и 3,6 раза соответственно. IL-13 переключает иммунокомпетентные клетки на продукцию IgE, IgG4, может дублировать функции IL-4 в его отсутствие, инициирует гиперреактивность дыхательных путей и является хемоаттрактантом для эозинофилов. Стабильное повышение этого фактора в мокроте логично и подтверждает наличие хронического аллергического воспаления в дыхательных путях у пациентов с БА [10, 13, 16–18].
Уровень IL-4 ИнМ у детей группы БА превышал таковой у детей группы сравнения как в начале (в 14,3 раза), так и в конце исследования (в 13,7 раза). Следует отметить, что IL-4 является ростковым фактором B-клеток и переключает продукцию IgM на IgE, IgG4 [13, 17–20].
Показатель IL-1β ИнМ у детей с БА в начале исследования был в 1,7 раза выше, чем в группе сравнения, но через 2 года данные сравнялись. IL-1β синтезируется в основном макрофагами в ответ на различные иммунные стимулы, он вызывает активацию эндотелиальных клеток, рекрутирование и поддержание жизнедеятельности эозинофилов. Исследования по изучению полиморфизма гена IL-1β продолжаются [21–23].
Уровень IL-8 ИнМ у детей с БА в начале исследования был в 7,1 раза выше, чем в группе сравнения, к концу исследования отмечалось его снижение, но уровень группы сравнения достигнут не был. Участие IL-8 в развитии аллергического и других видов воспаления несомненно. Основными клетками-продуцентами IL-8 являются активированные моноциты, макрофаги и клетки эндотелия. IL-8 привлекает в очаг воспаления иммунокомпетентные клетки, активирует эозинофилы и базофилы, подавляет синтез IgE и инактивирует противовирусную активность IFN-γ. Повышенные уровни этого цитокина в мокроте у больных БА отмечены в работах российских и зарубежных исследователей [3, 6, 8, 24].
Значения TNF-α ИнМ у детей группы БА были стабильно высокими, они превышали показатель у детей группы сравнения в начале и в конце исследования в 3,3 и 2,8 раза соответственно. По данным отечественных и иностранных ученых, у больных БА отмечается повышение уровня TNF-α в мокроте [6, 23, 25].
Показатель IFN-γ ИнМ у детей группы БА был значительно снижен относительно такового в группе сравнения как в начале, так и в конце исследования. Выявленная особенность не противоречит данным других исследователей, которые указывают на то, что у детей с атопией уровни IFN-γ крови ниже, чем у других детей [26–29].
Концентрация NOx (общий NO) в ИнМ у детей с БА в 3,2 и 1,6 раза превышала показатель группы сравнения в начале и в конце исследования соответственно. Была отмечена тенденция к снижению NOx в динамике у детей с БА к концу исследования. Высокий уровень NO в выдыхаемом воздухе определяется у детей с обострением БА, поэтому некоторые ученые относят его к маркерам БА [8, 30].
Выводы
У детей с БА как в начале, так и в конце исследования отмечалась высокая распространенность повышенных уровней эозинофилов НС (83% и 62% соответственно) и эозинофилов ИнМ (79% и 81% соответственно), несмотря на то, что дети курсами получали контролирующую терапию низкими дозами ингаляционных и назальных глюкокортикостероидов. Контролирующая терапия считалась достаточной, так как за два года наблюдения у 32% детей БА не обострялась, у 38% детей было одно обострение и у 30% детей — 2 обострения в виде приступа легкой степени тяжести, не требовавшего госпитализации.
При анализе воспалительного фенотипа по данным ИнМ было выявлено, что у детей с БА как в начале, так и в конце исследования преобладает и одинаково часто встречается эозинофильный воспалительный фенотип — его частота составила 60%. Распространенность смешанного воспалительного фенотипа к концу исследования тоже статистически значимо не изменилась, увеличившись с 30% до 34%.
При изучении иммунологических показателей ИнМ как в начале, так и в конце исследования обнаружены высокие уровни цитокинов IgG4, IL-4, IL-8, IL-13, TNF-α, NOx относительно данных в группе сравнения. Значения IL-8, IL-1β и NOx ИнМ у детей с БА статистически значимо снизились к концу исследования, что отчасти может быть объяснено модулирующим влиянием контролирующей терапии на хроническое аллергическое воспаление, в частности на секрецию клетками этих цитокинов [21, 22].
ЗАКЛЮЧЕНИЕ
Выявленные изменения в клеточном составе и иммунологических показателях индуцированной мокроты свидетельствуют о том, что у детей дошкольного возраста с бронхиальной астмой (БА) наблюдается персистенция воспаления на уровне слизистой оболочки бронхиального дерева, которая сохраняется в период ремиссии легкой БА. Это подчеркивает необходимость проведения контролирующей терапии детям с легкой БА.








