Установлено, что проявления патологического процесса выходят за рамки респираторного тракта и могут быть зафиксированы в различных системах организма [5]. У значительной части детей раннего возраста самым ранним и частым проявлением атопии (80–85% всех случаев) является атопический дерматит (АтД) [6]. АтД — первое проявление «атопического марша» и значимый фактор риска развития БА у детей, что связано с системным иммунным ответом [7].
Роль респираторной инфекции в патогенезе БА как фактора, определяющего фенотипическую реализацию заболевания и затем — его течение, а порой и исходы, многогранна, и это обусловливает актуальность изучения роли инфекционного агента при БА у детей. Имеются данные, что некоторые инфекционные патогены (вирусы, хламидии, микоплазмы) могут активно влиять на иммунный ответ ребенка, способствуя вторичному инфицированию дыхательных путей, повышению бронхиальной гиперреактивности и развитию бронхоспазма [8–10]. Кроме того, больные с атопической формой БА генетически предрасположены к персистирующему течению некоторых вирусных и атипичных (внутриклеточных) инфекций [11].
Установлено, что очаги хронической инфекции способствуют развитию бактериальной сенсибилизации организма, усугубляя течение заболевания у детей с атопией [12]. Повторные заболевания органов дыхания и обострение очагов хронической инфекции снижают барьерную функцию слизистых оболочек респираторного тракта и облегчают процесс сенсибилизации многими неинфекционными аллергенами, чем обусловливается поливалентность аллергии [13]. По данным ряда авторов, в период от 1 года до 5 лет после санации очагов инфекции снижается уровень бактериальной сенсибилизации (в динамике достигался отрицательный результат или уменьшалась интенсивность кожных проб) и урежаются обострения очагов хронического воспаления и БА. Однако при атопической БА лечебный эффект от санации очагов хронической инфекции бывает неполным [13].
Микрофлора полости рта разнообразна и имеет как аутохтонную (резидентную, постоянную), так и аллохтонную (транзиторную, временную) составляющую. Спектр микрофлоры включает стафилококки, стрептококки, вейлонеллы, нейссерии, а также палочковидные формы бактерий, обитающие в полости рта (лактобациллы, коринебактерии и др.) [14].
Ряд патогенных стафилококков синтезируют и секретируют высокоактивные экзотоксины и ферменты, которые могут способствовать развитию заболеваний, в том числе аллергических [15].
Доказано, что этиологическое значение в развитии такого хронического очага инфекции, как кариес, имеет Streptococcus mutans [16]. У детей 9–12 лет, страдающих БА, распространенность кариозного процесса наиболее выражена при тяжелой степени заболевания [17]. Тяжесть кариеса зубов и заболеваний пародонта находится в прямой зависимости от степени тяжести БА и АтД [18–21]. Исследования показали, что распространенность кариеса у детей и подростков с аллергической патологией достигает 90–100% [22, 23].
Установлено, что распространенность кариеса зубов среди детей, больных АтД, составляет 87,5%, а среди детей, страдающих сочетанной аллергической патологией, этот показатель равен 92,0%. Для сравнения, у здоровых детей кариес постоянных зубов встречался в 76,0% случаев [17].
В свою очередь, наличие одонтогенных очагов инфекции может вызывать дополнительную сенсибилизацию организма [22], что обусловливает необходимость тщательной санации полости рта и своевременной профилактики стоматологических заболеваний у детей.
Цель исследования: изучить микробиологический состав зубного налета у детей с бронхиальной астмой и атопическим дерматитом.
МАТЕРИАЛЫ И МЕТОДЫ
Открытое проспективное клиническое исследование проводилось на базе Оренбургского государственного медицинского университета и Оренбургской областной клинической больницы № 2 (детского пульмонологического и детского аллергологического отделений) в период с 2015 по 2016 г.
Обследовано 66 детей в возрасте от 3 до 15 лет, отобранных методом случайной выборки. В первую группу были включены дети с БА (n = 22), во вторую — дети с АтД (n = 22), в третью группу (или группу сравнения) — дети без аллергических заболеваний (n = 22).
Критерии включения в исследование: добровольное информированное согласие родителей ребенка на участие в клиническом исследовании; возраст детей от 3 до 15 лет; дети с БА и АтД различной степени тяжести и условно здоровые дети без аллергических заболеваний.
Критерии исключения: отказ родителей от участия в клиническом исследовании; наличие у детей острой соматической патологии в стадии декомпенсации; осложненное течение БА и АтД.
Состояние пациентов изучали с применением разработанной нами специальной анкеты, включавшей оценку генеалогического, аллергологического анамнеза и характера вскармливания на первом году жизни. Всем детям выполняли клиническое и лабораторно-инструментальное обследование (общий анализ крови, биохимический анализ крови, общий анализ мочи, ЭКГ, копрологическое исследование, рентгенография органов грудной клетки), ИФА с определением уровней общего IgE и типоспецифических IgE в сыворотке крови. По показаниям проводили спирометрию, консультации дерматолога. Степень тяжести АтД была оценена с помощью шкалы SCORAD (англ. Scoring Atopic Dermatitis). Диагноз БА выставлен согласно протоколу GINA (англ. Global Initiative for Asthma) [24].
Стоматологическое обследование проводилось детским врачом-стоматологом. Определялись показатели распространенности (%) и интенсивности кариеса зубов по индексу КПУ (К — кариозный зуб; П — пломбированный зуб; У — зуб, удаленный в результате развития кариеса), а также уровень гигиены полости рта с использованием гигиенического индекса Федорова — Володкиной и степень тяжести гингивита по индексу PMA (папиллярно-маргинально-альвеолярный индекс) [25].
Для определения степени обсемененности зубного налета и идентификации возбудителей применяли бактериологический метод. Материала для посева с контактной поверхности зубов забирали натощак до чистки зубов. Посев проводили на питательные среды: желточно-солевой агар, кровяной агар, среду Эндо, сахарный бульон, кандиселект. В дальнейшем была выполнена видовая идентификация колоний с использованием диагностических наборов «СТАФИтест-16», «СТРЕПТОтест-16», «ЭН-КОККУСтест» (ПЛИВА-Лахема, Чехия). Результаты учитывали с помощью бактериологического анализатора Multiskan-Ascent (THERMO-Labsystems, Финляндия) и компьютерной программы «Микроб-автомат», автоматически считывающей коммерческие идентификационные тест-системы. Идентификация вида микроорганизма осуществлялась фенотипически. Критерием бактериальной обсемененности являлось наличие роста условно-патогенной флоры в титре ≥ 105 КОЕ/мл.
Для статистической обработки данных опеделяли среднюю арифметическую величину (М) и ошибку средней арифметической (m). С целью выявления статистически значимых различий в сравниваемых группах применяли непараметрический U-критерий Манна — Уитни [19]. Распределение качественных признаков в группах оценивали с помощью частотного анализа, межгрупповые различия при сравнении частот выявляли по угловому критерию Фишера и критерию «хи-квадрат» Пирсона (χ2). Вероятность ошибки первого рода (α) равнялась 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Аллергоанамнез по атопии у детей первой группы был отягощен в 81,8% случаев (n = 18), при этом наследственная отягощенность по линии родителей составила 72,7% (n = 16), по линии остальных родственников — 27,3% (n = 6).
Характеристика детей с БА и АтД представлена в таблице 1. Как следует из таблицы, в первой группе пищевая сенсибилизация встречалась статистически значимо чаще, чем пыльцевая: 36,4% (n = 8) против 27,3% (n = 6) (p < 0,05).
Таблица 1
Характеристика групп исследования, n (%)
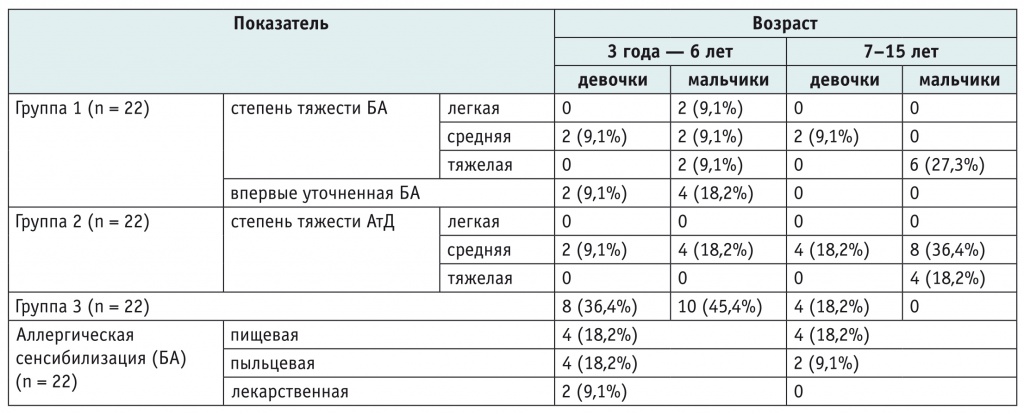
Примечания.
1. АтД — атопический дерматит; БА — бронхиальная астма.
2. В таблицах 1–4: группа 1 — дети с бронхиальной астмой; группа 2 — дети с атопическим дерматитом; группа 3 — дети без аллергических заболеваний.
По анамнестическим данным, в первой группе гестоз встречался в 22,7% случаев (n = 5), угроза прерывания беременности — в 13,6% (n = 3). У детей с БА имела место атопическая форма заболевания, преобладала тяжелая астма, которая отмечалась в 36,4% случаев (n = 8), в основном у мальчиков в возрасте 7–15 лет (n = 6) (см. табл. 1).
Во второй группе как детская, так и подростковая форма АтД встречалась с частотой 50,0% (n = 11), средняя степень тяжести заболевания (SCORAD 20–40) преобладала над тяжелой (SCORAD > 40): 81,8% случаев (n = 18) и 18,2% (n = 4) соответственно (см. табл. 1). У 36,4% детей (n = 8) АтД обострялся в весенне-летний период. У 77,3% больных (n = 17) отмечался ранний перевод на искусственное вскармливание.
Результаты клинического обследования показали, что у детей первой и второй групп имеются сопутствующие заболевания (табл. 2). Как видно из таблицы, у пациентов с БА в сравнении с группой детей с АтД статистически значимо чаще выявлялись круглогодичный аллергический ринит (р < 0,001), аденоидные разрастания носоглотки (p < 0,01) и персистирующая инфекция верхних дыхательных путей (р < 0,05), а в группе детей с АтД статистически значимо чаще, чем у больных БА, устанавливались ультразвуковые признаки реактивных изменений поджелудочной железы (р < 0,001), аномалии формы желчного пузыря (p < 0,01) и электрокардиографические изменения, соответствовавшие дисфункции синусового узла (р < 0,05).
Таблица 2
Структура сопутствующей патологии у детей с бронхиальной астмой и атопическим дерматитом
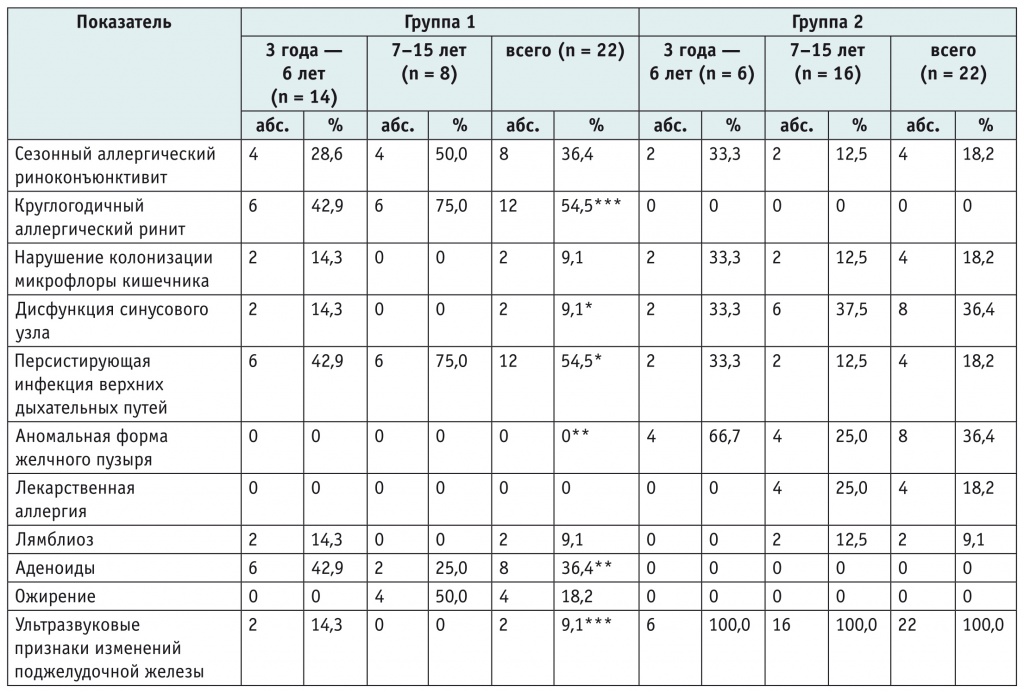
Примечание: знаком (*) отмечены статистически значимые различия со второй группой: (*) — p < 0,05; (**) — p < 0,01; (***) — p < 0,001.
В ходе аллергологического обследования у детей первой и второй групп установлен высокий уровень общего IgE: средняя величина этого показателя в первой группе составила 437,1 ± 12,7 МЕ/мл, во второй — 185,5 ± 8,4 МЕ/мл (p < 0,001). У детей без аллергических заболеваний данный показатель был статистически значимо ниже, чем в двух основных группах, — 42,75 ± 4,5 МЕ/мл (p < 0,001).
В стоматологическом статусе детей с аллергопатологией выявлена высокая распространенность кариозного процесса, статистически значимо превосходившая таковую у детей без аллергических заболеваний (табл. 3). Средние показатели интенсивности кариеса зубов в группах БА и АтД также были статистически значимо выше, чем в группе сравнения: 2,6 + 0,79 и 2,4 + 0,82 соответственно против 0,9 + 0,21 (в обоих случаях p < 0,001).
Таблица 3
Структура зубочелюстной патологии у наблюдаемых детей
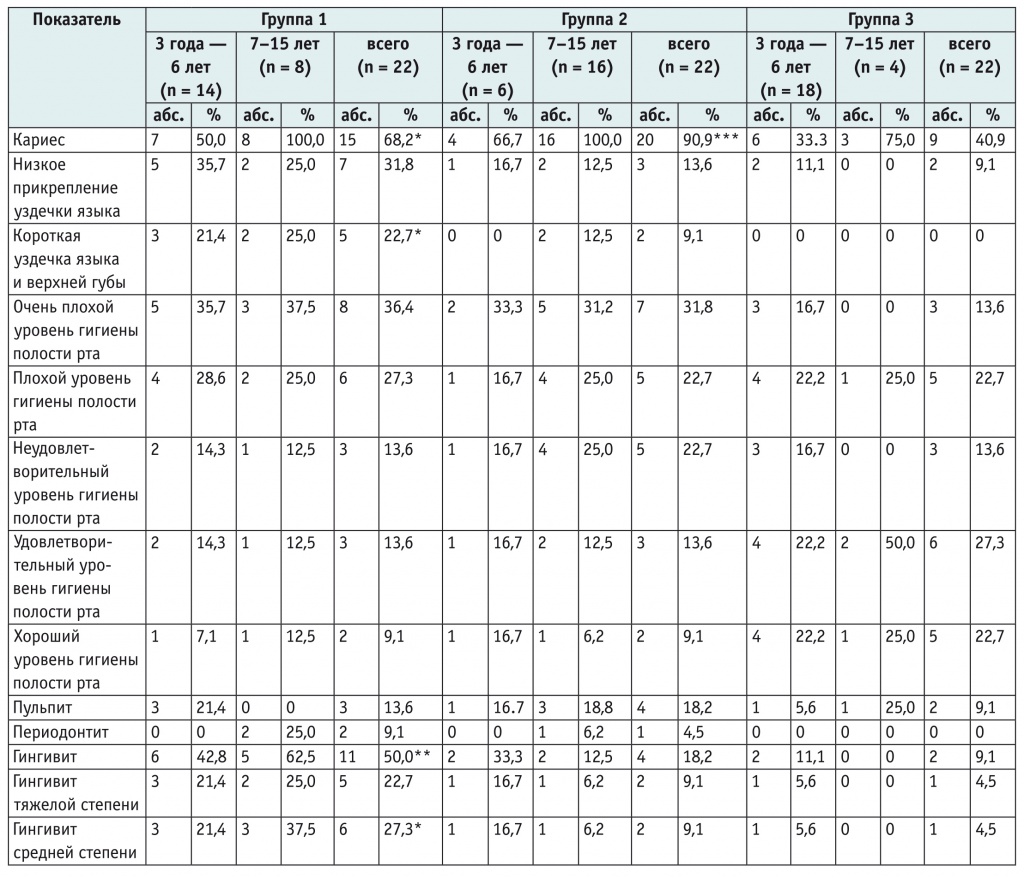
Примечание: знаком (*) отмечены статистически значимые различия с третьей группой: (*) — p < 0,05; (**) — p < 0,01; (***) — p < 0,001.
Распространенность и интенсивность кариозного процесса во всех группах нарастали с возрастом. В сравнении с детьми 3–6 лет у детей 7–15 лет распространенность кариеса зубов в группах БА и АтД выросла в 2,0 и 1,5 раза соответственно и достигла 100%, в третьей группе — в 2,2 раза и составила 75,0% (см. табл. 3). Интенсивность кариеса у пациентов с БА увеличилась с 1,3 ± 0,31 до 4,8 ± 1,72; с АтД — с 1,5 ± 0,34 до 4,1 ± 1,05; у детей без аллергических заболеваний — с 0,3 ± 0,04 до 2,6 ± 0,58.
В структуре зубочелюстных аномалий статистически значимо чаще, чем в группе сравнения, встречалась только короткая уздечка языка и верхней губы у детей с БА (p < 0,05) (см. табл. 3).
При оценке гигиенического состояния полости рта обнаружено, что у детей с БА и АтД уровень гигиены был значительно хуже, чем у детей без аллергопатологии (см. табл. 3).
Проведенный анализ показал, что в группе БА изменения в состоянии тканей пародонта были более выраженными и характеризовались присоединением воспалительных процессов слизистой оболочки полости рта. Среди воспалительных заболеваний ротовой полости у детей с БА статистически значимо выше, чем в группе сравнения, была распространенность гингивита (p < 0,01) и чаще встречался гингивит средней степени тяжести (p < 0,05); статистически значимых различий по другим воспалительным заболеваниям выявлено не было (см. табл. 3).
В ходе бактериологического анализа микрофлоры слизистой оболочки полости рта выявлена высокая плотность КОЕ стафилококков и стрептококков в посевах у детей с БА и АтД. Высокая плотность КОЕ стрептококков и стафилококков в биоматериале, взятом с поверхностей зубов и слизистой оболочки десны, сохранялась до разведения 10–5.
Как показано в таблице 4, в микрофлоре полости рта обследованных детей доминировали стрептококки. В первой группе статистически значимо чаще, чем в группе сравнения, высевался Streptococcus mutans (p < 0,05). У пациентов с БА и АтД в одинаковом проценте случаев высевался Staphylococcus aureus (27,3%), который несколько реже встречался у детей третьей группы. Во всех трех группах с разной частотой обнаруживался S. agalactiае. Стоит отметить, что S. pyogenes и S. dysgalactiae встречались только у детей с АтД.
Таблица 4
Видовой состав микроорганизмов полости рта у наблюдаемых детей
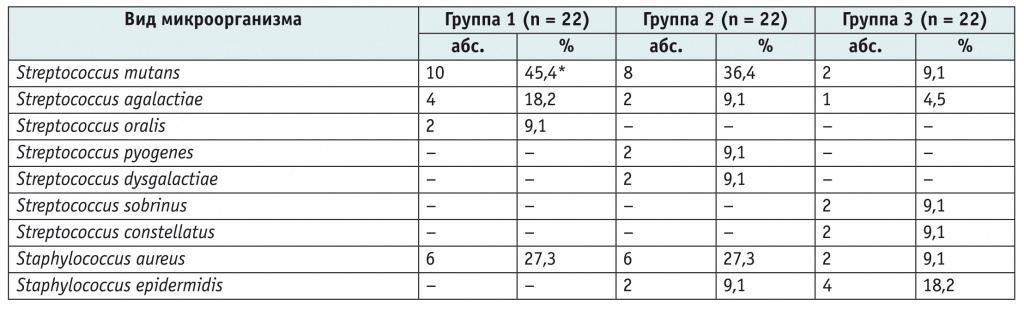
Примечание: знаком (*) отмечено статистически значимое различие с третьей группой: p < 0,05.
Полученные результаты свидетельствуют о значимости обсемененности кариесогенной микрофлорой (S. mutans) у пациентов с БА для появления кариеса, особенно в младшей возрастной группе, для которой характерна манифестация БА.
ЗАКЛЮЧЕНИЕ
В результате проведенного исследования установлено, что видовой состав микрофлоры полости рта у обследованных детей представлен S. mutans, S. agalactiае, S. oralis, S. pyogenes, S. dysgalactiae, S. sobrinus, S. constellatus, S. aureus, S. epidermidis с преобладанием кариесогенной флоры у больных бронхиальной астмой (S. mutans). Кариес у пациентов с аллергопатологией выявлялся статистически значимо чаще, чем у детей без аллергических заболеваний. Как при бронхиальной астме, так и при атопическом дерматите с увеличением возраста детей нарастали распространенность кариеса и его интенсивность.
Полученные данные обосновывают необходимость своевременной диагностики и последующей санации хронических очагов инфекции (кариес, патология периодонта) у детей с бронхиальной астмой и атопическим дерматитом. Этим детям с профилактической целью рекомендуется с трехлетнего возраста ежегодно проходить осмотр у стоматолога.








