Премедикация с использованием высокоселективного центрального агониста α2адренорецепторов дексмедетомидина имеет ряд особенностей, благоприятно влияющих на течение периоперационного периода [5, 6]. В частности, дексмедетомидин обладает выраженным седативным эффектом, в связи с чем развивающееся под его действием состояние напоминает естественный сон [4, 7, 8], но при этом сохраняется реакция на речевую стимуляцию и, таким образом, пациент остается доступным для контакта с медицинским персоналом [9, 10].
Важным аспектом безопасности дексмедетомидина является отсутствие угнетения дыхания при его применении в терапевтических дозах [11]. Показано, что в случае использования в терапевтических дозах препарат вызывает снижение показателей периферической гемодинамики, в частности АД и ЧСС, что обусловлено его симпатолитическим эффектом [12–14]. Нами сделано предположение, что применение дексмедетомидина в премедикации не приведет к удлинению времени пробуждения пациента после окончания хирургического вмешательства и общей анестезии благодаря короткому периоду полувыведения препарата (около 2–3 часов [11, 12, 15]).
Целью исследования явились изучение эффективности премедикации с включением в ее протокол дексмедетомидина при плановых лапароскопических операциях и оценка его клинической эффективности.
МАТЕРИАЛЫ И МЕТОДЫ
Работа одобрена локальным этическим комитетом ФГБОУ ВО «Астраханский государственный медицинский университет» Минздрава России.
Исследование проведено с участием 70 пациентов. Все больные находились в хирургическом отделении клиники ЧУЗ «Медикосанитарная часть» (г. Астрахань) с диагнозом «желчнокаменная болезнь; хронический калькулезный холецистит в фазе ремиссии» и в плановом порядке были подвергнуты эндоскопической холецистэктомии. Возраст пациентов составлял от 34 до 50 лет, средний показатель массы тела — 76 ± 6 кг, у больных определялась I–II степень операционноанестезиологического риска по классификации Московского научного общества анестезиологовреаниматологов (1988). Хирургические вмешательства выполнялись одной и той же бригадой квалифицированных хирургов, чем обеспечивался равный уровень травматичности операций.
Подготовка к оперативному вмешательству осуществлялась по общепринятой схеме. Больные были рандомизированы на две группы: первую (основную) и вторую (контрольную). В первую группу вошли 32 пациента, которые с целью премедикации получали раствор дексмедетомидина в концентрации 4,0 мкг/мл в дозе 1,0 мкг/кг/ч путем внутривенной инфузии в течение 1 часа до индукции анестезии. Во вторую группу вошли 38 пациентов, которым с целью премедикации вводили 10 мг диазепама внутримышечно за 30 минут до индукции анестезии.
Эффективность седации после премедикации оценивали по шкале седации Ramsay и Ричмондской шкале возбужденияседации (англ. Richmond AgitationSedation Scale — RASS).
Перед индукцией анестезии пациентам внутривенно вводили 0,01 мг/кг атропина. Индукцию анестезии осуществляли дробным введением 1%го раствора пропофола в дозе 1,5–2,5 мг/кг. Для проведения эндотрахеальной интубации применяли стандартную дозу рокурония бромида, что составляет 0,6 мг/кг; через 80–90 секунд создавались адекватные условия для интубации трахеи. Анестезия поддерживалась севофлураном на фоне внутривенной инфузии 0,005%го раствора фентанила со скоростью 0,4 мг/ч. Поддерживающие дозы рокурония бромида (0,15 мг/кг) вводили в тот момент, когда амплитуда мышечных сокращений восстанавливалась до 25% от контрольного уровня или когда появлялись 2–3 ответа при мониторинге в режиме четырехразрядной стимуляции (TOF). ИВЛ проводили аппаратом Dräger Fabius Plus (Германия).
У пациентов обеих групп в периоперационном периоде выполняли клиниколабораторный мониторинг. Рассчитывалась динамика гемодинамических инцидентов по данным, полученным в ходе регистрации показателей периферической гемодинамики (систолического (САД) и диастолического (ДАД) артериального давления, ЧСС), частоты дыхания, сатурации (SpO2) (Infinity Gamma XL, Германия), уровней глюкозы (анализатор глюкозы «Энзискан Ультра», Россия) и кортизола в сыворотке крови (методом ИФА на аппарате BioTek ELx800 производства BioTek Instruments, Inc., США), газов артериальной крови и кислотноосновного состояния (КОС; ABL800 Radiometer, Голландия). Мониторинг проводили на следующих этапах: I — перед премедикацией; II — после премедикации; III — во время индукции анестезии и интубации трахеи; IV — на травматичном этапе операции; V — в конце операции; VI — через 10 минут после завершения оперативного вмешательства.
Учитывали такой важный критерий оценки качества общей анестезии, как сроки посленаркозной реабилитации. Под последней понимаются полное восстановление сознания, способности пациента правильно оценивать обстановку, ориентироваться в пространстве и времени, быстро реагировать на вопросы и давать адекватные ответы, а также восстановление адекватного самостоятельного дыхания, стабильной гемодинамики, мышечного тонуса.
Статистическую обработку проводили с помощью программы Exсel 2010. Для статистической оценки полученных результатов применяли tкритерий Стьюдента. Различия показателей считали статистически значимыми при p ˂ 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
У всех 32 пациентов первой группы был достигнут уровень седации, соответствовавший 3 баллам по шкале седации Ramsay и −3 баллам по RASS. Во второй группе у 32 пациентов уровень седации соответствовал также 3 баллам по шкале седации Ramsay и −3 баллам по RASS, а у 6 пациентов — 4 баллам по шкале седации Ramsay и −4 баллам по RASS.
Динамика основных показателей клиниколабораторного мониторинга в периоперационном периоде на этапах исследования у пациентов первой и второй групп представлена в таблицах 1 и 2.
Таблица 1
Динамика основных показателей состояния пациентов первой группы на этапах анестезии и операции
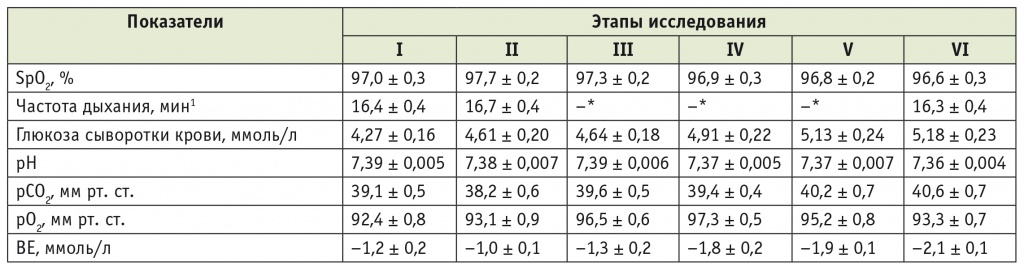
* Частота дыхания во время ИВЛ задается врачом, поэтому цифры не приводятся.
Примечания.
1. В таблицах 1, 2: I этап — перед премедикацией; II — после премедикации; III — во время индукции анестезии и интубации трахеи; IV — на травматичном этапе операции; V — в конце операции; VI этап — через 10 минут после завершения оперативного вмешательства.
2. В таблицах 1, 2: ВЕ (англ. base excess) — смещение буферных оснований; рСО2 — парциальное давление углекислого газа в крови; рО2 — парциальное давление кислорода в крови; SpO2 — насыщение гемоглобина крови кислородом.
Таблица 2
Динамика основных показателей состояния пациентов второй группы на этапах анестезии и операции
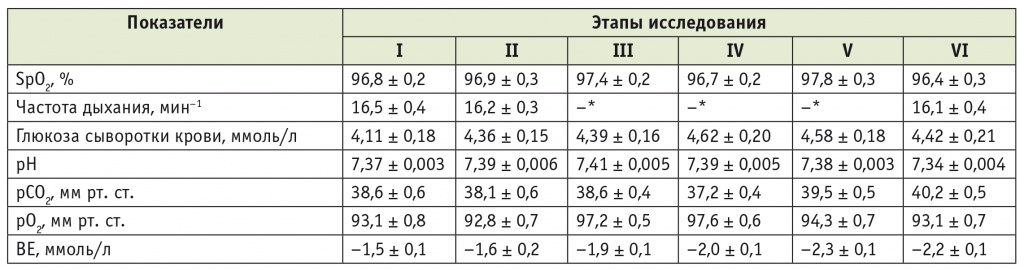
* Частота дыхания во время ИВЛ задается врачом, поэтому цифры не приводятся.
При поступлении в операционную все пациенты находились в удовлетворительном состоянии, имели нормальные показатели АД, ЧСС, КОС, газов артериальной крови и не обнаруживали признаков эмоционального беспокойства.
Начальный этап индукции был общим для обеих групп. Индукционные дозы препаратов в большинстве случаев вызывали постепенное, спокойное засыпание пациентов без неприятных ощущений и эмоционального дискомфорта. Хирургическое вмешательство протекало гладко, у хирургов не возникало какихлибо технических трудностей. Стабильные показатели периферической гемодинамики, газов артериальной крови и КОС свидетельствовали о достаточных уровнях анестезии и анальгезии.
Состояние легочной вентиляции и газообмена при проведении общей анестезии в группах оставалось адекватным. Непрерывный мониторный контроль SpO2 и газов артериальной крови позволял в режиме реального времени объективно оценивать и предупреждать какиелибо нарушения механики дыхания и оксигенации крови в периоперационном периоде (см. табл. 1, 2).
При исследовании уровней КОС и газов артериальной крови, выполненном у пациентов обеих групп, установлено, что перед началом анестезии у большинства из них эти показатели соответствовали норме. Во время анестезии и операции ни у одного из больных не возникало расстройств газообмена, связанных с нарушением легочной вентиляции.
Показатели кровообращения имели следующую динамику. У пациентов первой группы после проведения премедикации отмечалось снижение САД и ЧСС по сравнению с I этапом (р < 0,05), что было связано с симпатолитическим действием дексмедетомидина; во время индукции анестезии и интубации трахеи происходил рост этих показателей (р < 0,05) с их последующей стабилизацией на травматичном этапе операции (IV этап) и в конце оперативного вмешательства. У пациентов второй группы отмечалось достоверное повышение САД и ЧСС на этапе индукции анестезии и интубации трахеи по сравнению с исходным фоном (р < 0,05), на IV этапе САД достоверно снижалось (р < 0,05) и в последующем оставалось стабильным (рис. 1, 2).
Рис. 1. Показатели периферической гемодинамики пациентов первой и второй групп после премедикации.
* P < 0,05
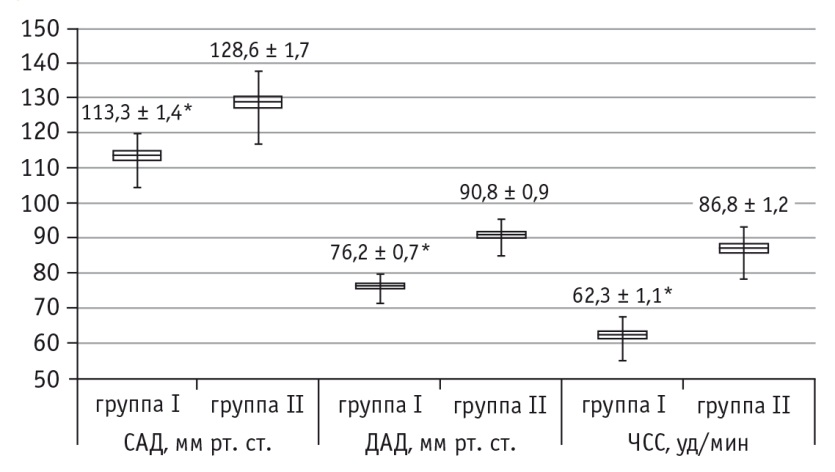
Рис. 2. Показатели периферической гемодинамики пациентов первой и второй групп на этапе индукции анестезии и интубации трахеи.
* P < 0,05
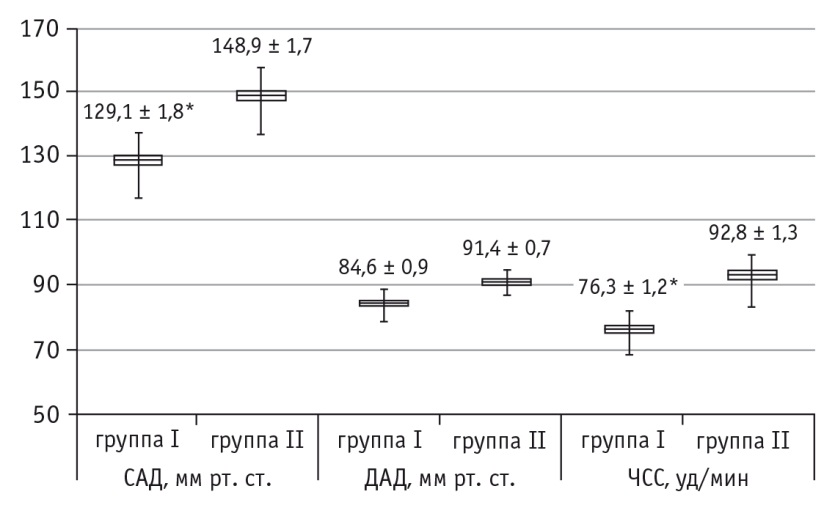
Выявлены достоверные различия между исследуемыми группами по уровням САД, ДАД и ЧСС после премедикации (в каждом случае р < 0,05) (см. рис. 1), по уровням САД и ЧСС на этапе индукции анестезии и интубации трахеи (в каждом случае p < 0,05) (см. рис. 2). Эти данные свидетельствуют о том, что адекватность анестезиологической защиты применявшихся видов премедикации имела клинически значимые различия.
Таким образом, динамика клинических показателей кровообращения указывала на меньшую выраженность стрессовых реакций, связанных с индукцией анестезии, интубацией трахеи и травматичным этапом операции, на фоне премедикации с применением дексмедетомидина, что, несомненно, повышает эффективность лечения.
Показатели КОС и газов артериальной крови на исследуемых этапах в группах достоверно не различались и не превышали границ физиологической нормы. В обеих группах во время анестезии и операции не происходило статистически значимых изменений показателей газообмена и рН; средние значения рСО2 в конце операции в первой (40,2 ± 0,7 мм рт. ст.) и второй (39,5 ± 0,5 мм рт. ст.) группах несколько превышали исходные и соответствовали нормокапнии (см. табл. 1, 2).
Следует отметить и тот факт, что глюкокортикоидный стрессответ на операционную травму был более выраженным у пациентов первой группы, где отмечена статистически значимая активация стрессреализующих механизмов на травматичном этапе операции и по ее окончании по сравнению с исходным уровнем (p < 0,05) с нормализацией через 10 минут после завершения оперативного вмешательства.
Динамика уровня глюкозы сыворотки крови исследована у пациентов обеих групп и отражена в таблицах 1, 2. Среди пациентов не было больных сахарным диабетом. Во избежание искажения результатов раствор глюкозы для инфузии во время анестезии и операции не вводили, в основном применяли изотонические растворы кристаллоидов. На всех этапах наблюдения и у всех пациентов уровень глюкозы находился в пределах физиологической нормы.
Перед проведением премедикации уровень кортизола у пациентов первой группы не выходил за пределы физиологической нормы, составляя в среднем 264,0 ± 10,2 нмоль/л (норма: 240–748 нмоль/л) (табл. 3). На травматичном этапе операции концентрация кортизола достоверно (р < 0,05) увеличивалась, но к концу оперативного вмешательства уменьшалась, при этом средний уровень кортизола на фоне действия операционной травмы был вдвое ниже верхней границы физиологической нормы. У пациентов второй группы во время операции происходила в среднем не имевшая статистической значимости активация глюкокортикоидной функции надпочечников с достоверным (р < 0,05) ростом концентрации кортизола на травматичном этапе операции и ее снижением к концу оперативного вмешательства (см. табл. 3).
Таблица 3
Динамика уровней кортизола у пациентов первой и второй групп на этапах анестезии и операции, нмоль/л
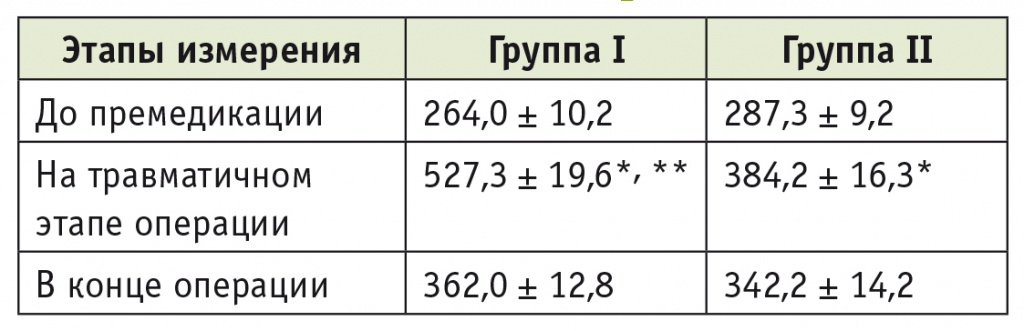
* P < 0,05 при сравнении с показателем до премедикации.
** P < 0,05 при сравнении со второй группой.
Высокое качество анестезиологической защиты подтверждается поддержанием уровней гликемии и кортизола у пациентов обеих групп в пределах «стресснормы»: рост уровня кортизола не превышал 37,1% в первой и 19,1% во второй группе и глюкозы — 21,3% и 7,5% соответственно.
Степень активации кортизола у пациентов первой группы может быть расценена как весьма умеренная, поскольку уровень гормона не только не превышал, но и во всех случаях был ниже верхнего предела физиологической нормы. Кроме того, отмеченный во время операции рост уровня кортизола свидетельствовал о сохранении у исследуемых пациентов способности коры надпочечников к повышению функциональной активности в условиях возросшей нагрузки на организм.
Выявлены статистически значимые различия между группами по времени пробуждения пациентов. Время, необходимое для полного пробуждения, в первой группе составило 4,1 ± 1,1 минуты, а во второй — 12,2 ± 1,2 минуты (р < 0,05). В первой группе время от окончания операции до экстубации трахеи оказалось почти втрое меньше, чем во второй: 6,3 ± 2,8 против 17,2 ± 1,7 минуты (р < 0,05).
Тошнота и рвота в ближайшем послеоперационном периоде достоверно чаще регистрировались во второй группе (p < 0,05). Кроме того, в первой группе, по сравнению со второй, отмечено статистически значимое снижение частоты возникновения ознобов и мышечной дрожи (p < 0,05) (табл. 4).
Таблица 4
Частота развития осложнений в ближайшем послеоперационном периоде в первой и второй группах, n (%)
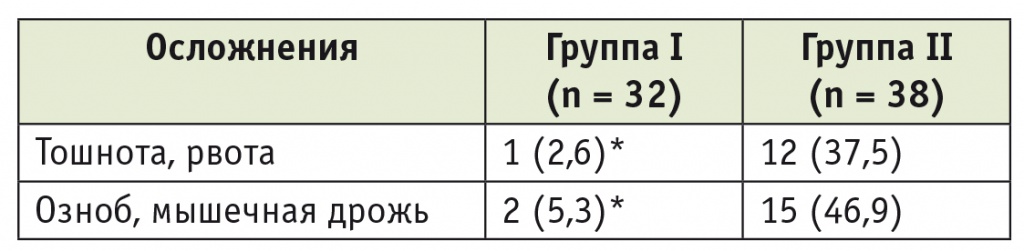
* P < 0,05 при сравнении со второй группой.
Отсутствие осложнений в ходе операции у пациентов первой группы позволяет сделать заключение о достаточной адекватности использования дексмедетомидина в качестве основного компонента премедикации.
Исследованные основные показатели периферической гемодинамики, показатели КОС, газового состава крови, SpO2 артериальной крови свидетельствуют о том, что в основной группе, при включении в протокол премедикации дексмедетомидина, общая анестезия протекала благоприятно, это подтверждается уменьшением числа осложнений в периоперационном периоде. Можно констатировать, что наиболее физиологичная, адекватная антиноцицептивная защита больных во время операции и в послеоперационном периоде достигалась у пациентов первой группы, где основным компонентом премедикации был дексмедетомидин.
Выводы
1. Проведенное клиническое исследование показывает возможность применения дексмедетомидина в премедикации перед плановыми хирургическими вмешательствами в качестве седативного компонента. Это обеспечивает стабильность гемодинамического профиля, показателей КОС и газового состава крови, адекватный стресспротективный эффект в сравнении с использованием у второй группы традиционных компонентов премедикации.
2. У пациентов первой группы имело место незначительное повышение физиологических значений маркеров стресса. Рост уровня кортизола от исходных значений не превышал 37,1%, глюкозы — 21,3%. Степень такой активации расценена как весьма умеренная, поскольку уровни этих показателей во всех случаях оставались ниже верхнего предела физиологической нормы.
3. Премедикация с применением дексмедетомина обеспечивает быстрое пробуждение, уменьшает количество постнаркозных осложнений (частота тошноты и рвоты у пациентов первой группы — 2,6% против 37,5% во второй группе; ознобов и мышечной дрожи — 5,3% против 46,9%).
4. Применение дексмедетомидина в премедикации позволяет улучшить качество общей анестезии при плановых лапароскопических хирургических вмешательствах.
ЗАКЛЮЧЕНИЕ
Премедикация инфузией дексмедетомидина не влияет на стабильность гемодинамики и газообмена, обладает хорошим стресспротективным эффектом и обеспечивает более быстрое пробуждение, чем традиционная премедикация диазепамом.








