Особое внимание в программе ERAS уделено предотвращению бронхопульмональных осложнений. Многие элементы протокола ERAS способны предупредить периоперационное повреждение легких или оказать благотворное влияние на тяжесть и характер течения послеоперационных осложнений [6]. Показано, что использование протективной ИВЛ: низкого дыхательного объема (5–7 мл/кг) и положительного давления конца выдоха (5 мбар) — позволяет статистически значимо уменьшить частоту пульмональных осложнений [7, 8].
Послеоперационные бронхопульмональные осложнения имеют важнейшее значение в торакальной онкохирургии. Хирургия рака легкого подразумевает расширенные объемы оперативных вмешательств и, как следствие, массивную редукцию легочной ткани; часто выполняются пневмонэктомии. У ряда пациентов с целью сокращения объема удаляемой легочной ткани применяются различные варианты бронхопластики. При вовлечении в патологический процесс карины или колец трахеи осуществляются резекция и сложнейшая реконструкция в данной зоне. Для вышеназванных групп пациентов, помимо традиционных послеоперационных осложнений, характерен высокой риск нарушения состоятельности швов, обеспечивающих герметичность культи бронха или сформированных анастомозов. Осложнения такого рода часто требуют выполнения повторного оперативного вмешательства и нередко приводят к фатальным последствиям [9–11].
Это наводит на мысль, что действующие принципы ERAS по профилактике бронхопульмональных осложнений для пациентов, прооперированных на легких, необходимо расширить. Согласно существующим рекомендациям, пациенты, перенесшие подобные оперативные вмешательства, должны быть экстубированы в операционной [12]. ИВЛ, продолженная в послеоперационном периоде, способствует развитию пневмонии, затрудняет отхождение бронхиального секрета и неблагоприятно влияет на анастомозы за счет положительного давления в дыхательных путях [13]. Кроме того, считается, что при продленной ИВЛ повышается частота бронхопульмональных осложнений, в том числе связанных с нарушением герметичности бронхиальных швов [14, 15].
Таким образом, необходимость ранней, желательно на операционном столе, экстубации пациентов, имеющих риск послеоперационного нарушения герметичности бронхиальных швов, не вызывает сомнений. На настоящий момент представляет интерес выбор оптимального варианта восстановления нейромышечной проводимости (НМП).
Цель исследования заключалась в оценке эффективности и безопасности применения препаратов с разным механизмом действия — неостигмина метилсульфата и сугаммадекса — для реверсии нейромышечного блока (НМБ) в программе мультимодальной ранней реабилитации пациентов после хирургических вмешательств.
МАТЕРИАЛЫ И МЕТОДЫ
Работа проведена под руководством д. м. н. В. Э. Хороненко на базе Московского научноисследовательского онкологического института им. П. А. Герцена — филиала ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России (отдел анестезиологии и реанимации и отдел торакоабдоминальной онкохирургии).
В исследование вошли 100 пациентов (74 мужчины и 26 женщин в возрасте 57 ± 8,5 года и с физическим статусом по шкале ASA преимущественно II–III), которым производились открытые оперативные вмешательства в объеме лобэктомии с бронхопластикой или пневмонэктомии по поводу рака легких либо метастазов рака других локализаций в легкие.
Для профилактики послеоперационного болевого синдрома за сутки до операции назначали антиконвульсант прегабалин — 75 мг 2 раза в сутки per os. На ночь перед операцией пациенты получали диазепам в дозе 10 мг в/м. За 2 часа до операции больные принимали утреннюю дозу прегабалина (75 мг). Пациентам проводили сочетанную общую анестезию с эпидуральным компонентом. Катетеризацию эпидурального пространства осуществляли на уровне Th4–Th6 с последующим проведением катетера в краниальном направлении на 4 см; затем начинали инфузию модифицированной смеси Брейвика (ропивакаин 3 мг/мл + фентанил 4 мкг/мл + адреналин 2 мкг/мл) со скоростью 5–15 мл/ч в течение операции. В послеоперационном периоде продолжалась дотация смеси Брейвика. Индукция анестезии включала в себя фентанил (0,002 мг/кг), пропофол (2 мг/кг), кетамин (25 мг), миорелаксацию рокурония бромидом в дозе 1,5 мг/кг. Для поддержания анестезии применяли десфлуран в дозе 0,5–1,0 МАК и фентанил болюсно в дозе 0,05–0,1 мг в/в на травматичных этапах операции и по мере необходимости, ориентируясь на показатели гемодинамики. Введение миорелаксанта рокурония бромида по 10–15 мг каждые 20–30 минут проводили под контролем TOFмониторинга (глубина блока поддерживалась на уровне TOF 1–2). В конце операции для профилактики вторичной гиперальгезии всем пациентам вводили анальгетик центрального действия нефопам в дозе 20 мг в/м.
Пациенты были рандомизированы на две группы, различавшиеся по способу реверсии НМБ. Группа N (неостигмин, n = 50): по окончании операции пациентам вводили ингибитор холинэстеразы неостигмина метилсульфат в дозе 50 мкг/кг и атропина сульфат в дозе 10 мкг/кг (для коррекции побочных эффектов неостигмина). Группа S (сугаммадекс, n = 50): по окончании вмешательства пациентам вводили препарат с прямым механизмом восстановления НМП за счет инкапсуляции миорелаксанта — сугаммадекс (Брайдан, производитель — MSD, США) в дозе 2 мг/кг.
Оценка восстановления НМП осуществлялась при помощи TOFмониторинга. С момента введения препарата для реверсии НМБ оценивали длительность периода до начала регистрации показателя TOF > 90%, после чего прекращали подачу десфлурана. Элиминацию ингаляционного анестетика из аппаратного контура осуществляли потоком свежего газа (10 л/мин).
Всех пациентов экстубировали на операционном столе после восстановления спонтанного дыхания, акта глотания и рефлекторной защиты дыхательных путей и далее переводили в ОРИТ для динамического наблюдения. Прием воды и пищи был разрешен через 2 часа после экстубации.
Интраоперационно осуществляли стандартный мониторинг показателей гемодинамики (AД, пульс, сатурация, ЭКГ), уровня анестезии (энтропия), НМП (TOFмониторинг при стимуляции каждые 20 секунд). Выполняли регистрацию продолжительности операции (T1), длительности реверсии НМБ с момента введения препарата для восстановления НМП до показателя TOF > 90% (Т2), временнóго интервала между окончанием операции и началом транспортировки пациента из операционной (Т3), суммарного времени пребывания больного в операционной (T4).
В первые сутки послеоперационного периода регистрировали интенсивность постторакотомического болевого синдрома (ПТБС) и наличие послеоперационной тошноты и рвоты (ПОТР) на различных этапах: 1я оценка — сразу после экстубации, три последующие — по окончании 1 часа, 12 и 24 часов после экстубации. Для оценки интенсивности ПТБС и послеоперационной тошноты использовали 100миллиметровую визуальноаналоговую шкалу (ВАШ): пациентам предлагалось оценить интенсивность осложнения в баллах, установив специальный бегунок в определенной точке. Крайние точки шкалы для ПТБС были определены как «нет боли» и «настолько сильно болит, насколько это возможно себе представить», для послеоперационной тошноты — как «нет тошноты» и «настолько сильно тошнит, насколько это возможно себе представить». ПОТР определяли при наличии как минимум одного из трех событий: факта рвоты, факта позыва на рвоту, послеоперационной тошноты интенсивностью выше 50 баллов по ВАШ.
Кроме того, оценивали продолжительность пребывания пациентов в ОРИТ и стационаре, частоту осложнений, летальность.
Статистическую обработку данных проводили с помощью программы Statistica 6.0 для Windows (StatSoft Inc., США). Различия между относительными величинами оценивали с помощью критерия Пирсона (χ2), между абсолютными величинами — с помощью Uкритерия Манна — Уитни. Разницу показателей признавали статистически значимой при p < 0,05.
РЕЗУЛЬТАТЫ
Пациенты групп сравнения не имели различий по демографическим характеристикам, физическому статусу и объему проведенного хирургического лечения. Сравнительный анализ течения анестезии и операции показал, что продолжительность вмешательства, кровопотеря, потребность в анестетиках, опиоидных анальгетиках и миорелаксантах также достоверно не различались (табл. 1).
Таблица 1
Характеристика исследуемых групп
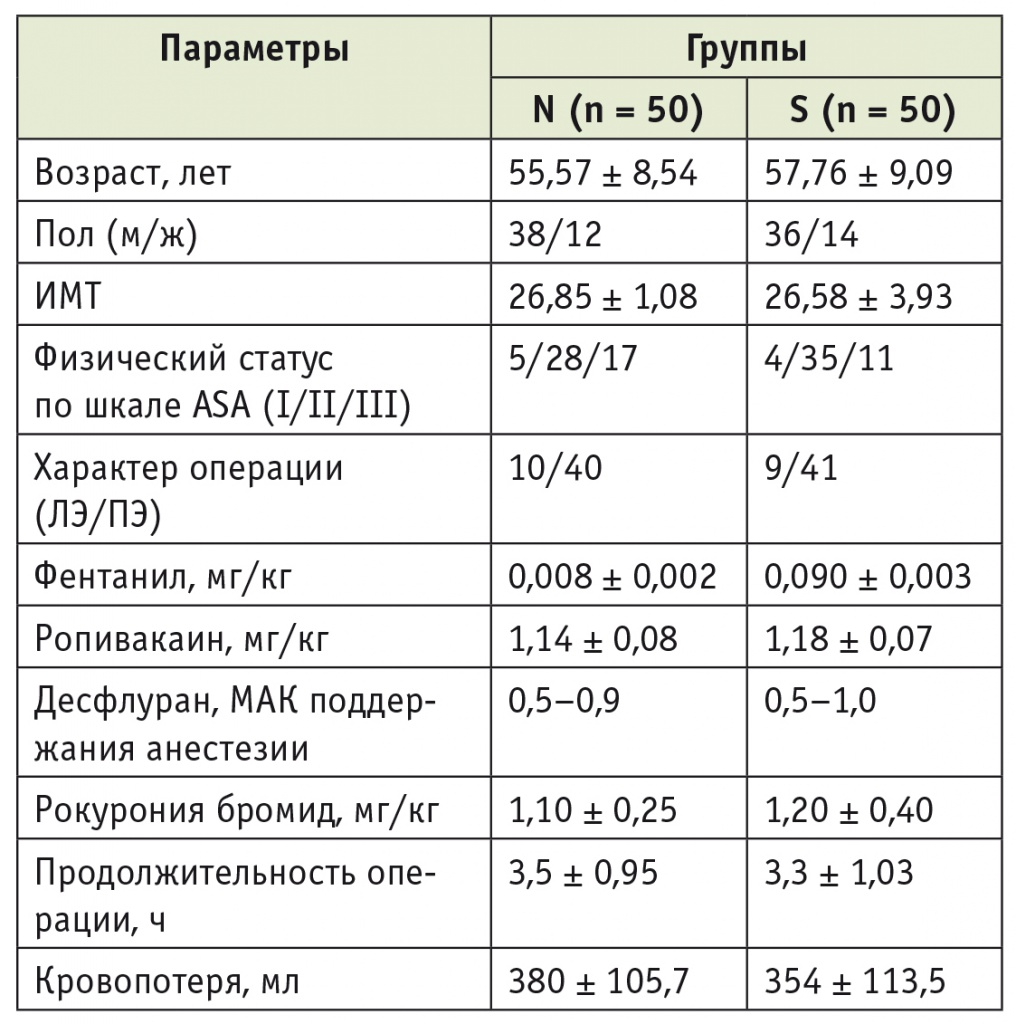
Примечание: ИМТ — индекс массы тела; ЛЭ — лобэктомия с бронхопластикой; ПЭ — пневмонэктомия; ASA — American Society of Anesthesiologists (Американское общество анестезиологов).
При оценке временны́х интервалов восстановления НМП и нахождения пациента в операционной период Т1 не имел различий в группах сравнения. Периоды Т2 и Т3 в группе S были достоверно меньше, чем в группе N, т. е. реверсия НМБ и начало транспортировки больного из операционного зала при использовании сугаммадекса происходили статистически значимо раньше, чем при применении неостигмина. Однако в связи с широким разбросом продолжительности хирургического вмешательства различия в 15–20 минут, достигнутые в эти периоды, не повлекли за собой статистически значимой разницы по интервалу T4. Общее время нахождения пациента в операционной в группах сравнения было одинаковым (табл. 2).
Таблица 2
Средние значения временны́х интервалов в исследуемых группах
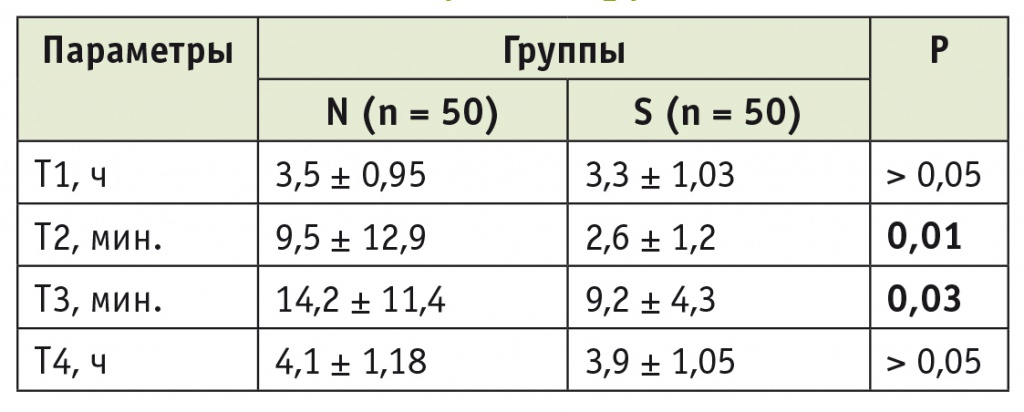
Примечание: T1 — продолжительность операции; Т2 — длительность восстановления нейромышечной проводимости до TOF > 90%; Т3 — время между окончанием операции и началом транспортировки пациента из операционной; T4 — суммарное время пребывания больного в операционной.
Использование различных вариантов восстановления НМП не оказало влияния на частоту развития и выраженность ПТБС. В первые сутки после операции в обеих группах на фоне профилактической терапии отмечался ПТБС слабой степени выраженности (табл. 3).
Таблица 3
Динамика постторакотомического болевого синдрома и послеоперационной тошноты и рвоты в исследуемых группах в первые сутки после операции
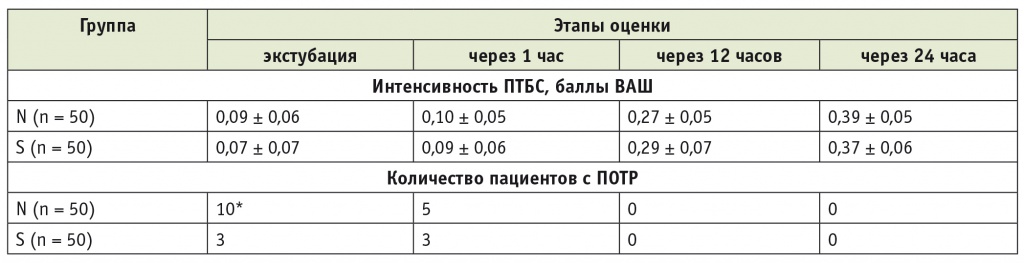
* P < 0,05 при сравнении с группой S.
Примечание: ВАШ — визуальная аналоговая шкала; ПОТР — послеоперационная тошнота и рвота; ПТБС — постторакотомический болевой синдром.
Иные результаты были получены при анализе частоты и интенсивности такого неприятного осложнения, как ПОТР. В группе N пациенты страдали ПОТР достоверно чаще, чем в группе S (см. табл. 3). Возможно, развитие ПОТР в ранние сроки после экстубации трахеи было связано с непосредственным влиянием неостигмина на вегетативный тонус, так как в более поздние часы послеоперационного периода различий по частоте ПОТР выявлено не было. Прием жидкости и энтеральное питание в группах N и S были начаты в одинаковые сроки.
Послеоперационный период оценивали также по количеству осложнений и времени пребывания пациентов в ОРИТ и стационаре. Проведенный анализ не выявил статистически значимых различий между группами N и S по частоте развития послеоперационного делирия, пневмонии и кардиоваскулярных расстройств. Частота хирургических осложнений, таких как кровотечение и несостоятельность культи бронха, в группах сравнения также не различалась. Пациенты обеих групп провели равное время в палате интенсивной терапии и в стационаре в целом (табл. 4).
Таблица 4
Течение послеоперационного периода в исследуемых группах
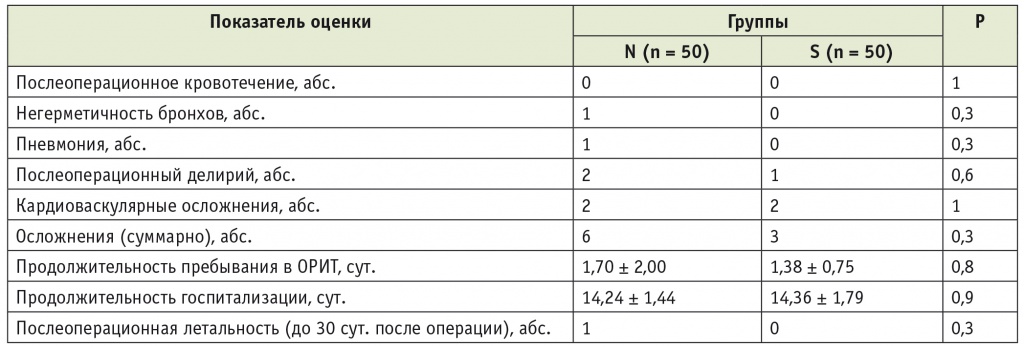
Примечание: ВАШ — визуальная аналоговая шкала; ОРИТ — отделение реанимации и интенсивной терапии.
За время исследования от нозокомиальной пневмонии, устойчивой к антибактериальной терапии, скончался один пациент из группы N (см. табл. 4).
ОБСУЖДЕНИЕ
Неотъемлемым компонентом анестезиологического обеспечения хирургических вмешательств является блокада нейромышечного проведения, позволяющая достичь максимального обзора зоны операции и эффективной ИВЛ. В представленной работе изучено влияние препаратов для реверсии НМБ, обладающих принципиально различным механизмом действия, на послеоперационную реабилитацию онкологических больных, перенесших обширные вмешательства на легких.
В группах сравнения использовали неостигмин и сугаммадекс. Неостигмин — препарат мускариноподобного действия, который относится к группе ингибиторов холинэстеразы, что определяет его активирующее влияние на парасимпатическую нервную систему и известные побочные эффекты, нивелировать которые приходится введением холинолитиков. Действие сугаммадекса обусловлено прямым захватом молекулы стероидного миорелаксанта, его инкапсуляцией и выведением через почки. Ввиду этого он лишен каких-либо побочных эффектов.
В качестве показателя ранней послеоперационной реабилитации было оценено время, которое потребовалось для восстановления НМП до TOF > 90% после введения того или иного препарата. Проведено также сравнение времени с момента окончания операции до возможности осуществить транспортировку пациента на самостоятельном дыхании в ОРИТ и суммарной продолжительности пребывания пациента в операционном зале. Проанализировано течение послеоперационного периода у торакальных больных с позиций частоты развития осложнений и сроков пребывания в ОРИТ и в стационаре в целом.
В нашей работе удалось показать преимущество сугаммадекса в средней дозе 2 мг/кг перед неостигмином в дозе 50 мкг/кг при реверсии НМБ у пациентов, которым в связи с особенностями операции (легочные осложнения) и анестезии (использование двухпросветной трубки) показана ранняя экстубация на операционном столе. При применении сугаммадекса для наступления достаточной реверсии НМБ (TOF > 90%), позволяющей анестезиологу принять решение о подготовке к экстубации, требуется достоверно меньше времени, чем при использовании неостигмина. Данные результаты, вероятнее всего, связаны с тем, что наступление эффекта сугаммадекса происходит раньше и является более предсказуемым. Стандартное отклонение средней величины времени с момента внутривенного введения агента для реверсии НМБ до регистрации TOF > 90% в группе сугаммадекса составило ±1,2 минуты, в то время как в группе неостигмина — ±12,9 минуты. Более высокое значение стандартного отклонения в группе неостигмина говорит о большей волатильности данных. В такой выборке данные беспорядочно и сильно рассеяны вокруг центра, что на практике определяет непредсказуемость и ненадежность эффектов исследуемого препарата.
Кроме того, сокращение времени, необходимого для восстановления адекватной НМП и последующей экстубации, в группе сугаммадекса привело к статистически значимому уменьшению периода пребывания пациента в операционном зале после окончания операции.
Полученные нами результаты соответствуют данным мировой литературы, согласно которым сугаммадекс обладает преимуществом перед неостигмином в восстановлении НМП как при глубоком, так и при поверхностном блоке [16–18]. Углубленный анализ современной литературы позволил найти указания на то, что время реверсии глубокого НМБ сугаммадексом может достигать 20 минут [17, 19].
В нашем исследовании проанализированы выраженность ПТБС и частота ПОТР при разных вариантах реверсии НМБ. По частоте возникновения и выраженности болевого синдрома различий в группах сравнения не выявлено. Однако в первые сутки после операции пациенты, которые после экстубации трахеи получили неостигмин, страдали ПОТР чаще, чем получившие сугаммадекс: 10/50 и 3/50 соответственно (р < 0,05). В дальнейшем послеоперационный период в обеих группах протекал без ПОТР. Подобная ситуация обусловлена, по-видимому, эметогенными свойствами неостигмина, относящегося к группе ингибиторов холинэстеразы и оказывающего мускариноподобное воздействие на ЖКТ и его перистальтику [20]. В ряде работ показано, что частота развития ПОТР при использовании неостигмина имеет четкий дозозависимый характер. Так, при его применении в дозе 1,5 мг тошнота и рвота после оперативных вмешательств развиваются более чем в 2 раза реже, чем в дозе 2,5 мг [21].
В отношении сроков пребывания пациентов в ОРИТ и в стационаре сугаммадекс в качестве агента для реверсии НМБ не показал достоверных преимуществ перед неостигмином, однако в мировой практике подобные результаты есть. По-видимому, их можно связать со статистически значимым влиянием продолжительности ИВЛ на риск развития легочных осложнений у данной категории больных [22, 23]. В нашей работе использование сугаммадекса позволило сократить время ИВЛ в среднем на 15 минут, что в ряде случаев имеет значение. Однако достоверной разницы между группами исследования ни по частоте серьезных послеоперационных осложнений, ни по срокам пребывания в стационаре не было обнаружено, что также не противоречит результатам ряда работ [18, 24, 25].
В современной литературе по вопросам влияния реверсии НМБ на сроки послеоперационной реабилитации торакальных больных одним из самых распространенных подходов к изучению НМБ является его оценка с позиций оптимальной глубины блока [26, 27]. В нашей повседневной практике мы стараемся поддерживать TOF на уровне 1–2, на данный момент считающемся достаточным, однако поиск оптимальной глубины НМБ в торакальной хирургии и оценка влияния этого параметра на результаты лечения представляют несомненный интерес.
ЗАКЛЮЧЕНИЕ
Сравнительный анализ восстановления нейромышечной передачи после обширных онкологических вмешательств на легких с помощью неостигмина и сугаммадекса показал, что последний имеет ряд преимуществ, позволяющих считать его препаратом выбора у торакальных больных, нуждающихся в максимально раннем проведении экстубации трахеи и переводе с искусственной вентиляции легких на самостоятельное дыхание. Он обладает высокой и предсказуемой эффективностью при реверсии нейромышечного блока, вызванного стероидными миорелаксантами, при отсутствии значимых побочных эффектов.








