ПОСТПЕРФУЗИОННЫЙ СИНДРОМ И ПРИЧИНЫ ЕГО РАЗВИТИЯ
Постперфузионный синдром представляет собой нарушения функций различных органов и систем после операций на сердце в условиях искусственного кровообращения (ИК). В их число входят сердечная недостаточность (как систолическая, так и диастолическая), дыхательная недостаточность (синдром «постперфузионных легких», повышение риска развития инфекции), острое повреждение почек, церебральная дисфункция (нейрокогнитивные расстройства, нарушение мозгового кровообращения), нарушения системы гемостаза (коагулопатия и тромбоцитарная дисфункция), различные метаболические расстройства [2].
Послеоперационная полиорганная дисфункция развивается не только в результате воздействия хирургической травмы на организм, значительный вклад в ее формирование вносят негативные эффекты ИК. Несмотря на значительное совершенствование методики ИК, его проведение попрежнему остается нефизиологичной процедурой [3].
Ключевыми патофизиологическими звеньями постперфузионного синдрома являются: контакт крови с инородной поверхностью контура ИК и воздухом, системная гепаринизация с последующей реверсией, гипотермия, возвращение крови из операционной раны в системную циркуляцию, тканевые и воздушные микроэмболии, механическая травма клеток крови, гемодилюция, гипероксия, нефизиологичные кровоток и распределение объема циркулирующей крови (ОЦК), гипоперфузия внутренних органов [2, 3].
Системная воспалительная реакция (СВР) — главный триггер постперфузионного синдрома. Она развивается вследствие операционной травмы и контакта крови с инородной поверхностью контура ИК: запускается каскад активации системы комплемента, калликреинкининовой системы, коагуляции и фибринолиза, происходит активация лейкоцитов, тромбоцитов и клеток эндотелия [4, 5], результатом чего становятся нарушение проницаемости сосудов, интерстициальный отек, коагулопатия, расстройства тромбоцитарного гемостаза и нарушения микроциркуляции. Эти явления могут усугубляться гипотермией, несмотря на ее органопротективное предназначение [3].
Немалый вклад в развитие СВР и нарушений гемостаза вносит возврат излившейся в операционную рану крови в системную циркуляцию. Раневая кровь контактирует с тканями организма и инородными поверхностями, подвергается механической травме и смешивается с воздухом. Это вызывает гемолиз, запуск каскада коагуляции и фибринолиза, активацию тромбоцитов и лейкоцитов. В системный кровоток попадает большое количество провоспалительных цитокинов, эмбологенных липидных субстанций и воздушных микроэмболов, которые не всегда задерживаются фильтрами [6–8].
Другим патологическим фактором ИК является гемодилюция. Первоначально считалось, что инфузионная нагрузка в условиях хирургической травмы улучшает микроциркуляцию и перфузию тканей и позволяет снизить кровопотерю [9]. Однако в дальнейших исследованиях была установлена взаимосвязь гемодилюции с развитием послеоперационных осложнений и летальными исходами [10]. Одномоментное поступление избытка жидкости в сосудистое русло во время начала ИК вызывает дисбаланс свертывающей и противосвертывающей систем, уменьшение гематокрита и доставки кислорода к тканям, перемещение жидкости в интерстиций с развитием отека [11].
Помимо снижения доставки кислорода к тканям, при начале ИК может наблюдаться гипероксия, которая инициирует свободнорадикальное окисление [3].
МИНИИНВАЗИВНОЕ ЭКСТРАКОРПОРАЛЬНОЕ КРОВООБРАЩЕНИЕ КАК СТРАТЕГИЯ ПРЕДОТВРАЩЕНИЯ НЕГАТИВНЫХ ЭФФЕКТОВ ИСКУССТВЕННОГО КРОВООБРАЩЕНИЯ
Большинство описанных побочных эффектов ИК потенциально предотвратимы, либо их выраженность возможно снизить. Один из путей уменьшения негативных последствий ИК — миниинвазивное экстракорпоральное кровообращение (МиЭКК).
МиЭКК — это мультидисциплинарная стратегия, основанная на комплексном подходе с участием хирурга, анестезиологареаниматолога и перфузиолога и направленная на снижение инвазивности оперативного вмешательства в условиях экстракорпорального кровообращения [12].
Разработка методики началась с применения закрытых систем ИК с центрифужным насосом для продленной экстракорпоральной поддержки кровообращения. Затем в контур был добавлен модуль для кровяной кардиоплегии по A. Calafiore. Системы стали использовать для обеспечения ИК при операциях на сердце [13]. Методику называли минимизированным, или миниатюризированным, ИК, что отражало только уменьшение размеров экстракорпорального контура [2].
Среди первых публикаций встречалась серьезная критика миниатюризированного ИК, связанная с риском воздушной эмболии [14]. Это стало стимулом для усовершенствования контура ИК и разработки мультидисциплинарного подхода [15]. Рост интереса к методике и накопление мирового опыта привели к организации Международного общества специалистов по миниинвазивным экстракорпоральным технологиям (англ. Minimal Invasive Extracorporeal Technologies International Society — MiECTiS).
В декабре 2014 г. MiECTiS был выработан согласительный документ, где были обобщены данные проведенных на тот момент рандомизированных исследований и упорядочены терминология и рекомендации. В согласительном протоколе впервые было предложено определение МиЭКК как мультидисциплинарной стратегии. Рекомендуемые компоненты контура МиЭКК получили разделение на основные (обязательные) и дополнительные (факультативные). Основными компонентам были названы закрытая система ИК без твердого венозного резервуара (его функцию выполняет венозное русло пациента), центрифужный насос, биологически совместимое покрытие всех компонентов контура и система для элиминации воздуха. К дополнительным компонентам отнесены мягкий резервуар, система аспирации с саморегулирующимся разрежением (англ. smart suction), системы для декомпрессии (англ. vent) отделов сердца и крупных сосудов (корня аорты и легочных сосудов) и др.
МиЭКК предусматривает отказ от забора в контур необработанной крови из операционной раны [12]. Наличие закрытого контура ИК, необходимость управления преднагрузкой и отказ от прямого забора излившейся крови в контур ИК требуют адаптации хирургической и анестезиологореанимационной тактики. Таким образом, характеристики контура МиЭКК предполагают реализацию командной стратегии с заблаговременной разработкой четкого сценария действий, постоянной коммуникацией и своевременным принятием решения о возможной конверсии в классическое ИК.
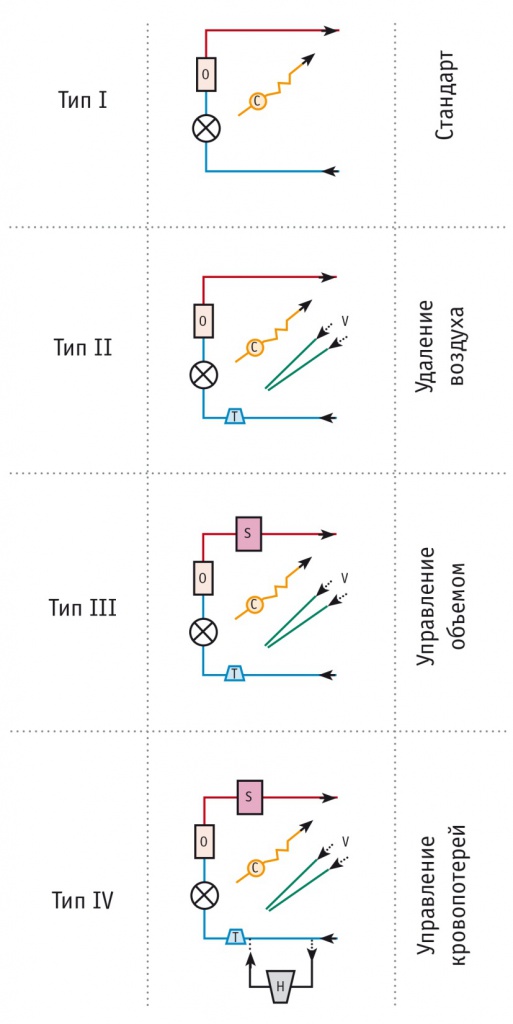
В согласительном протоколе предложена классификация контуров МиЭКК (рис.), разработанная K. Anastasiadis и соавт. в 2015 г. [16]. Согласно ей выделены четыре типа миниинвазивных экстракорпоральных контуров:
• I тип — закрытая система, состоящая из магистралей, центрифужного насоса, оксигенатора с терморегулирующим устройством и системы для проведения кардиоплегии;
• II тип — контур I типа, дополненный венозной воздушной ловушкой;
• III тип контуров, помимо перечисленных компонентов, включает мягкий коллабирующий венозный резервуар, предназначенный для управления ОЦК;
• к IV типу относятся так называемые модульные системы, которые представляют собой систему II или III типа с интегрированным твердым венозным резервуаром, выключенным из общей циркуляции. Данный резервуар предназначен для экстренной конверсии в классическое ИК или для кратковременного планового этапа операции, сопровождающегося риском воздушной эмболии.
Рис. Классификация контуров мини-инвазивного экстракорпорального кровообращения (МиЭКК) по K. Anastasiadis и соавт. [12].
Примечание. C — система для кардиоплегии; H — твердый венозный резервуар; O — оксигенатор; S — мягкий резервуар; T — воздушная ловушка/устройство для удаления воздуха; V — система дренирования (англ. vent) корня аорты/легочных сосудов; X — главный насос искусственного кровообращения
ПРЕИМУЩЕСТВА СТРАТЕГИИ МИНИИНВАЗИВНОГО ЭКСТРАКОРПОРАЛЬНОГО КРОВООБРАЩЕНИЯ ПЕРЕД КЛАССИЧЕСКИМ ИСКУССТВЕННЫМ КРОВООБРАЩЕНИЕМ
Разработка компонентов контура МиЭКК, как и всей стратегии, направлена на исключение либо снижение инициации триггеров постперфузионного синдрома.
Уменьшение площади контура ИК и отсутствие твердого венозного резервуара позволяют снизить контакт крови пациента с инородной поверхностью и воздухом. Благодаря этому при использовании МиЭКК отмечается меньшая выраженность СВР, что лабораторно подтверждается уменьшением количества нейтрофилов и провоспалительных цитокинов (ИЛ6, ИЛ8, ИЛ10, ФНОα, фактора адгезии нейтрофилов) в раннем послеоперационном периоде [2]. При обработке крови, излившейся в операционную рану, перед ее возвратом в циркуляцию предотвращается поступление в контур ИК провоспалительных цитокинов и эмбологенных субстанций [6, 7].
Однако наряду с многочисленными публикациями, показавшими снижение маркеров СВР после МиЭКК, существуют единичные исследования с индифферентными результатами [17]. На сегодняшний день класс рекомендаций касательно СВР при МиЭКК соответствует уровню IIB [12]. Это можно объяснить отсутствием крупных многоцентровых исследований, а также разнородностью маркеров СВР и временны́х интервалов их оценки в исследованиях.
Уменьшение площади контура ИК позволяет редуцировать первичный объем его заполнения, что способствует снижению гемодилюции и сохранению адекватной доставки кислорода к тканям [11]. Согласно рекомендациям Общества торакальных хирургов (англ. Society of Thoracic Surgeons) и Общества сердечнососудистых анестезиологов (англ. Society of Cardiovascular Anesthesiologists) (2011), применение «минимизированных контуров ИК» является кровосберегающей технологией (класс рекомендаций — I, уровень доказательности — A). МиЭКК позволяет уменьшить количество гемотрансфузий, а следовательно, и связанных с ними осложнений [18].
Помимо снижения гемодилюции и контактной активации клеток крови, сохранению коагуляционного потенциала способствует биологически совместимое покрытие контура МиЭКК, которое позволяет снизить дозы гепарина и потребность в протамине. Перечисленные факторы приводят также к сохранению большего числа функционирующих тромбоцитов [19, 20]. Благоприятное влияние на интра и послеоперационный гемостаз сопровождается снижением потребности в переливании свежезамороженной плазмы [21].
Клинический результат применения МиЭКК оценивался во многих одноцентровых рандомизированных исследованиях. Кроме того, проведено несколько крупных метаанализов. Наиболее достоверны результаты исследований защиты миокарда, показавшие преимущество МиЭКК (класс рекомендаций — I, уровень доказательности — A) [19]. Благоприятное влияние МиЭКК на сердечную мышцу связано со снижением выраженности СВР, улучшением доставки кислорода и лучшей реперфузией. Когда функцию венозного резервуара выполняет естественное русло пациента, остается неизменным циркулирующий объем и ИК становится более физиологичным.
По сравнению с классическим ИК, при МиЭКК отмечают более высокое среднее АД при той же скорости кровотока. Это ведет к улучшению перфузии всех внутренних органов и доставки кислорода к тканям [13]. За счет меньшего выброса вазоактивных веществ на фоне МиЭКК сохраняется естественная регуляция сосудистого тонуса. Стабильность общего периферического сопротивления сосудов сопряжена с меньшей потребностью в вазопрессорной поддержке. Благоприятное влияние МиЭКК на капиллярную органную перфузию подтверждается снижением уровней маркеров повреждения внутренних органов (почек, легких, кишечника) и положительной динамикой данных периоперационной капилляроскопии [22, 23].
Отсутствием резких волемических колебаний при начале МиЭКК предотвращаются гипотензия и нарушения ритма, нередко встречающиеся при начале классического ИК [22]. В послеоперационном периоде также отмечается меньшая частота возникновения фибрилляции предсердий (уровень доказательности — IА) [19].
Редуцирование газовых, тканевых и жировых микроэмболий, улучшение перфузии и доставки кислорода (по данным церебральной оксиметрии) способствуют уменьшению числа неврологических осложнений. Во многих публикациях показано снижение частоты острого нарушения мозгового кровообращения и когнитивных расстройств при МиЭКК [19, 24, 25]. Однако на сегодняшний день объем этих исследований недостаточен.
Концепция МиЭКК успешно включается в протоколы ускоренного выздоровления (англ. Enhanced Recovery After Surgery, Fast Track) [26, 27]. Органопротекция МиЭКК способствует ранней активизации пациентов, сокращению сроков пребывания в ОРИТ и длительности госпитализации [27]. Как следствие улучшения переносимости ИК, отмечается повышение качества жизни пациентов [28]. В нескольких публикациях не обнаружено различий между ИК и МиЭКК в сроках послеоперационной искусственной вентиляции легких (ИВЛ), в длительности пребывания в ОРИТ и госпитализации. Но надо отметить, что в этих работах МиЭКК применяли у пациентов с заведомо большей коморбидностью и худшим прогнозом по шкалам риска [29]. Это говорит о том, что внедрение стратегии МиЭКК позволяет в некоторых случаях пересматривать вопрос об операбельности пациента [30].
ОСОБЕННОСТИ ИНТЕГРАЦИИ И ПЕРСПЕКТИВЫ МИНИИНВАЗИВНОГО ЭКСТРАКОРПОРАЛЬНОГО КРОВООБРАЩЕНИЯ В КАРДИОХИРУРГИЧЕСКОЙ ПРАКТИКЕ
На сегодняшний день интеграция методики МиЭКК в повседневную практику остается достаточно низкой, несмотря на благоприятный потенциал. Одно из препятствий представляет консервативная приверженность большинства операционных бригад традиционным подходам. При работе с МиЭКК некоторые классические стереотипы действий значительно изменяются. Для перфузиолога могут быть непривычными работа с центрифужным насосом, необходимость непрерывного контроля и управления ОЦК. Хирург должен изменить алгоритм канюляции, уделив внимание профилактике воздушной эмболии, помнить об опасности дислокации венозной канюли и вскрытия полостей. От анестезиолога требуется поддерживать положительное давление в дыхательных путях пациента на протяжении всего перфузионного периода, избегать болюсного введения лекарственных препаратов, отказаться от диуретиков, согласовывать инфузионную нагрузку с перфузиологом [2].
Существует также обеспокоенность хирургов и перфузиологов относительно риска кровопотери, воздушной эмболии и трудностей управления ОЦК. Зарубежные авторы также описывают данные особенности [31]. Для успешной реализации стратегии МиЭКК необходимо понимание потенциальных рисков, путей их профилактики и быстрого устранения. Рекомендуется использовать системы МиЭКК как минимум II типа с устройством для элиминации воздуха и обеспечивать незамедлительный гемостаз независимо от этапа операции. В этом случае риск осложнений минимизируется и процедура становится технически выполнимой и безопасной [15, 31–33].
Интеграции методики могут препятствовать сомнения относительно ее эффективности. При наличии многочисленных рандомизированных исследований и метаанализов, показавших ее преимущества, объемы многоцентровых исследований на сегодняшний день еще недостаточны [12].
Тем не менее международное сообщество отмечает рост заинтересованности в МиЭКК медицинских учреждений и специалистов. Активно разрабатываются образовательные программы как за рубежом, так и в России. Запланировано многоцентровое исследование Conventional versus Minimally Invasive extracorporeal circulation in patients undergoing Cardiac Surgery (COMICS), дизайн которого был представлен на Втором съезде MiECTiS в 2016 г. в Афинах [34]. В рамках исследования поставлена задача прояснить сомнительные моменты относительно влияния МиЭКК на СВР, клинический результат и, что не менее важно, оценить экономическую целесообразность методики.
Перспективным считают проведение МиЭКК с использованием модульных систем (IV типа по классификации K. Anastasiadis и соавт. [16]). Благодаря интегрированному твердому венозному резервуару они дают возможность сделать течение МиЭКК более гибким. В случае изменения интраоперационной ситуации можно мгновенно переключиться на классическое ИК, избежав негативных последствий. К числу так называемых аварийных ситуаций принадлежат угроза воздушной эмболии и кровотечение. Модульные системы позволяют выполнять операции со вскрытием полостей сердца — вмешательства на клапанах и аорте, закрытие септального дефекта. Кратковременное переключение на классическое ИК менее травматично для пациента, чем операция, полностью проведенная в условиях классического ИК. Повторные операции на сердце также становятся более безопасными [16]. Отмечается тенденция к применению МиЭКК во время видеоассистированных вмешательств на сердце из минидоступа [35].
Параллельно с периоперационным использованием систем МиЭКК существуют рекомендации по их применению для непродолжительной экстракорпоральной поддержки жизни [36].
В последнее время в публикациях встречается сравнение МиЭКК при аортокоронарном шунтировании (АКШ) с операциями на работающем сердце (offpump) [37]. В рекомендациях по реваскуляризации миокарда Европейского общества кардиологов (англ. European Society of Cardiology)/Европейской ассоциации кардиоторакальных хирургов (англ. European Association for CardioThoracic Surgery) (2014) предлагается рассматривать АКШ offpump в качестве операции выбора для пациентов высокого риска в крупных медицинских центрах (класс рекомендации — IIa, уровень доказательности — В) [38]. Самое большое и скрупулезно организованное многоцентровое исследование CORONARY не выявило различий в отдаленных результатах между АКШ с ИК и offpump [39]. В ближайшие сроки (в течение 30 дней) после АКШ offpump отмечено статистически значимое снижение числа гемотрансфузий, реопераций по поводу кровотечений, случаев острого повреждения почек, длительности ИВЛ и респираторных осложнений по сравнению с группой ИК (p < 0,05). Однако в группе offpump констатировано меньшее количество анастомозов на пациента (p < 0,001), а частота неполных реваскуляризаций (по интраоперационной оценке хирурга) была более высокой (p = 0,05). Число ранних повторных реваскуляризаций миокарда было достоверно выше после АКШ offpump (p = 0,01), притом что в исследовании участвовали только опытные хирурги, одинаково владеющие обеими методиками [40]. Место АКШ offpump в структуре оказания помощи остается предметом дискуссий [41]. На этом фоне МиЭКК выглядит привлекательной альтернативой, сохраняющей технические преимущества ИК, но позволяющей избежать его негативных эффектов [37]. Метаанализ, проведенный U. Benedetto и соавт., показал сравнимые результаты АКШ offpump и МиЭКК в отношении госпитальной летальности, частоты нарушений мозгового кровообращения, случаев заместительной почечной терапии, послеоперационной фибрилляции предсердий, повторных вмешательств по поводу кровотечений, а также числа гемотрансфузий и объема послеоперационной кровопотери [42]. В зарубежных публикациях обсуждается вопрос о возможности применения МиЭКК в качестве стандарта при проведении реваскуляризации миокарда [37].
ОПЫТ ПРИМЕНЕНИЯ МИНИИНВАЗИВНОГО ЭКСТРАКОРПОРАЛЬНОГО КРОВООБРАЩЕНИЯ В ФГБУ «КЛИНИЧЕСКАЯ БОЛЬНИЦА» УПРАВЛЕНИЯ ДЕЛАМИ ПРЕЗИДЕНТА РФ
Методика МиЭКК применяется в ФГБУ «Клиническая больница» УД Президента РФ с 2015 г. На сегодняшний день выполнено 10 операций с МиЭКК, в том числе 9 операций АКШ и одна операция АКШ в сочетании с пластикой постинфарктной аневризмы сердца. Использовались системы III или IV типа (по классификации K. Anastasiadis и соавт. [16]). Проводились нормотермическая перфузия, кровяная перемежающаяся кардиоплегия по A. Calafiore и стандартное анестезиологическое сопровождение, адаптированное к МиЭКК. Часть операционной бригады уже имела опыт работы с МиЭКК, в связи с чем кривая обучения (англ. learning curve) как таковая отсутствовала [43]. Конверсии в классическое ИК ни в одном случае не потребовалось.
ЗАКЛЮЧЕНИЕ
Комплексная стратегия миниинвазивного экстракорпорального кровообращения (МиЭКК) позволяет успешно выполнять операции на сердце в условиях искусственного кровообращения (ИК), в том числе у пациентов с высоким риском осложнений и коморбидностью. По наблюдениям авторов, методика показала себя хорошо воспроизводимой и безопасной. МиЭКК потенциально позволяет редуцировать ряд негативных эффектов ИК: снизить выраженность системной воспалительной реакции и нарушений гемостаза; уменьшить число и объем гемотрансфузий и переливаний свежезамороженной донорской плазмы. В результате сокращаются сроки пребывания в ОРИТ и длительность госпитализации. Это позволяет рассматривать МиЭКК как составляющую протоколов ускоренного выздоровления пациентов (Fast Track).








