С возникновением нового понятия «Fast-Track-хирургия», или «ранняя реабилитация после операции» (Enhanced Recovery After Surgery — ERAS), в мировой медицинской практике стали активно пересматриваться традиционные подходы к периоперационному ведению больных[7]. В ходе многоцентровых исследований было доказано, что в Fast-Track-хирургии выбор минимально инвазивных способов хирургического лечения, безопасных методов анестезии, оптимального периоперационного контроля боли и современных методов активного послеоперационного восстановления уменьшает проявления хирургического стресса и органной дисфункции, что значительно ускоряет процесс послеоперационного восстановления пациентов[7]. Однако, несмотря на совершенствование хирургической техники и активное внедрение в практику методов и средств профилактики послеоперационных осложнений (таких как периоперационная антибактериальная профилактика и антитромботическая защита), частота послеоперационных осложнений в абдоминальной хирургии остается высокой. Одна из основных причин — отсутствие скрининга питательного статуса (ПС) пациента при поступлении в клинику с соответствующей недооценкой степени его нарушений[5, 12]. В частности, мальнутриция остается проблемой у больных колоректальным раком из-за недостаточного внимания к этой проблеме у практических врачей[1, 6].
В то же время заживление ран и нормальный иммунный ответ напрямую зависят от доставки нутриентов и адекватно подобранной программы нутритивной поддержки, поэтому адекватное питание способно улучшать репаративные процессы, восстанавливать иммунокомпетентность и снижать периоперационную заболеваемость и летальность[5]. В мировой литературе приводится большое количество данных о нарушении питания и белкового обмена у больных онкологического профиля, что проявляется синдромом гиперметаболизма — гиперкатаболизма[8–10, 13]. В послеоперационном периоде принято назначать нутритивную поддержку больным из расчета потребностей в энергии на килограмм массы тела, однако общее состояние больного и его нутритивный статус не являются стабильными в различные сроки послеоперационного периода, что делает крайне затруднительной оценку необходимых потребностей расчетными методами. Учет послеоперационных белковых потерь проводят лишь единичные авторы[11].
Между тем компенсация потерь энергии и белка после перенесенного хирургического вмешательства, даже при условии сбалансированного лечебного питания, занимает длительный период времени, нередко превышающий продолжительность пребывания больного в ОРИТ[2, 3].
Цель представляемого исследования, выполненного в Университетской клинике ГКБ № 64 (главный врач — профессор О. В. Шарапова, руководитель клиники — профессор А. Е. Климов), заключалась в улучшении результатов хирургического лечения с использованием элементов FAST TRACK у больных колоректальным раком путем проведения целевой нутриционной терапии в предоперационном периоде.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование были включены 54 пациента с диагнозом «опухоль толстой кишки». Пациенты получили плановое радикальное хирургическое лечение в объеме гемиколэктомии или резекции сигмовидной кишки.
Критерии включения: верифицированный колоректальный рак в стадии Тi–2N0M0, возраст от 60 до 78 лет, отсутствие признаков кишечной непроходимости.
Критерии исключения: возраст более 78 лет, паллиативное хирургическое вмешательство, наличие признаков кишечной непроходимости, операционная кровопотеря более 500 мл, длительная постнаркозная седация и необходимость в продленной ИВЛ.
У всех пациентов при первичном анестезиологическом осмотре выявлены сопутствующие сердечно-сосудистые заболевания, у 10 больных возникла необходимость их предоперационной медикаментозной коррекции.
Группы исследования:
- группа А (п = 32): проспективная группа пациентов, оперированных за период с января 2015 г. по июнь 2015 г. Назначалась дополнительная нутриционная терапия в предоперационном периоде за 6 дней до вмешательства методом сиппинга: гипернитрогенная смесь 3 раза в день по 125 мл (Нутридринк Компакт Протеин, в 125 мл — 300 ккал и 18 г белка);
- группа В (п = 22): ретроспективная группа пациентов, оперированных за период с июня 2014 г. по январь 2015 г. Предоперационная коррекция нутритивного статуса не проводилась.
Пациенты обеих групп получали послеоперационную нутритивно-метаболическую терапию согласно энергопотребностям, измеренным методом непрямой калориметрии. Количество белка в питательных смесях определяли по уровню азота, потерянного с суточной мочой. Различий по объему хирургического вмешательства между группами не наблюдалось. Кровопотеря в ходе хирургического вмешательства составляла около 500 мл.
ПС пациентов оценивали с помощью балльной шкалы: за норму показателя принимали 3 балла, за отклонение от нормы легкой степени — 2 балла, средней степени — 1 балл, тяжелой степени — 0 баллов[2, 4]. Учитывали антропометрические показатели: ИМТ, окружность плеча (ОП), толщину кожно-жировой складки трицепса (ТКЖСт) и окружность мышц плеча (ОМП), — а также определяли лабораторные данные: общий белок плазмы крови, альбумин, трансферрин и абсолютное число лимфоцитов. Степень питательной недостаточности оценивали по сумме баллов (табл. 1).
Таблица 1
Нутритивный статус пациентов
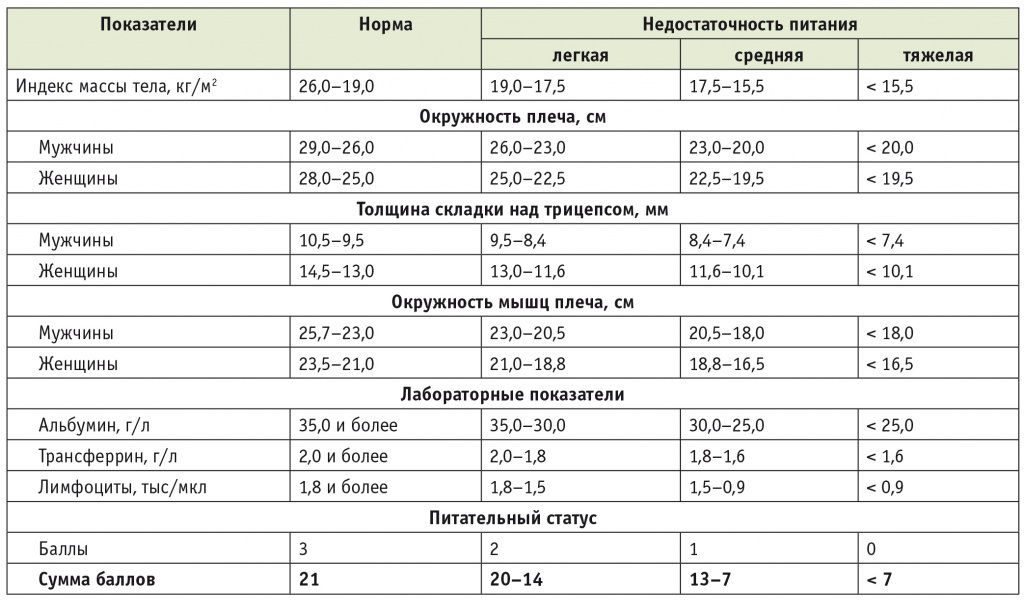
ОМП (характеризующую соматический пул белка) рассчитывали по формуле:
ОМП (в см) = ОП (в см) – 0,314 × ТКЖСт (в мм).
ТКЖСт (являющуюся интегральным показателем состояния жирового депо организма) измеряли с помощью калипера.
Исследовали суточную экскрецию мочевины с мочой с последующим расчетом азота мочи по общепринятой методике для оценки потерь азота организмом. Сбор мочи проводили в течение 24 часов. При планировании нутритивной терапии учитывали данные ежедневного измерения энергопотребностей методом непрямой калориметрии.
ПС и содержание азота в моче определяли за 6 дней и за сутки до операции, на 1-е и 7-е сутки после операции.
При анализе эффективности предложенной схемы нутриционной поддержки учитывались частота послеоперационных осложнений, длительность пребывания в ОРИТ и длительность пребывания в стационаре после операции.
Статистическую обработку данных осуществляли при помощи программы SPSS Statistics версии 21. Проводили анализ сравнения средних по Т-критерию для независимых выборок, анализ сравнения между группами по критерию Манна — Уитни (U-test).
РЕЗУЛЬТАТЫ
Анализ ПС за 6 дней до операции показал, что почти у половины пациентов обеих групп — у 15 (46,9%) пациентов в группе A и 10 (45,5%) в группе B — нарушения ПС отсутствовали.
Распределение остальных больных в исследуемых группах по степени нарушения ПС представлено в таблице 2: недостаточность питания легкой степени выявлена у 28,1% пациентов группы А и 22,7% пациентов группы В, средней степени — у 18,8% и 22,7% больных соответственно; питательная недостаточность тяжелой степени наблюдалась у 6,2% пациентов группы А и также у 9,1% пациентов группы В. Различия между группами не имели статистической значимости (p > 0,05, U-test Манна — Уитни).
Таблица 2
Изменение питательного статуса на различных этапах лечения и наблюдения
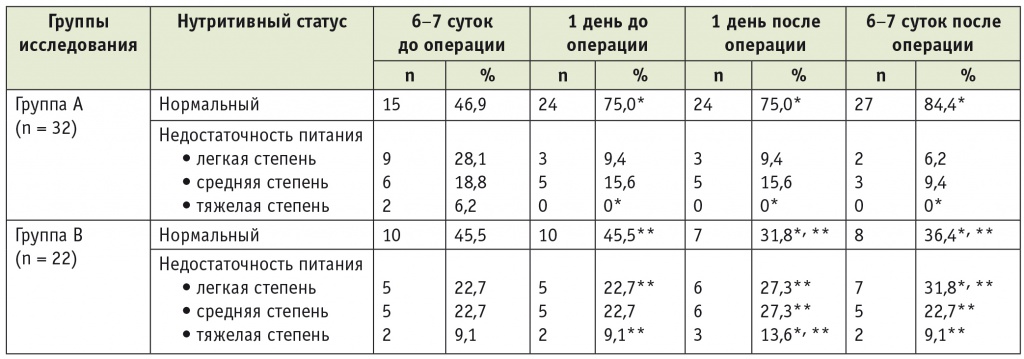
* P < 0,05 при сравнении с исходными данными — за 6 дней до операции.
** Различия с группой A статистически значимы (p < 0,05, U-test Манна — Уитни).
За сутки до хирургического вмешательства после предоперационной гипернитрогенной нутриционной терапии методом сиппинга у 9 (28,1%) пациентов группы А было отмечено улучшение ПС: доля больных с нормальным ПС возросла до 24 (75,0%) пациентов, статистически значимо по сравнению с исходными данными (p < 0,05).
Важно отметить, что с помощью предоперационной подготовки гипернитрогенными смесями удалось компенсировать и подготовить к операции больных (двух человек) с тяжелой степенью недостаточности питания. Послеоперационный период у них протекал благоприятно.
У пациентов группы В перед операцией ПС не изменился относительно данных исходного скрининга. В послеоперационном периоде ожидаемых ухудшений ПС у пациентов группы А не наблюдалось, тогда как в группе В при том же режиме послеоперационной нутриционной терапии выявлено статистически значимое ухудшение ПС: возросла доля больных с тяжелой степенью питательной недостаточности (см. табл. 2).
При первичном питательном скрининге за 6 дней до операции потери азота в суточной моче у больных группы А и группы В составили 6,6 и 5,9 г/сут соответственно. Различия между группами не были статистически значимыми (p > 0,05). За сутки до операции в группе А выявлено значимое снижение уровня потерянного азота по сравнению с исходным значением — до 4,8 г/сут (p < 0,05). В группе В потери азота в суточной моче практически не изменились и составили 6,7 г/сут.
В послеоперационном периоде в группе В наблюдалось значимое повышение уровня потерянного азота относительно исходного показателя — до 11,6 г/сут (p < 0,05), — тогда как в группе А суточные потери азота не увеличились (табл. 3). Статистически значимые различия между группами очевидны (p < 0,05). Предоперационная гипернитрогенная диета позволила уменьшить процесс гиперкатаболизма у больных группы А.
Таблица 3
Потери азота с мочой, г/сут
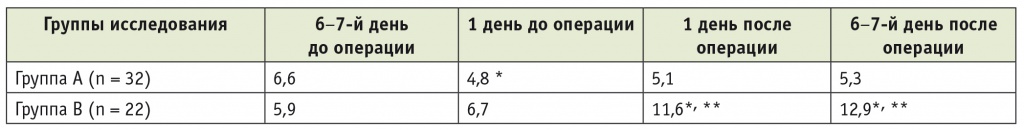
* P < 0,05 при сравнении с исходными данными — за 6 дней до операции.
** Различия с группой A статистически значимы (p < 0,05, U-test Манна — Уитни).
Анализ течения раннего послеоперационного периода показал, что когнитивные послеоперационные нарушения в 1-е сутки в группе А развились лишь у 2 (6,2%) больных, тогда как в группе В — у 6 (27,3%) пациентов, различия статистически значимы (p < 0,05).
Респираторные осложнения, требовавшие продленной ИВЛ, отмечены только у 2 больных в группе В. Несостоятельность межкишечного анастомоза на 3–5-е сутки диагностирована также у 2 больных группы В. При исходном скрининге у данных пациентов отмечена недостаточность питания средней и тяжелой степени.
Все осложнения послеоперационного периода явились основанием для более длительного пребывания в ОРИТ больных группы В: все пациенты этой группы требовали 48-часового наблюдения, тогда как в группе А треть пациентов была переведена в профильную палату уже по истечении 24 часов после операции; 62% больных группы В наблюдались 72 часа, в то время как в группе А таких больных было всего 5%; наконец, на 3-и сутки все пациенты группы А были переведены из ОРИТ, а в группе В 40% больных наблюдались 4 суток и 10% — 5 суток.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
У больных онкологическим заболеванием имеется более высокий риск развития питательной недостаточности, чем у больных общехирургического профиля, что требует особого внимания к методам нутриционной терапии в периоперационном периоде[12]. Однако в современной мировой клинической практике это не является препятствием к применению методики Fast Track. В протоколах ERAS рекомендуется проведение раннего энтерального питания у больных колоректальным раком, так как при современных методах хирургической техники не предполагается послеоперационной кишечной дисфункции[7]. В то же время полностью избежать проявлений кишечной недостаточности в послеоперационном периоде после резекции кишки удается крайне редко. Поэтому в первые сутки после операции больной не может полноценно усвоить весь необходимый объем энтеральной смеси, что может отрицательно сказываться на течении послеоперационного восстановления у больных с исходными проявлениями питательной недостаточности.
В данной ситуации предоперационная нутриционная терапия у больных колоректальным раком играет ключевую роль в уменьшении процессов гиперкатаболизма и гиперметаболизма, характерных для пациентов с онкологическими заболеваниями. Уменьшение потерь азота с мочой перед операцией является достоверным прогностическим признаком благоприятного течения послеоперационного периода.
ЗАКЛЮЧЕНИЕ
Предоперационная гипернитрогенная нутриционная терапия позволяет избежать ухудшения питательного статуса в послеоперационном периоде за счет снижения явлений гиперкатаболизма.
Своевременное введение программ нутриционной терапии у больных с высоким риском развития питательной недостаточности дает возможность улучшить результаты лечения больных колоректальным раком по программе Fast Track.








