Наиболее сложной задачей в улучшении качества
хирургической помощи являются не новые открытия,
а внедрение уже имеющихся данных в практику.
Д. Урбач, Н. Бакстер (1994)
В связи с этим остро стоит вопрос об интенсификации не только диагностического, но и лечебного процесса у данной категории больных, о сокращении сроков лечения, быстрой реабилитации. В настоящее время в мире широкое распространение получил мультимодальный подход к профилактике послеоперационных осложнений в различных областях хирургии и онкологии. Одной из методик, способных улучшить результаты лечения при одновременном сокращении расходов, является ускоренное восстановление после хирургических операций (англ. Enhanced Recovery After Surgery — ERAS), или «быстрый путь» (англ. Fast Track) [1]. Основными целями ERAS являются максимальное снижение частоты и выраженности последствий операционной травмы, борьба с негативными явлениями послеоперационного периода, сокращение числа осложнений, уменьшение сроков госпитализации и реабилитации пациентов [2]. Эту методику в 1997 г. выдвинул датский анестезиолог Henrik Kehlet [3]. Концепция ERAS была впервые предложена и получила наибольшее распространение в колоректальной хирургии, что привело к публикации в 2009 г. первого консенсуса по ее применению в данной области [4].
Актуальность проблемы рака толстого кишечника обусловлена высокими показателями частоты развития (третье место в общей структуре онкозаболеваемости) и летальности (пятое место среди онкологических болезней) [5]. Рак толстого кишечника может возникать в любом возрасте, однако чаще всего его обнаруживают в старших возрастных группах (у лиц 60–69 лет и 70–79 лет — 28% и 18% соответственно). Это заболевание вдвое чаще поражает мужчин, чем женщин, а наиболее распространенными локализациями опухоли являются сигмовидная (25–30%) и прямая кишка (до 40%) [6]. В современной литературе приведено достаточно много доказательств эффективности программы ERAS в плановом хирургическом лечении рака толстого кишечника, в том числе у больных пожилого и старческого возраста [7, 8].
Применение программы ERAS признано безопасным и эффективным, но небольшое количество опубликованных исследований пока не позволяет считать ее стандартом лечения рака толстого кишечника [4]. Наши наблюдения показывают, что перенос подходов зарубежных коллег к лечению рака толстого кишечника в рамках технологии ERAS на модель отечественного здравоохранения без соответствующего опыта организации мультимодального протокола является преждевременным и нецелесообразным.
В России наиболее важными моментами с точки зрения оптимизации хирургического лечения рака толстого кишечника стали создание междисциплинарного научного хирургического общества «ФАСТ ТРАК» при Российском обществе хирургов и принятие на XIX съезде Общества эндоскопических хирургов России (Москва, 16–18 февраля 2016 г.) клинических рекомендаций по внедрению программы ускоренного выздоровления пациентов после плановых хирургических вмешательств на ободочной кишке. Однако наиболее рациональная и эффективная тактика хирургического лечения пациентов с раком толстого кишечника пока четко не определена.
Целью настоящей работы явилась оценка эффективности применения протокола ERAS у пациентов с хирургическим вмешательством по поводу рака толстого кишечника.
МАТЕРИАЛЫ И МЕТОДЫ
В хирургическом отделении Федерального научноклинического центра специализированных видов медицинской помощи и медицинских технологий ФМБА России (далее — ФГБУ ФНКЦ ФМБА России) с 2010 по 2016 г. в плановом порядке оперированы 98 пациентов с колоректальным раком. Всем этим пациентам в зависимости от локализации опухоли (слепая, сигмовидная кишка, восходящий отдел ободочной кишки) выполнены радикальные операции: правосторонняя гемиколэктомия или резекция сигмовидной кишки с наложением первичного межкишечного анастомоза.
Для объективного анализа результатов хирургического лечения все больные с учетом возраста, пола, локализации и стадии онкологического заболевания, сопутствующих заболеваний, протокола ведения были распределены на две группы: основную (n = 37) и группу сравнения (n = 61).
Критериями включения в исследование явились: возраст от 30 до 80 лет; локализации опухоли — слепая, восходящая ободочная или сигмовидная кишка; стадии заболевания от T2N0M0 до T3N2M0; не более двух превалирующих интеркуррентных заболеваний; выполнение операции традиционным открытым способом (лапаротомия) или лапароскопическим доступом без выведения колостом.
Критериями исключения из исследования были: несоответствие возрастным параметрам (моложе 30 и старше 80) и стадиям заболевания (Т1 и Т4, М1); другая локализация опухоли; более двух превалирующих интеркуррентных заболеваний; наложение превентивной колостомы или обструктивный объем операции; выполнение сочетанных, комбинированных операций; IV класс физического статуса по шкале ASA.
Основные параметры характеристики пациентов представлены в таблице 1.
Таблица 1
Общая характеристика пациентов исследованных групп
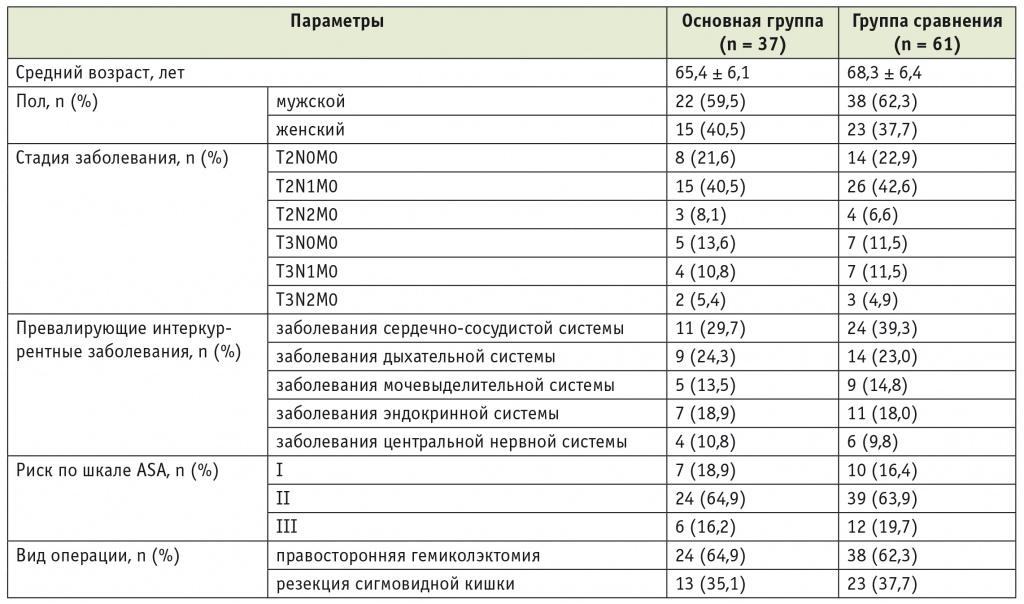
Примечания.
1. ASA — American Society of Anesthesiologists (Американское общество анестезиологов).
2. По всем представленным параметрам различия между группами не имеют статистической значимости: p > 0,05.
В основной группе использовали адаптированный к условиям и возможностям ФГБУ ФНКЦ ФМБА России протокол ERAS, включавший в себя три этапа.
Дооперационный этап:
1) подробное информирование пациента об особенностях лечения;
2) отказ от механической очистки кишечника;
3) применение пробиотиков (хилак форте; бифидобактерии лонгум + энтерококкус фэциум; бифидобактерии бифидум) и прокинетики (итоприд) в течение 3–5 дней до операции;
4) отказ от предоперационного голодания с разрешением употреблять углеводные смеси для энтерального питания и высококалорийные жидкости до позднего вечера накануне операции;
5) профилактика венозных тромбоэмболических осложнений (адекватный режим регидратации, эластическая компрессия нижних конечностей, введение эноксапарина натрия по 40 мг за 12 часов до операции);
6) антибактериальная профилактика путем проведения селективной деконтаминации с включением пероральной формы препаратов в день, предшествовавший операции, и внутривенное введение разовой дозы цефалоспоринов III поколения за 30 минут до разреза.
Операционный этап:
1) выполнение операции лапароскопическим способом (правосторонняя гемиколэктомия или резекция сигмовидной кишки с лимфодиссекцией в стандартном объеме — D2) и формирование межкишечных анастомозов механическим швом;
2) удаление назогастрального зонда перед экстубацией пациента;
3) ограничительный режим инфузии жидкости — до 5 мл/кг/ч;
4) инфузия подогретых растворов, применение согревающих одеял с целью недопущения интраоперационной гипотермии;
5) отказ от рутинного дренирования брюшной полости.
Послеоперационный период:
1) подача насыщенного кислорода в течение 2 часов после операции;
2) начало приема больными жидкости через рот в конце первых суток после операции, изокалорических энтеральных смесей — через 36 часов;
3) прекращение инфузионной терапии через 2 суток после операции;
4) использование для обезболивания эпидурального катетера, инъекций кеторолака по требованию, отказ от наркотических препаратов;
5) раннее удаление центрального венозного, уретрального катетера;
6) ранняя активизация пациентов (сидячее положение к концу первых суток после операции, палатный режим — со вторых суток);
7) активное использование физиотерапии, ЛФК.
В группе сравнения больным под эндотрахеальным наркозом была выполнена открытая операция: лапаротомия, правосторонняя гемиколэктомия или резекция сигмовидной кишки с лимфодиссекцией в стандартном объеме (D2), что зависело от локализации опухоли. Все операции были завершены наложением первичного анастомоза с помощью ручного или механического шва. Дренирование брюшной полости осуществляли одним дренажом на срок от 1 до 3 суток после операции. Зонд в желудке для декомпрессии оставляли после операции на одни сутки. Питание и начало активизации больных проводили с третьих суток после операции, на фоне инфузионной терапии. При выраженном болевом синдроме, помимо ненаркотических анальгетических средств, применяли инъекции наркотических препаратов (тримеперидин, морфин). Антибиотикотерапия включала в себя внутримышечное введение цефалоспоринов III поколения на протяжении 5 суток после операции. Профилактика венозных тромбоэмболических осложнений не отличалась от таковой в основной группе.
В процессе исследования анализировали длительность операции, объем интраоперационной кровопотери, количество интра и послеоперационных осложнений, выраженность болевого синдрома, сроки появления перистальтики кишечника и первого самостоятельного стула после операции, сроки начала активизации пациентов, длительность периода госпитализации.
Для оценки результатов исследования использовали интегрированную систему для комплексного статистического анализа и обработки данных в среде Windows (STATISTICA 6.1, StatSoft Inc., США). С целью выявления статистически значимых различий между средними величинами показателей независимых выборок применяли как параметрический критерий Стьюдента, так и непараметрический критерий Манна — Уитни. Корреляционный анализ проводили с использованием коэффициента корреляции Пирсона. Критический уровень значимости принимали равным 0,05.
РЕЗУЛЬТАТЫ
Летальных исходов среди пациентов обеих групп не было. Основные результаты проведенного исследования представлены в таблице 2.
Таблица 2
Результаты лечения пациентов исследованных групп
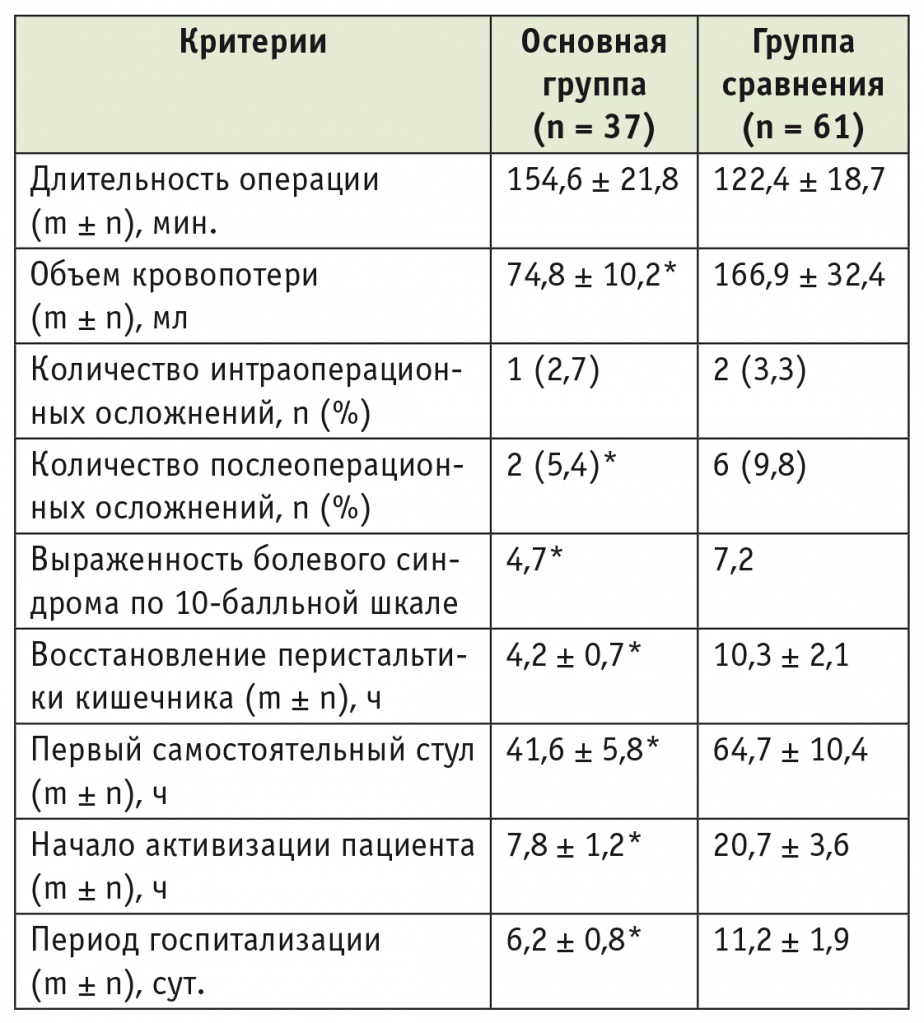
* Различия с группой сравнения статистически значимы: p < 0,05.
Как видно из таблицы 2, по длительности операции и количеству интраоперационных осложнений статистически значимых различий между пациентами основной группы и группы сравнения не наблюдалось. Это свидетельствует о хорошей отработке обоих вариантов выполнения оперативного вмешательства и надежности хирургической техники исполнения операций. В то же время объем кровопотери у пациентов основной группы, оперированных лапароскопическим способом, был достоверно меньше, чем при открытом оперативном вмешательстве, что можно объяснить большей прецизионностью лапароскопического способа, лучшей визуализацией и увеличением операционного поля при лапароскопии.
К послеоперационным осложнениям были отнесены осложнения, возникшие в период госпитализации пациентов после операции. В основной группе больных наблюдали всего два общих послеоперационных осложнения: тахиаритмию и сердечную недостаточность, потребовавшую назначения бетаблокаторов, и нозокомиальную нижнедолевую пневмонию, купированную антибактериальной терапией. В группе сравнения отмечены шесть послеоперационных осложнений, из них три общих: послеоперационная пневмония, мерцательная аритмия, тромбоз глубоких вен голени, которые потребовали консервативного лечения. Из местных осложнений наблюдались острая тонкокишечная спаечная непроходимость (для устранения применены релапаротомия, разделение спаек, назоинтестинальная интубация на пятые сутки после операции), нагноение операционной раны и острый послеоперационный панкреатит, купированный медикаментозной терапией.
Выраженность болевого синдрома у пациентов основной группы была достоверно ниже, чем в группе сравнения. Мы связываем это с выполнением лапароскопических операций и использованием интраоперационно и в послеоперационном периоде пролонгированной эпидуральной анестезии. Снижение болевого синдрома напрямую влияло на начало активизации больных в послеоперационном периоде: пациентов присаживали уже в день операции с постепенным расширением режима до палатного к концу вторых суток после оперативного вмешательства.
В связи с отказом от механической подготовки кишечника к операции, а также ранним пероральным приемом жидкости и ранним приемом изокалорических смесей (к концу первых суток и через 36 часов после операции соответственно) у больных основной группы в более ранние сроки восстанавливалась перистальтика кишечника и возникал самостоятельный стул.
Благодаря тому что указанные особенности течения ближайшего послеоперационного периода в основной группе позволили быстрее начать активизацию пациентов, существенно снизилась продолжительность госпитализации: с 11,2 ± 1,9 до 6,2 ± 0,8 суток. При принятии решения о выписке пациента из стационара ориентировались на следующие условия: незначительная боль, купируемая применением пероральных анальгетиков; возможность приема твердой пищи; самостоятельный стул; отсутствие необходимости во внутривенном введении жидкости; возможность самостоятельного передвижения и самообслуживания, а также психологическая готовность пациента к выписке.
ОБСУЖДЕНИЕ
Медицина во многом консервативна, что вполне оправданно. Новые методы диагностики и лечения перед использованием в широкой клинической практике проходят длительные испытания. Со временем к ним привыкают, их не подвергают сомнению и длительное время не оспаривают. Так возникают постулаты, отказаться от которых непросто, и это является особенностью не только хирургии, так как новое всегда непривычно.
Поскольку большинство канонов в хирургии (оперативная техника, методы обезболивания, принципы предоперационной подготовки и послеоперационного ведения пациентов) сформировались еще в «доантибиотиковую» эру, то внедрение новых, минимально инвазивных, хирургических технологий в условиях современных медикоэкономических и медикосоциальных подходов в медицине потребовало решительного пересмотра сложившихся представлений. Этот период совпал с повсеместным внедрением принципов доказательной медицины в рамках Кокрейновского сотрудничества (Cochrane Collaboration, 1988–2013, Великобритания). Проведенные в 1990–2010 гг. многоцентровые мировые двойные слепые исследования по проверке методов подготовки пациентов к операциям, ставших незыблемыми стереотипами, выявили их неэффективность [6, 9]. Например, длительная предоперационная подготовка кишечника, обязательное применение назогастрального зонда и послеоперационных дренажей, длительный постельный режим, этапные диеты после операции при проведении многих хирургических вмешательств оказались бесполезными, а в ряде случаев — вредными [10–12].
Индивидуальный подбор методов анестезии и минимально инвазивных способов оперативного лечения, оптимальный контроль болевого синдрома и начала активного послеоперационного восстановления (раннее пероральное питание и мобилизация) значительно уменьшают выраженность стрессовых реакций организма и степень дисфункции органов и систем, статистически значимо сокращают время, необходимое для полного восстановления пациента [13, 14].
Авторская концепция ERAS основана на сочетании тщательно интегрированных в мультимодальную реабилитационную стратегию научно обоснованных принципов пред, интра,послеоперационного ведения больных, базирующихся на современных минимально инвазивных хирургических технологиях и принципах ранней реабилитации пациентов [3, 15].
Подавляющее большинство пунктов программы ERAS имеют высокую степень достоверности с позиций доказательной медицины [2] (табл. 3).
Таблица 3
Степень достоверности эффективности компонентов ERAS (по данным [2])
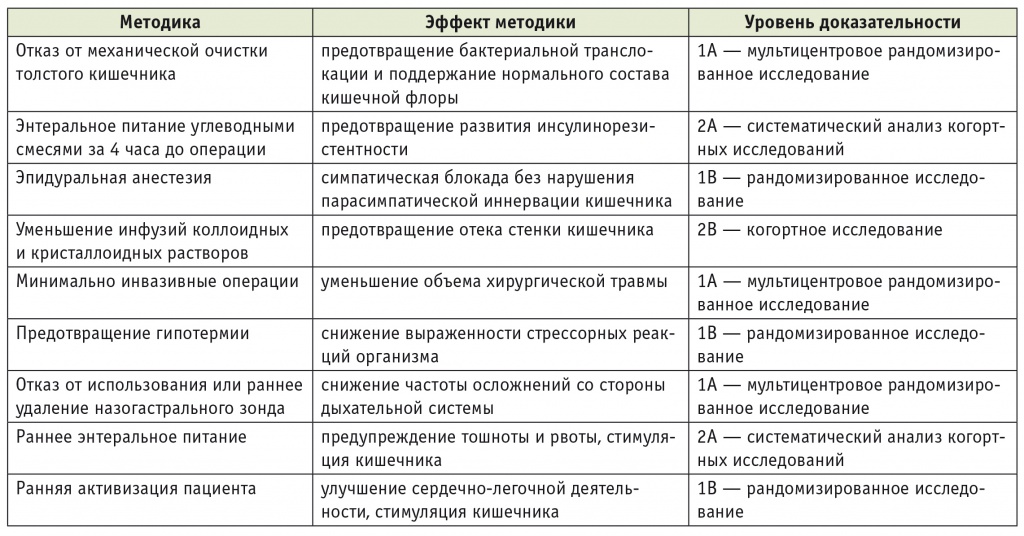
Полученные нами результаты подтверждают данные других авторов об эффективности применения мультимодальной программы ERAS у больных, оперируемых по поводу рака толстого кишечника [10]. В нашем исследовании средняя частота воспроизводимости компонентов протокола ERAS составила 84% (от 62% до 100%). Одним из нерешенных вопросов применения протокола ERAS является недостаточно эффективный контроль за режимом гидратации, что в основном обусловлено техническими сложностями его выполнения и может приводить к возникновению динамической кишечной непроходимости. На наш взгляд, проблематично сокращение послеоперационного периода до срока менее 6 дней без обеспечения необходимых условий: пролонгированной эпидуральной анестезии, лапароскопической хирургии, патронажа квалифицированным медицинским персоналом на дому после выписки из стационара.
Новая концепция обезболивания в протоколе ERAS требует помимо общего наркоза применять эпидуральную анестезию. Этот метод позволяет пациентам быстрее проснуться после операции, дает возможность снизить дозировку сильных болеутоляющих средств, которые, кроме выраженной усталости, вызывают снижение активности кишечника, а также тошноту и рвоту. Применение эпидуральной анестезии сопровождается улучшением функций легких, снижением нагрузки на сердечнососудистую систему, меньшей выраженностью пареза кишечника [13].
В рамках доказательной медицины установлено, что дооперационное голодание существенно снижает резервы гликогена в печени и вызывает послеоперационную устойчивость к инсулину. Результатом этого является уменьшение восстановительных ресурсов организма [16].
Минимально инвазивная хирургия подразумевает снижение боли и сокращение сроков пребывания в стационаре по сравнению с таковыми при открытых методиках. Оптимизированная инфузионная терапия во время операции предполагает предупреждение интраоперационной гиповолемии и чрезмерной инфузии кристаллоидов, которые могут привести к отекам мягких тканей тела, ухудшению оксигенации тканей.
Ускоренная мобилизация предполагает раннюю способность к передвижению (по крайней мере 6 часов вне кровати на следующий день после операции). Постельный режим усугубляет потерю мышечной массы и слабость, ухудшает легочные функции, предрасполагает к венозному застою и тромбоэмболии, а также способствует послеоперационному образованию спаек [17].
В основе раннего кормления пациентов после операции лежат результаты современных исследований, показавших, что кишечник функционирует круглосуточно, при любом состоянии организма; при исчезновении из кишечника основного субстрата его работы он парализуется и не выполняет свою функцию, что способствует развитию динамической кишечной непроходимости [18].
Результаты зарубежных исследователей по внедрению программы ERAS при плановых операциях в колоректальной хирургии показали и экономическую обоснованность такого подхода. Так, в США уменьшение количества внутривенных инфузий, снижение частоты осложнений и сокращение длительности госпитализации позволили уменьшить стоимость лечения одного пациента примерно на 5700 долларов, по сравнению с аналогичным показателем в группе пациентов, пролеченных до внедрения этой программы. С точки зрения экономики здравоохранения уменьшение частоты осложнений и длительности госпитализации при применении программы ERAS сопровождается значительно меньшей стоимостью лечения, чем при использовании стандартного подхода.
Следует отметить, что трудности распространения программы ERAS аналогичны таковым при внедрении в повседневную практику клинических рекомендаций во всех областях медицины. Они связаны с плохой осведомленностью о результатах доказательной медицины, неприятием их или недостаточной уверенностью в возможности применения принципов Fast Track в конкретной клинике.
Выводы
1. Применение системы ERAS у пациентов с колоректальном раком оправданно, обоснованно и эффективно.
2. Использование программы ERAS при хирургическом лечении больных раком толстого кишечника позволяет достоверно улучшить результаты лечения, сократить сроки госпитализации, ускорить период реабилитации при одновременном сокращении финансовых расходов.
3. При условии осуществления определенных организационных мер и освоения основных принципов мультидисциплинарного подхода к решению данной проблемы, применение программы ERAS у больных колоректальным раком может быть рекомендовано и внедрено в широкую клиническую практику хирургических и онкологических стационаров.
ЗАКЛЮЧЕНИЕ
Программа быстрого восстановления после хирургических операций (ERAS) базируется на патофизиологических принципах, основным из которых является принцип редукции стрессорного ответа организма на хирургическую травму.
Внедрение в клиническую практику методики ERAS не только имеет положительные медицинские последствия (улучшение ближайших и отдаленных результатов лечения), но и важно в социальноэкономическом аспекте.
В настоящий момент практически ни у кого не вызывает сомнений необходимость широкого внедрения методики Fast Track в клиническую практику. На наш взгляд, единственным препятствием к этому является чрезмерный консерватизм — сохраняющееся нежелание врачей отходить от традиций и менять установившиеся подходы к лечению.








