Мультимодальная программа ранней реабилитации пациентов после хирургических вмешательств (англ. Enhanced Recovery After Surgery — ERAS) впервые была предложена в 90-е годы прошлого века датским исследователем H. Kehlet [7]. Наибольшее развитие и успех она получила при хирургическом лечении колоректального рака, а затем была применена в кардиохирургической практике среди пациентов, которым проводили рентгенохирургическое стентирование коронарных артерий и аортокоронарное шунтирование. Впоследствии были разработаны протоколы ERAS, которые показали хорошие результаты в ортопедии, гинекологии и общехирургической практике.
По определению профессора H. Kehlet, программа ERAS «…предусматривает применение эпидуральной или регионарной анестезии, мини-инвазивных оперативных вмешательств и техники агрессивной послеоперационной реабилитации, включающих раннее энтеральное питание и раннюю активизацию. В комбинации эти меры позволяют снизить стрессовые реакции организма и значительно сократить время, необходимое для полного восстановления» [7]. То есть в основе любого протокола ERAS лежит попытка повлиять на стресс, вызванный хирургической травмой, посредством коррекции тех изменений гомеостаза, которые произошли для приспособления организма к изменившимся условиям окружающей среды.
Углубленное изучение патофизиологических механизмов, лежащих в основе послеоперационных осложнений, дало возможность более дифференцированно и эффективно влиять на отдельные компоненты патогенеза, такие как боль, тошнота и рвота, нарушения сна, вызванные динамическим парезом кишечника, гипоксией, голоданием, иммобилизацией, а также длительным наличием в организме инородных тел (дренажей, катетеров, зондов) [1].
Продолжительность послеоперационного периода у пациентов, которым выполняются операции по поводу злокачественных новообразований органов брюшной или грудной полости, обычно составляет от 14 до 21 суток, а осложнения в послеоперационном периоде возникают даже при технически удачном выполнении оперативных вмешательств. В последние годы развитие эндовидеохирургических технологий и появление новых лекарственных средств позволили повысить эффективность оперативного лечения за счет минимизации операционной травмы и ранней реабилитации пациентов.
В литературе последних лет представлено много данных, свидетельствующих о преимуществах использования программы ERAS. Так, пациенты, лечение которых проведено по протоколам ранней реабилитации, значительно реже страдают послеоперационными осложнениями III и IV степени по классификации Клавьена — Диндо [12]. Многоцентровое исследование влияния программы ERAS на результаты хирургического лечения у онкологических пациентов пожилого возраста ACERTO показало, что по сравнению с контролем в группе ERAS в 7 раз снижается уровень инфекционных осложнений (19,0% и 2,7% соответственно) и достоверно сокращаются сроки госпитализации (6 и 2 суток соответственно; р = 0,002), это позволило авторам сделать вывод о целесообразности ее применения у данной категории больных [1]. Кроме того, у пациентов, проходящих лечение по программе ранней реабилитации, выявлены более раннее восстановление функции кишечника и более комфортное течение послеоперационного периода по сравнению с пациентами, лечащимися по традиционной схеме [13].
Таким образом, проведенный анализ показал, что применение технологий ERAS даже после обширных и травматичных онкологических вмешательств должно способствовать снижению частоты осложнений, длительности госпитализации, а следовательно, значительному повышению безопасности и комфортности периоперационного периода и сокращению суммарных затрат на лечение. В своей работе мы попробовали оценить результаты использования протокола ERAS в сравнении с традиционным подходом.
Цель исследования: оценка эффективности и безопасности использования протокола ERAS у больных раком желудка.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование вошли 80 пациентов в возрасте от 43 до 83 лет (средний возраст — 64,10 ± 7,65 года), среди них было 40 мужчин и 40 женщин. Всем пациентам выполнялись обширные оперативные вмешательства по поводу злокачественных новообразований желудка в условиях Московского научно-исследовательского онкологического института им. П. А. Герцена (далее — МНИОИ им. П. А. Герцена, генеральный директор — член-корреспондент РАН, профессор А. Д. Каприн) в период с 2013 по 2015 г.
По шкале физического статуса Американского общества анестезиологов (англ. American Society of Anesthesiologists — ASA) большинство больных относились ко II‒III классам (табл. 1), т. е. имели значительные функциональные нарушения, в первую очередь за счет наличия сопутствующей сердечно-сосудистой патологии.
Таблица 1
Распределение больных по шкале физического статуса Американского общества анестезиологов (англ. American Society of Anesthesiologists — ASA), абс. (%)
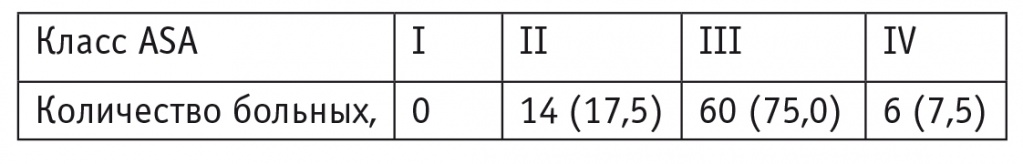
В процессе обследования у больных был диагностирован рак желудка, преимущественно III стадии, по поводу чего выполнялась гастрэктомия с лимфаденэктомией D2 чрезбрюшинным доступом. При расширении ранее запланированного объема вмешательства пациенты в исследование не включались. Длительность оперативных вмешательств составила в среднем 5,43 ± 1,35 часа, средняя кровопотеря — 540 ± 36,4 мл.
Внедрение протокола ERAS для пациентов, подлежащих обширным оперативным вмешательствам на органах брюшной полости, началось в МНИОИ им. П. А. Герцена в январе 2014 г. Таким образом, 40 пациентов, проведенных по протоколу ERAS после января 2014 г., вошли в одноименную основную группу. За 2013 г. были отобраны 40 больных, чьи ретроспективные данные были максимально доступны для анализа. Эти пациенты составили контрольную группу. Все 80 пациентов были прооперированы разным составом операционных бригад, но при участии одних и тех же оперирующего хирурга и анестезиолога. Подготовка кишечника перед операцией в группах не различалась.
Индукция анестезии была стандартизована и проводилась пропофолом (1,56 ± 0,31 мг/кг), кетамином (25‒50 мг), фентанилом (0,002 ± 0,001 мг/кг). Миорелаксация обеспечивалась рокурония бромидом в дозе 0,68 ± 0,14 мг/кг. Всем пациентам выполняли сочетанную эпидуральную (смесь Брейвика — Ниеми) и общую анестезию на основе севофлурана с добавлением на наиболее травматичных этапах опиоидного анальгетика фентанила. Пункцию и катетеризацию эпидурального пространства осуществляли на уровне Th7‒Th8, катетер проводили краниально на 3‒4 см. После фиксации катетера начиналась перманентная инфузия раствора местного анестетика (ропивакаин 0,375%, фентанил 4 мкг/мл, адреналин 2 мкг/мл) при насыщающей скорости 15‒20 мл/ч (до 10 мл) с переходом на поддерживающую скорость инфузии 4‒8 мл/ч под контролем гемодинамики. Ингаляцию севофлурана осуществляли с момента интубации трахеи до окончания оперативного вмешательства, средняя концентрация севофлурана составила 0,7 ± 0,1 МАК. Фентанил вводили внутривенно болюсно по 0,05‒0,1 мг на наиболее травматичных этапах операции в средней дозе 0,0004 ± 0,00002 мг/кг/ч. Пациентам обеих групп выполняли антибиотикопрофилактику (амоксициллин + клавулановая кислота по 1,2 г внутривенно перед кожным разрезом и через 3 часа после первой дозы) и тромбопрофилактику (низкомолекулярные гепарины за 12 часов до операции, компрессионный трикотаж). В обеих группах пациенты в послеоперационном периоде получали аналоги соматостатина с целью профилактики послеоперационного панкреатита. Послеоперационное обезболивание в группах было стандартным и включало эпидуральную анальгезию (ропивакаин 0,2% со скоростью 4‒10 мл/ч), НПВП (лорноксикам), парацетамол, нефопам, опиоидные анальгетики (морфин по требованию).
Пациенты группы ранней реабилитации после хирургических вмешательств
Предоперационная подготовка. Прием готовых энтеральных смесей по 400‒600 мл/сут (2 ккал/мл, 800‒1200 ккал/сут, 7‒14 суток) начиная с поликлинического этапа. При наличии декомпенсированного стеноза антрального отдела желудка — частичное или полное парентеральное питание с учетом энергетических потребностей. Прием жидкости, богатой глюкозой, накануне вечером и за 2 часа до операции.
Интраоперационно. Поддержание целевой температуры тела не ниже 36 °C. Инфузионная терапия с целью поддержания нормоволемии и физиологических потребностей пациента, при необходимости компенсация пареза сосудистого русла невысокими дозами вазопрессоров. Дренирование брюшной полости одним дренажом малого диаметра, установленным через винслово отверстие в зону лимфодиссекции. Установка назоеюнального зонда дистальнее анастомозов. Контроль глубины анестезии с помощью ЭЭГ-энтропии (40‒60 ЕД).
Послеоперационный период. Поддержание нормотермии. Сразу после операции введение в зонд растворов электролитов и препаратов глутамина (400‒500 мл) со скоростью 30 мл/ч. В 1-е сутки зондовое питание — 400 мл изокалорической смеси (Пептамен, Nestle, Швейцария) 30 мл/ч + парентеральное питание до общей калорийности 1800‒2000 ккал. На 2-е сутки 800 мл изокалорической смеси (Пептамен, Nestle, Швейцария) по 50 мл/ч + парентеральное питание до общей калорийности 1800‒2000 ккал. На 3‒4-е сутки 1200 мл смеси по 70 мл/ч + электролиты. На 5-е сутки (контроль анастомоза) стол 0 + сиппинг + электролиты, далее расширение диеты (стол 1) и отмена инфузионной терапии. С 6‒7-х суток пероральное питание в полном объеме + сиппинг (Импакт Орал, Nestle, Швейцария). Ранняя активизация пациентов: присаживание в постели с бандажом в первый вечер после операции, ЛФК (занятия с инструктором), постановка на ноги в течение 1-х суток после операции с обязательным предшествующим ультразвуковым контролем состояния вен нижних конечностей. Попытки отказа от мочевого катетера с 1-х суток после операции. Удаление дренажа на 1‒3-и сутки при отсутствии обильного (более 500 мл) отделяемого. Максимально ранняя психологическая реабилитация пациентов: обычные гигиенические процедуры, художественная литература, периодическая пресса, общение с родными.
Пациенты группы контроля
Предоперационная подготовка. Предоперационная нутритивная подготовка не выполнялась.
Интраоперационно. Не выполнялся контроль температуры тела и не использовались системы обогрева. Коррекция эпизодов относительной гиповолемии осуществлялась волемической нагрузкой, контроль глубины анестезии — по МАК. Установка зонда с целью декомпрессии. Дренирование брюшной полости двумя двухпросветными дренажами.
Послеоперационный период. Не выполнялся постоянный контроль температуры тела и не использовались системы обогрева. Зонд применялся только для декомпрессии. До 5-х суток проводилось парентеральное питание, на 5-е сутки (контроль анастомоза) стол 0, далее расширение диеты (стол 1) и отмена инфузионной терапии. С 6‒7-х суток пероральное питание в полном объеме. Активизация пациентов: начало активизации со 2-х или 3-х суток, после перевода в профильное отделение; удаление дренажа на 5‒6-е сутки после контроля анастомоза. Обычный режим пребывания в ОРИТ.
Интраоперационно осуществлялся стандартный мониторинг показателей гемодинамики (AД, ЧСС, насыщение гемоглобина артериальной крови кислородом, ЭКГ, температура тела), уровня анестезии (ЭЭГ-энтропия), нейромышечной проводимости (TOF-watch). Для объективизации клинической значимости болевого синдрома использовалась 100-миллиметровая визуально-аналоговая шкала (ВАШ).
Статистическую обработку данных проводили с помощью программы Statistica 6.0 for Windows (StatSoft Inc., США). Статистическую значимость разницы относительных величин оценивали с помощью критерия χ2, абсолютных величин — с помощью U-критерия Манна — Уитни. Различия считали статистически значимыми при p < 0,05.
РЕЗУЛЬТАТЫ
Все пациенты в основной и контрольной группах были экстубированы в операционной по окончании хирургических вмешательств. Как видно из таблицы 2, пациенты группы ERAS продемонстрировали сокращение сроков пребывания в ОРИТ и госпитализации в целом относительно контрольных значений (p = 0,02 и p = 0,0001 соответственно).
Таблица 2
Эффективность и безопасность лечения больных раком желудка с использованием протокола ранней реабилитации после хирургических вмешательств (группа ERAS) и без его применения (контроль)
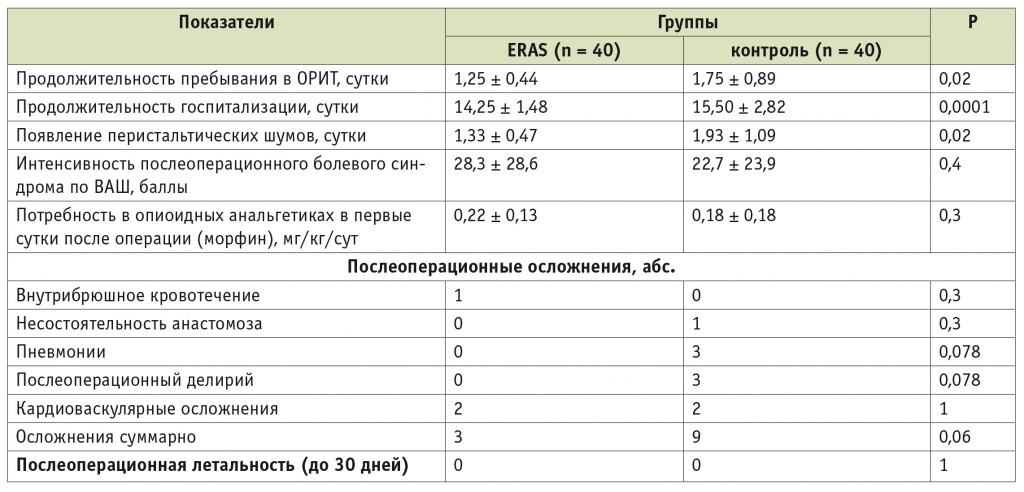
Примечание. ВАШ — визуально-аналоговая шкала; ОРИТ — отделение реанимации и интенсивной терапии.
В группе ERAS также было отмечено более раннее появление перистальтических кишечных шумов (р = 0,02). Интенсивность послеоперационного болевого синдрома и потребность в опиоидных анальгетиках в 1-е сутки не различались в выделенных группах, несмотря на использование методик ранней активизации в группе ERAS. В послеоперационный период в группе ERAS у одного пациента развилось внутрибрюшное кровотечение. Были выполнены срочное оперативное вмешательство, остановка кровотечения. В группе контроля у одного пациента развилась частичная несостоятельность анастомоза, больному проведена срочная реоперация. Статистически значимых различий по частоте послеоперационных осложнений между основной и контрольной группами выявлено не было, однако обнаружена тенденция к снижению суммарного количества осложнений при проведении ERAS (р = 0,06). В выделенных группах не было зарегистрировано ни одного летального исхода в течение 30 дней после операции.
ОБСУЖДЕНИЕ
Исследование показало, что с момента внедрения протокола ERAS сократилось число послеоперационных осложнений; у пациентов ОРИТ отмечено более раннее восстановление функции кишечника; у больных, леченных по протоколу ERAS, значительно сократились сроки пребывания как в ОРИТ, так и в стационаре в целом по сравнению с пациентами, у которых применялись традиционные подходы. Хотя результаты представляются весьма перспективными, необходимо особо подчеркнуть: проведенное исследование носило отчасти ретроспективный характер, поэтому окончательные и однозначные выводы не могут быть сделаны. Следует помнить также о том, что ввиду известных организационных трудностей нами был использован компонентный, а не комплексный подход к выполнению протокола.
Предоперационные компоненты ERAS включают в себя обучение пациента, детальную оценку его соматического состояния, коррекцию выявленных расстройств (при необходимости госпитализацию в профильный стационар), нормализацию питания с клинической точки зрения.
Большое значение имеет общение с пациентом. Необходимо детально и в доступной форме рассказывать обо всех этапах предстоящего лечения начиная с момента обращения в лечебное учреждение, в том числе обсуждать момент пробуждения после операции [17]. Данный компонент не требует от персонала и администрации заинтересованных подразделений использования дополнительных ресурсов и легковыполним.
Коррекция сопутствующей патологии и нормализация питания с помощью диеты и использования специализированных смесей для оптимизации исходного соматического статуса пациента являются важной и неотъемлемой частью ERAS [13]. Однако в современных экономических условиях пациенты часто госпитализируются накануне или в день операции в состоянии суб-, а иногда и декомпенсации имеющихся расстройств, и на подбор адекватной лекарственной терапии и коррекции нутритивной недостаточности у таких больных просто не хватает времени. Для решения этой проблемы в нашем институте подавляющее большинство пациентов консультируются анестезиологом-реаниматологом на поликлиническом этапе, что позволяет корригировать терапию еще до поступления в клинику. Такой подход существенно снижает процент больных с осложнениями. Перед плановой операцией необходимо также убедить пациента отказаться от курения, но клинически значимый результат будет достигнут только в том случае, если отказ от курения произойдет за один месяц до операции [9]. Поэтому на реализацию данного компонента ERAS, как правило, мы повлиять не в силах.
Текущие рекомендации по приему пищи и жидкости перед операцией включают прием легкой пищи за 6 часов, а жидкости — за 2 часа до вмешательства [2]. Дополнительный пероральный прием 12,5%-го раствора карбогидрата, содержащего мальтодекстрины, позволяет снизить чувства голода, жажды и беспокойства. Кроме того, использование карбогидрата способствует снижению потери белка, уменьшению послеоперационной инсулинорезистентности, большему сохранению мышечной силы в послеоперационном периоде [14]. Современные условия не всегда дают возможность использовать данный раствор, но в повседневной практике доступна его замена на раствор глюкозы той же концентрации или обычный сладкий чай.
В настоящее время не существует данных, согласно которым механическая подготовка кишечника снижала бы частоту осложнений в абдоминальной хирургии, за исключением операций на левой половине толстой кишки [3]. Наоборот, использование механической подготовки кишечника может повлечь осложнения за счет дегидратации и электролитного дисбаланса [4].
Интраоперационные компоненты ERAS непосредственно являются ключом к успеху и формируют основу для раннего питания и мобилизации пациентов. Они затрагивают работу и хирургов, и анестезиологов-реаниматологов. Так, при планировании оперативного вмешательства необходим взвешенный подход к использованию лапаро- и торакоскопической техники с целью снижения травматичности и упрощения ранней реабилитации [13]. Выполнение расширенной лимфодиссекции не позволяет полностью отказаться от дренирования брюшной полости, однако накопленный опыт и результаты международных исследований указывают на возможность обойтись единственным дренажом малого диаметра с максимально ранним его удалением. Важно решить вопрос о формировании доступа для осуществления раннего кормления пациента при операциях на ЖКТ. В перспективе возможен переход на раннее пероральное питание даже у больных с пищеводными анастомозами, поскольку опубликованы исследования, указывающие на отсутствие влияния раннего перорального питания на частоту несостоятельности анастомозов при операциях на верхних отделах ЖКТ.
Целевая направленность инфузионной терапии является важнейшим компонентом ERAS. Именно такой подход должен сохраняться на всех этапах периоперационного ведения [13]. Основные задачи инфузионной терапии — поддержание центральной эуволемии и исключение избыточного формирования электролитов и воды, которые неизбежно окажутся в интерстициальном пространстве. Помимо дыхательных расстройств, сформировавшийся интерстициальный отек кишечной стенки увеличивает продолжительность постоперационного пареза кишечника, что задерживает сроки реабилитации [6, 10]. У пациентов низкого риска, подлежащих небольшим хирургическим вмешательствам, возможно безопасное поддержание условной расчетной эуволемии. Однако это неприемлемо для пациентов повышенного риска, подлежащих обширным оперативным вмешательствам. В отношении их показана тактика индивидуальной целенаправленной инфузионной терапии (англ. Goal-Directed Fluid Therapy — GDFT), которая подразумевает использование минимально инвазивного мониторинга сердечного выброса с целью оптимизации ударного объема сердца. Применение данного метода позволяет избежать гиперволемии и послеоперационной кислородной задолженности [11, 15]. В нашем исследовании при обширных оперативных вмешательствах у пациентов высокого риска использовался именно такой подход.
Обезболивание пациентов, так же как инфузионная терапия, должно быть последовательным и адекватным на всех этапах лечения и основываться на принципах мультимодальности. Соблюдение протоколов ERAS подразумевает широкое использование регионарных методик анальгезии и анестезии [13]. Целью периоперационного обезболивания является рациональная минимизация применения опиоидных анальгетиков, а не стремление к отказу от их применения [8]. Принцип мультимодальности обезболивания подразумевает использование препаратов с разным механизмом действия и блокады ноцицепции на разных уровнях. С этой целью широко используются НПВП, габапентиноиды (габапентин, прегабалин), антагонисты NMDA-рецепторов (кетамин, нефопам), альфа-2-агонисты (клонидин, дексмедетомидин), а также локальная инфильтрация области операции местными анестетиками [13]. Для открытой хирургии пролонгированная эпидуральная анестезия и анальгезия — «золотой стандарт» [18]. Однако необходимо помнить, что эпидуральная анальгезия может повлечь за собой гипотензию (которая часто компенсируется объемом инфузии, что нарушает принцип GDFT и также ведет к осложнениям) и, кроме того, способна привести к задержке сроков удаления мочевого катетера [13]. В нашей клинике использование нейроаксиальных блокад является неотъемлемой частью анестезиологического обеспечения при обширных оперативных вмешательствах. Для пациентов, подлежащих полостным видеоэндоскопическим вмешательствам, альтернативными методами обезболивания могут быть паравертебральные блокады и блокады поперечной мышцы живота (англ. Transversus Abdominis Plane Block) [13].
Успешное сочетание компонентов ERAS в предоперационном и интраоперационном периодах создает условия для раннего начала энтерального кормления и проведения ранней мобилизации пациента в послеоперационном периоде. Раннее начало энтерального питания содействует скорейшему восстановлению моторики ЖКТ и отказу от внутривенной инфузионной терапии [5, 13]. Кроме того, стимуляции работы кишечника способствует использование жевательной резинки (мнимое кормление) [16]. Необходимо помнить, что перегрузка жидкостью в послеоперационном периоде так же вредна, как и интраоперационно, поэтому назначение дополнительного ее объема должно быть обоснованным [11].
Точное соблюдение протоколов ERAS требует, чтобы в послеоперационном периоде пациент сидел в кресле не менее 6 часов каждый день [13]. В нашем учреждении, так же как и в других, активизацией пациентов занимаются в основном средний медицинский персонал и лечащие врачи. Ввиду их загруженности неукоснительное следование протоколу ERAS вызывает объективные трудности и не всегда возможно. Однако целесообразно стремиться к выполнению рекомендаций. Катетеры, дренажи и зонды у пациентов должны сохраняться только тогда, когда для этого существуют клинические показания.
Особое внимание необходимо уделять психологическому состоянию больных. Общение с пациентом, контроль за соблюдением режима сна и бодрствования, отказ от использования бензодиазепинов являются важными компонентами ранней реабилитации. Сегодня достаточно средств, способных облегчить засыпание пациента без последующей седации. К ним относятся, в частности, пропофол, дексмедетомидин. Следует стремиться к скорейшему восстановлению ориентации пациента в окружающем мире и к его максимально раннему возврату к умственной деятельности. Этому способствуют раннее начало общения с родственниками, чтение, прослушивание музыки, просмотр телепередач [19].
Выводы
В нашем исследовании удалось использовать только компонентный подход к выполнению программы ERAS, так как точное комплексное следование существующим протоколам не всегда было доступно. Однако даже ограниченное внедрение принципов ERAS способствовало:
1) сокращению сроков пребывания пациентов в ОРИТ (с 1,75 ± 0,89 до 1,25 ± 0,44 суток; p < 0,05);
2) уменьшению сроков пребывания пациентов в стационаре (с 15,5 ± 2,82 до 14,25 ± 1,48 суток; p < 0,05);
3) сокращению сроков восстановления функции кишечника (с 1,93 ± 1,09 до 1,33 ± 0,47 суток; p < 0,05);
4) появлению отчетливой тенденции к уменьшению числа послеоперационных осложнений.
ЗАКЛЮЧЕНИЕ
Проведенное исследование показало, что успешное сочетание компонентов программы ранней реабилитации после хирургических вмешательств в предоперационном и интраоперационном периодах создает условия для сокращения сроков пребывания пациентов в ОРИТ и стационаре, а также снижения числа послеоперационных осложнений.








