ВВЕДЕНИЕ
СД 1 типа (СД1) является аутоиммунным заболеванием, которое развивается на фоне и после гибели β-клеток поджелудочной железы, вырабатывающих инсулин — гормон, который оказывает множественное влияние на метаболизм глюкозы, липидов и белков.
При СД клетки организма подвержены патологическому воздействию высоких концентраций глюкозы, в том числе страдают клетки эндотелия, что приводит к развитию и прогрессированию специфических микрососудистых поражений сетчатки, клубочков и сосудов, участвующих в кровоснабжении периферических нервов[1].
В патогенезе макро- и микрососудистых осложнений СД важную роль играет гипергликемия. Продолжительность и амплитуда гипергликемии сильно коррелируют со скоростью прогрессирования диабетической микрососудистой патологии[2]. Исследование DCCT[3] в свое время доказало взаимосвязь рисков развития и прогрессирования специфических осложнений СД и уровней гликемии и гликированного гемоглобина (HbA1c) — основного показателя компенсации СД, который находится в прямой зависимости от концентрации глюкозы крови и является интегрированным показателем компенсации углеводного обмена на протяжении последних 90–120 дней.
Терапия СД направлена на оптимизацию гликемического контроля, чаще всего определяемого по уровню HbA1c, для снижения риска макро- и микрососудистых осложнений, частота и прогрессирование которых, как было показано, коррелируют с содержанием HbA1c[4, 5]. В отечественных руководствах и международных рекомендациях для большинства пациентов с СД1 обозначено целевое значение HbA1c менее 7,0%, хотя целевые значения должны быть индивидуализированы в зависимости от возраста пациентов, сопутствующих заболеваний и риска развития гипогликемии[6]1.
Однако на практике многие больные не достигают целевых показателей HbA1c[7].
Риск осложнений СД1 увеличивается по мере ухудшения гликемического контроля и повышения вариабельности уровня глюкозы. Эффективность гликемического контроля может быть оценена с помощью ряда показателей, включая уровень HbA1c до и в конце периода лечения, общее время в целевом диапазоне (Time In Range — TIR), время выше целевого диапазона (Time Above Range — TAR), ниже целевого диапазона (Time Below Range — TBR), TIR, TAR и TBR в определенные временны́е интервалы, а также уровни глюкозы плазмы натощак и постпрандиальной гликемии (ППГ)[8].
ППГ является важной мерой общего метаболического контроля при диабете, так как уменьшение выраженности вариабельности концентрации глюкозы может быть достигнуто за счет снижения ППГ[9].
Единственным методом лечения СД1 с доказанной безопасностью и эффективностью остается инсулинотерапия. В то же время достижение целевых значений гликемического контроля в педиатрической практике затруднено, несмотря на обилие высокотехнологичных средств индивидуального контроля гликемии и современных способов введения инсулина.
Ограничение ППГ — важный аспект общего гликемического контроля. Аналоги инсулина быстрого действия призваны имитировать физиологическое действие эндогенного инсулина, наблюдаемое у лиц без диабета, и предотвращать чрезмерные колебания ППГ. Быстродействующие аналоги инсулина (БАИ) широко используются при лечении СД у детей, и результаты исследований показывают, что БАИ более эффективны в снижении отклонений ППГ и содержания HbA1c[10].
Тем не менее многие пациенты с СД1, получающие БАИ, не достигают целевых показателей HbA1c, и существует неудовлетворенная потребность в дальнейшем улучшении контроля ППГ[11].
Современные БАИ имеют отсроченное начало и бо́льшую продолжительность действия, чем эндогенный инсулин, секретируемый в ответ на прием пищи. Подходы к разработке новых препаратов инсулина для коррекции подъема уровня гликемии в ответ на прием пищи с ускоренной кинетикой всасывания включают попытки изменения пути введения (например, путем ингаляции) и состава инсулина[12]. Сверхбыстродействующий инсулин аспарт (СБиАсп) представляет собой новую форму инсулина аспарт (иАсп), содержащую вспомогательные вещества ниацинамид и L-аргинин. СБиАсп имеет более ранние начало действия инсулина и сахароснижающий эффект, чем аспарт[13].
В крупных клинических исследованиях СБиАсп во время приема пищи продемонстрировал не меньшую эффективность, чем иАсп, в отношении снижения уровня HbA1c и обеспечил превосходный контроль ППГ без увеличения количества эпизодов тяжелой гипогликемии или гипергликемии. Кроме того, СБиАсп, вводимый в течение 20 минут после начала приема пищи, не уступал иАсп во время приема пищи по эффективности контроля концентрации HbA1c, что подчеркивает возможность его введения после еды[14–16].
ИАсп, инсулин глулизин и инсулин лизпро необходимо вводить примерно за 15–20 мин до еды, чтобы наилучшим образом удовлетворить постпрандиальную потребность в инсулине. Однако в повседневной жизни подростки с СД1 с трудом соблюдают рекомендуемые интервалы между инъекциями и едой, многие соблюдают только очень короткие интервалы или вообще игнорируют их, вводя болюсный инсулин после еды, что негативно сказывается на уровне ППГ и ухудшает гликемический контроль[17].
Наиболее проблемным временем, когда подросткам не удается соблюдать рекомендованные временны́е интервалы между введением инсулина и началом приема пищи, является нахождение детей в школе — с 9 утра до 15 часов дня. Согласно нашим данным, в реальной жизни зачастую продолжительность перемен между занятиями позволяет детям с СД1 вводить болюсный инсулин только непосредственно перед началом приема пищи в школе либо после него.
Цель исследования: оценить уровень ППГ и качество гликемического контроля у подростков, получающих терапию СБиАсп.
МАТЕРИАЛЫ И МЕТОДЫ
В 2021 г. нами проведено 12-недельное проспективное открытое контролируемое клиническое исследование на базе Городского детского эндокринологического центра Санкт-Петербурга СПбГБУЗ ДГМКЦ ВМТ имени К.А. Раухфуса. В исследование включены подростки с СД1, получающие инсулинотерапию в режиме многократных ежедневных инъекций, с длительностью заболевания более 1 года, использующие для контроля гликемии систему флэш-мониторирования гликемии (ФМГ).
Критерии исключения — нарушения функции печени, почек, надпочечниковая недостаточность, целиакия, нарушение функции щитовидной железы, наличие анемии, эпизода диабетического кетоацидоза или тяжелой гипогликемии в течение последнего года.
Обследован 21 подросток с СД1 в возрасте от 12 до 15 лет, средний возраст составил 13,2 ± 1,2 года, из них 12 (57,1%) мальчиков (средний возраст — 13,3 ± 2,1 года) и 9 (42,9%) девочек (средний возраст — 12,9 ± 2,1 года). Длительность заболевания составляла 4,1 ± 1,3 года (1–8 лет).
Обследованные дети получали инсулинотерапию в режиме многократных ежедневных инъекций, в качестве базального инсулина применялись гларгин или деглудек, в качестве болюсного — инсулин лизпро или иАсп.
В школе инсулин вводился непосредственно в момент начала приема пищи в столовой, без необходимой паузы перед приемом пищи.
Гликемический контроль оценивался по значениям TIR, TAR и TBR, согласно Международному консенсусу по времени в целевом диапазоне2, по отчетам стандартного амбулаторного профиля глюкозы. Эти отчеты были получены на онлайн-платформе LibreView3.
Оценивали уровни препрандиальной гликемии и глюкозы через 30, 60 и 120 минут после приема пищи в школе. Параметры TIR, TAR и TBR во время нахождения детей в школе и значения ППГ рассчитывались вручную после выгрузки массива данных на персональный компьютер и вычленения соответствующего временно́го интервала.
Перевод пациентов на терапию СБиАсп осуществлялся амбулаторно. Через 3 месяца после смены инсулинотерапии определяли TIR, TAR и TBR в школе, а также уровень препрандиальной гликемии и через 30, 60 и 120 минут после приема пищи в школе.
Статистический анализ производился с использованием программы StatTech v. 2.6.1 (ООО «Статтех», Россия). Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро — Уилка (при числе исследуемых менее 50). Количественные показатели, имеющие нормальное распределение, описывались с помощью средних арифметических величин (M) и стандартных отклонений (SD), границ 95%-ного ДИ. При сравнении нормально распределенных количественных показателей, рассчитанных для двух связанных выборок, использовался парный t-критерий Стьюдента. Различия считали статистически значимыми при р < 0,05.
РЕЗУЛЬТАТЫ
По результатам ФМГ, до перевода на терапию СБиАсп подростки имели следующие показатели гликемического контроля: среднее общее значение TIR составляло 58,1 ± 12,4% (39–82%), TAR — 32,5 ± 11,9% (10–60%), TBR — 10,1 ± 5,3% (1–19%). При оценке показателей гликемического контроля в школьное время относительно общих значений отмечались статистически значимые снижение TIR (до 52,3 ± 13,1% (30–78%); р < 0,001) и увеличение TAR (до 37,4 ± 12,3% (15–63%); р < 0,001). Это показывает, что нахождение в школе и несоблюдение препрандиальных пауз существенно ухудшает гликемический контроль у подростков с СД1.
Перевод на терапию СБиАсп позволил избежать необходимости выдерживать препрандиальную паузу перед приемом пищи в школе. Использование СБиАсп также сопровождалось значимым улучшением показателей гликемического контроля у обследованных детей (табл. 1).
Таблица 1
Показатели гликемического контроля у подростков до и после перевода на терапию сверхбыстродействующим инсулином аспарт (СБиАсп)
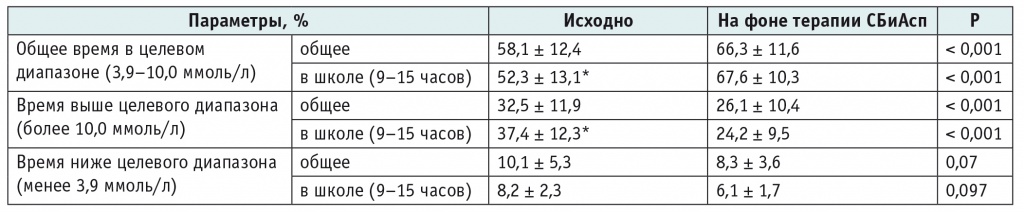
* Отличия от общих показателей статистически значимы (р < 0,001).
Увеличение TIR, как общего, так и во время нахождения в школе, происходило в первую очередь за счет уменьшения TAR, в то же время TBR статистически значимо не измененилось.
Амплитуда постпрандиальных значений гликемии также стала ниже после начала терапии СБиАсп (табл. 2).
Таблица 2
Значения постпрандиальной гликемии у подростков до и после перевода на терапию сверхбыстродействующим инсулином аспарт (СБиАсп)
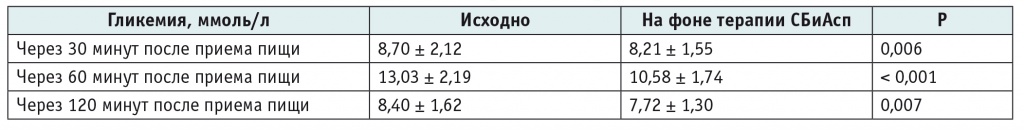
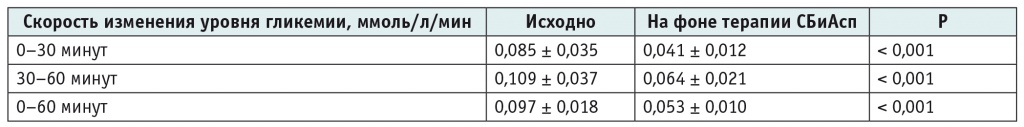
Более раннее начало действия СБиАсп, чем у классических ультракоротких аналогов, и более ранний сахароснижающий эффект позволили снизить ППГ за счет уменьшения скорости роста уровня глюкозы (табл. 3).
Таблица 3
Скорость изменения уровня постпрандиальной гликемии у подростков до и после перевода на терапию сверхбыстродействующим инсулином аспарт (СБиАсп)
ОБСУЖДЕНИЕ
Восполнение дефицита прандиального инсулина играет большую роль в нормализации углеводного обмена у пациентов с СД1. У людей без нарушений углеводного обмена прандиальный инсулин составляет около 50% от общего суточного выброса поджелудочной железой, при этом его бо́льшая часть секретируется в течение первого часа после еды[18].
Консенсус Международной диабетической федерации рекомендует стремиться к тому, чтобы уровень глюкозы через 2 часа после еды не превышал 7,8 ммоль/л, так как этот уровень редко наблюдается у людей без диабета4. Американская диабетическая ассоциация определяет целевой постпрандиальный уровень глюкозы в 10 ммоль/л через 2 часа5. Имеются данные о том, что постпрандиальные значения глюкозы, выходящие за пределы этих уровней, повышают риск развития диабетической ретинопатии и увеличения толщины комплекса интима-медиа сонных артерий, а также приводят к большей выраженности окислительного стресса, воспаления и дисфункции эндотелия[19, 20].
Влияние ППГ на гликемический контроль является предметом многочисленных дискуссий среди клиницистов. Крупные интервенционные исследования показали, что достижение и поддержание околонормального уровня гликемии снижает риск микрососудистых и макрососудистых осложнений при СД1[15, 16]. Известно, что препрандиальные концентрации глюкозы связаны с HbA1с более сильно, чем постпрандиальные, при этом ППГ составляет примерно 30–40% от общей дневной гипергликемии[21].
Точный вклад постпрандиального прироста содержания глюкозы и уровня глюкозы натощак в общую гипергликемию остается дискутабельным. По данным J. Ma и соавт., относительный вклад постпрандиальных колебаний уровня глюкозы в «компенсацию» СД в целом преобладает у пациентов с хорошим контролем, тогда как по мере ухудшения гликемического контроля постепенно увеличивается вклад гипергликемии натощак[22].
Расхождения между данными, опубликованными за последние годы, по-видимому, указывают на то, что ответ на вопрос об относительном вкладе гипергликемии натощак и ППГ в компенсацию СД может быть более сложным и тонким, чем ожидалось. Например, на величину относительного вклада постпрандиальных повышений уровня глюкозы в общую гипергликемию могут влиять как обстоятельства, при которых проводился мониторинг уровня глюкозы в постпрандиальный период, так и адекватность контроля СД в целом[23].
Коррекция дозы инсулина во время еды на основании данных мониторинга уровня глюкозы является важным аспектом в лечении СД1 у детей. Сложность выбора и расчета доз инсулина перед едой с учетом различий в размерах порций и составе пищи, а также в зависимости от физической активности часто непосильна и может усугубляться страхом развития гипогликемии[24].
Однако многие пациенты не корректируют свои препрандиальные дозы при высоком уровне глюкозы, что частично объясняет невозможность достижения целевых показателей гликемического контроля. Высокие уровни глюкозы после еды возникают не только из-за недостаточной дозы инсулина, но также могут отражать слишком позднее действие инсулина, поэтому время введения инъекций болюсного инсулина тоже является ключевым фактором в контроле ППГ при СД1.
Кроме того, подростки с СД1 очень часто пропускают болюсы, особенно в случае перекусов, или могут намеренно не вводить требуемые болюсы постоянно. Причины пропуска болюсных инъекций включают предотвращение развития гипогликемии, избегание боли при введении инсулина, страх инъекций, смущение от вмешательства в повседневную деятельность, особенно во время школьных занятий[25].
Лечение СБиАсп может иметь определенные преференции для всех пациентов, нуждающихся в инсулинотерапии, поскольку быстрое начало его действия обеспечивает бо́льшую гибкость в дозировании до и во время приема пищи, чем обычные аналоги, и это может способствовать большей удовлетворенности лечением и повышению приверженности, что критически важно при работе с таким сложным заболеванием, как СД1. В течение первого часа после приема пищи СБиАсп индуцирует не только бо́льшую периферическую скорость исчезновения глюкозы, но и большее подавление продукции эндогенной глюкозы[26]. Схожие данные получены и в нашем исследовании.
Наиболее значимым результатом нашего исследования следует считать существенное снижение величины и скорости изменения ППГ через 30, 60 и 120 минут после приема пищи у подростков, получающих терапию СБиАсп, что отражается в улучшении показателей гликемического контроля.
ЗАКЛЮЧЕНИЕ
Терапия с использованием сверхбыстродействующего инсулина аспарт (СБиАсп) у школьников с СД 1 типа позволяет достигать улучшения показателей гликемического контроля в виде увеличения времени в целевом диапазоне за счет снижения времени выше целевого диапазона без сопутствующего возрастания риска развития гипогликемий.
Тем не менее, как и при любых изменениях в инсулинотерапии, после начала применения СБиАсп необходимы надлежащая осторожность и постоянный мониторинг показателей гликемии, что является ключевым аспектом в достижении целевых значений уровня гликированного гемоглобина и в профилактике развития хронических осложнений СД.
Поступила: 17.02.2022
Принята к публикации: 15.03.2022
________
1 Дедов И.И., Шестакова М.В., Майоров А.Ю., ред. Алгоритмы специализированной медицинской помощи больным сахарным диабетом. 10-й вып. М.; 2021. DOI: 10.14341/DM12802; American Diabetes Association. 6. Glycemic targets: Standards of medical care in diabetes — 2018. Diabetes Care. 2018; 41(suppl.1): S55–64. DOI: 10.2337/dc18-S006
2 Battelino T., Danne T., Bergenstal R.M. et al. Clinical targets for continuous glucose monitoring data interpretation: recommendations from the International consensus on time in range. Diabetes Care. 2019; 42(8): 1593–603. DOI: 10.2337/dci19-0028
3 Bergenstal R.M., Ahmann A.J., Bailey T. et al. Recommendations for standardizing glucose reporting and analysis to optimize clinical decision making in diabetes: the Ambulatory Glucose Profile (AGP). Diabetes Technol. Ther. 2013; 15(3): 198–211. DOI: 10.1089/dia.2013.0051
4 International Diabetes Federation Guideline Development Group. Guideline for management of postmeal glucose in diabetes. Diabetes Res. Clin. Pract. 2014; 103(2): 256–68. DOI: 10.1016/j.diabres.2012.08.002
5 American Diabetes Association Professional Practice Committee; Draznin B., Aroda V.R. et al. 16. Diabetes care in the hospital: standards of medical care in diabetes — 2022. Diabetes Care. 2022; 45(suppl.1): S244–253. DOI: 10.2337/dc22-S016








