Среди жителей Новосибирска 45–69 лет, по данным популяционного скрининга 2003–2005 гг., обнаружена высокая распространенность СД2 (без значимых гендерных различий) — 11,3% [1]. Сопоставимость полученных данных с результатами первого национального эпидемиологического кросссекционного исследования, проведенного на территории Российской Федерации, по определению распространенности СД2 (NATION, 2013–2015 гг.), несмотря на использование разных диагностических критериев для постановки диагноза СД2, позволяет оценивать полученные в Новосибирске данные как репрезентативные в целом для России [1, 2]. В исследовании NATION в качестве диагностического критерия СД выбран уровень гликированного гемоглобина (HbA1c) ≥ 6,5%, в Новосибирске — уровень глюкозы в венозной плазме натощак ≥ 7,0 ммоль/л однократно после 8часового голодания.
С увеличением возраста отмечается статистически значимый рост распространенности СД2 среди жителей Новосибирска: 6,2% у лиц в возрасте 45–49 лет, максимальная частота в возрастной группе 65–69 лет — 15,0%. По данным исследования NATION, СД2 также наиболее часто диагностировали у людей в возрасте 65–69 лет — у 13,6%. Как справедливо отмечают авторы исследования NATION, полученные сведения важны, так как в этой возрастной группе наблюдается высокая распространенность заболеваний сердечнососудистой системы, терапия которых становится более сложной при наличии сопутствующего СД2 [1, 2].
Среди обследованных в Новосибирске из тех, кто знал о наличии у них СД2, у 30% уровень глюкозы крови натощак был ниже 7,0 ммоль/л. Значения выше ≥ 11,1 ммоль/л определены у 13,4%. Похожие данные приведены и в исследовании NATION, в котором среди участников с СД2 у 19,3% содержание HbA1c было больше 9,0%. Из общего числа лиц с СД2 82,9% указали во время обследования, что принимают пероральные сахароснижающие препараты, средний уровень глюкозы плазмы натощак в этой группе составил 10,5 ± 3,7 ммоль/л; 14,3% получали инсулинотерапию и соблюдали рекомендации по питанию, и у них средний уровень глюкозы плазмы натощак — 11,1 ± 1,7 ммоль/л. Лучшие показатели гликемии были у 2,8% человек, которые сообщили, что получают пероральные сахароснижающие препараты и инсулинотерапию, соблюдают рекомедации по питанию, средний уровень глюкозы в крови в этой группе составил 8,4 ± 2,6 ммоль/л [2, 3].Таким образом, у большинства лиц с СД2, получавших лечение по поводу СД2, выявлена все же недостаточная компенсация углеводного обмена. Возникает необходимость оптимизации проводимой терапии.
В последние годы в лечении больных СД2 широко применяют предварительно смешанные инсулины с фиксированным соотношением инсулинов короткого и продленного действия [4, 5]. Назначение предварительно смешанных инсулинов может быть наиболее оптимальным и обоснованным для пациентов, которые нуждаются в простом и удобном режиме инсулинотерапии. Использование готовых смесей инсулина в различных странах сильно варьируется: от более 60% всех используемых инсулинов в Германии до 20–30% в Канаде и США. В большинстве стран мира отмечается устойчивая тенденция к увеличению частоты применения предварительно смешанных инсулинов.
Готовые смеси позволяют индивидуализировать лечение. Кроме того, результаты международных и российских клинических исследований показывают, что использование смешанных инсулинов обеспечивает пациентам с СД2 удовлетворительный контроль углеводного обмена [6–9].
Цель исследования: оценить показатели углеводного обмена на фоне применения двухфазного человеческого генноинженерного инсулина (Росинсулина М микс 30/70) у больных СД2, ранее не получавших инсулинотерапию, не достигших целевых показателей углеводного обмена в результате проводимой терапии пероральными сахароснижающими препаратами.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проведено в 2015–2016 гг. на базе ГБУЗ НСО «Городская клиническая больница № 11» г. Новосибирска (главный врач — к. м. н. Величко А. Я.). Оно включало 36 пациентов с СД2 (11 мужчин и 25 женщин), получавших комбинацию препаратов метформина и сульфонилмочевины в максимально переносимых дозах. Все изменения в терапии диабета, произведенные на протяжении периода исследования, фиксировали в индивидуальной регистрационной карте пациента во время госпитализации в эндокринологическое отделение и при последующих амбулаторных визитах к эндокринологу через 3 и 6 месяцев.
Данная работа предусматривала максимально простой дизайн в условиях реальной клинической практики: последовательное включение пациентов без процедуры рандомизации, отсутствие контрольной группы. Вопросы о включении пациента в исследование, назначении Росинсулина М микс 30/70 и его начальной дозе, дозах пероральных сахароснижающих препаратов решались лечащим врачом пациента.
Все больные подписали письменное информированное согласие на участие в исследовании после получения от лечащего врача подробной информации о предстоящей программе, порядке ее проведения, побочных эффектах, которые могут возникнуть в результате лечения. Исследование соответствовало этическим стандартам, разработанным в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» с поправками 2000 г. и Правилами клинической практики в Российской Федерации, утвержденными Приказом Минздрава России от 19.06.2003 г. № 266. Протокол исследования был одобрен локальным Этическим комитетом.
На 1м визите (в период госпитализации в эндокринологическое отделение) осуществлялось включение в исследование больных, которым, согласно существующим клиническим рекомендациям, была необходима инициация инсулинотерапии. Оценивались демографические (пол, возраст) и антропометрические (рост, вес, ИМТ) данные, длительность СД, степень компенсации углеводного обмена (уровни HbA1c, глюкозы венозной плазмы натощак). Наличие осложнений: ретинопатии, нейропатии, нефропатии — и сопутствующих заболеваний фиксировалось врачом на основании доступной в медицинских картах и историях болезни информации.
Для каждого пациента лечащий врач обосновывал целевой уровень HbA1c. Росинсулин М микс 30/70 назначался в соответствии с инструкцией к препарату и показаниями для старта инсулинотерапии. Введение инсулина в картриджах производилось шприцручками КомфортПен под кожу 2 раза в сутки перед приемом пищи.
На 2м и 3м визитах в условиях амбулаторного приема эндокринолог оценивал массу тела, ИМТ, состояние компенсации углеводного обмена (содержание HbA1c, глюкозы венозной плазмы натощак), корректировал дозу инсулина. Результаты обследований, дозы инсулина, нежелательные явления на 1м визите и после 3 и 6 месяцев наблюдения регистрировались в индивидуальной регистрационной карте пациента. Общая продолжительность наблюдения составила 24 недели.
Переносимость инсулинотерапии оценивали по наличию местных и общих аллергических реакций на препарат, развитию гипогликемических реакций. Основным критерием безопасности проводимой терапии было количество серьезных нежелательных явлений, в том числе тяжелых дневных и ночных гипогликемических состояний в течение 6 месяцев применения инсулина. Гипогликемией считали уровень глюкозы в крови ниже 3,9 ммоль/л и/или наличие клинических симптомов, которые расценивались пациентом как типичные проявления гипогликемии.
Гипогликемия определялась как легкая, если эпизод самостоятельно купировался пациентом. Тяжелая гипогликемия — эпизод с потерей сознания или без, потребовавший для купирования помощи других лиц.
Эффективность лечения оценивали по динамике уровней HbA1с, глюкозы плазмы натощак через 3 и 6 месяцев после старта инсулинотерапии. Контрольные лабораторные исследования глюкозы плазмы натощак выполнялись в местных лабораториях в соответствии с общепринятыми процедурами стандартизации и контроля качества. Уровень HbA1c определяли в цельной капиллярной крови прибором DCA Vantage (Siemens).
По завершении наблюдения был подготовлен статистический отчет. Статистический анализ данных осуществлялся с использованием пакета программ SPSSv19. В зависимости от характера данных описательный статистический анализ включал в себя для количественных показателей, распределенных непараметрически, медиану (Ме), первый и третий квартили [Q1; Q2]. При сравнении значений параметров до начала, через 3 и 6 месяцев инсулинотерапии применяли непараметрический критерий Вилкоксона. Различия считали статистически значимыми при р < 0,05.
РЕЗУЛЬТАТЫ
Основные характеристики пациентов приведены в таблице 1.
Таблица 1
Основные антропометрические и метаболические показатели пациентов с сахарным диабетом 2 типа на этапе включения в исследование
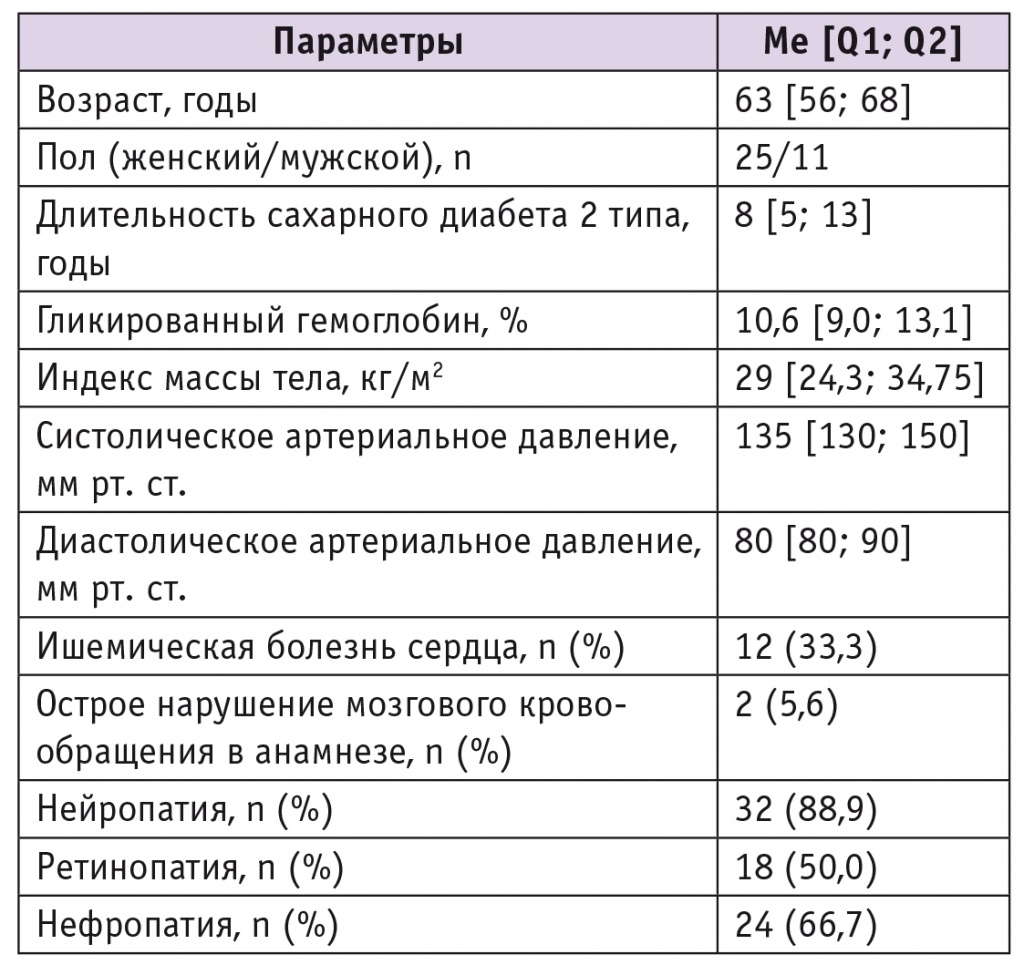
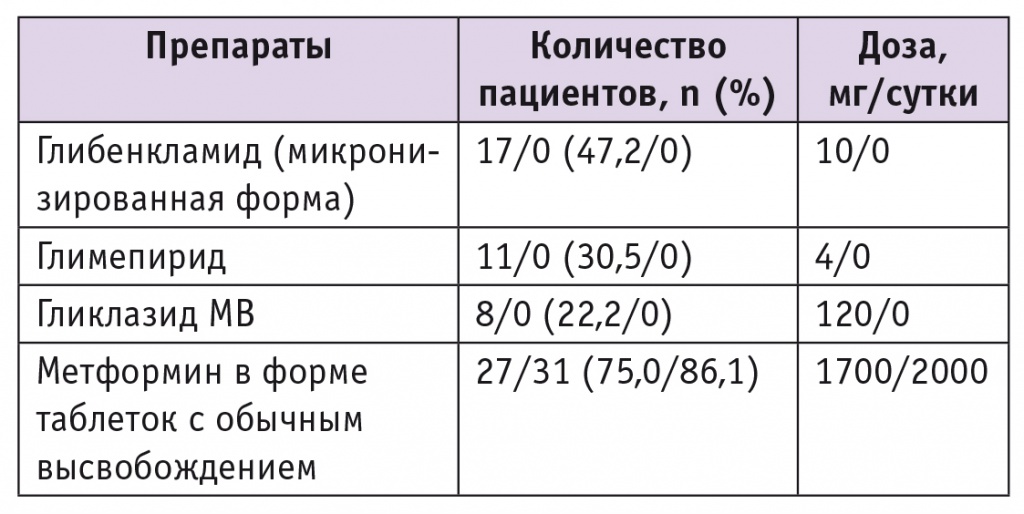
Показатели НbА1с имели достаточно широкий разброс — от 6,9% до 14,0%, медиана составила 10,6% [9,0%; 13,1%]. Уровень глюкозы плазмы натощак — 11,1 [8,9; 14,6] ммоль/л, причем 74% пациентов имели НbА1с ≥ 9,0%. На 1м визите лечащий врач у каждого участника зафиксировал целевой уровень HbA1c, исходя из действующих Алгоритмов специализированной медицинской помощи больным сахарным диабетом [5]. При назначении Росинсулина М микс 30/70 доза метформина составила 2000 мг/сут и оставалась стабильной в течение всего периода наблюдения, препараты сульфонилмочевины были отменены (табл. 2).
Таблица 2
Таблетированная сахароснижающая терапия пациентов с сахарным диабетом 2 типа до/после назначения инсулинотерапии
Инсулинотерапия проводилась с учетом консенсусного алгоритма инициации и интенсификации сахароснижающей терапии у больных СД2 [10]. Лечение смешанным инсулином в пропорции 30/70 начиналось с суточной дозы 0,4–0,6 Ед/кг массы тела (в зависимости от уровня гликемии перед ужином и натощак). При необходимости начальная доза могла быть уменьшена по решению врача. Далее доза инсулина (тоже при необходимости) постепенно увеличивалась каждые 2–4 дня на 4–6 Ед до достижения целевых уровней глюкозы плазмы натощак и перед ужином при условии отсутствия симптомов гипогликемии.
В настоящее время принято суточную дозу смешанных инсулинов делить поровну между утренней и вечерней инъекциями, однако некоторые больные достигают лучших показателей при назначении 2/3 суточной дозы перед завтраком и 1/3 перед ужином. В данном исследовании 27 человек (75,0%) по назначению лечащего врача получали 2/3 суточной дозы инсулина утром и 1/3 вечером, 9 человек (25,0%) делили дозу поровну.
Средняя суточная доза Росинсулина М микс 30/70, подобранная на 1м визите, — 37 [31; 48] Ед/сут. В ходе контрольных визитов она корректировалась в зависимости от показателей углеводного обмена и через 6 месяцев составила 36 [30; 46] Ед/сут. Важно, что применение смешанных видов инсулина практически не меняет образ жизни пациента, кроме того, не требует частого мониторинга гликемии — достаточно контролировать уровень глюкозы в крови 1 раз в день перед завтраком и периодически проводить дополнительный тест ночью. Возможность ограничиться двумя инъекциями инсулина помогает больным преодолеть страх перед многочисленными инъекциями.
Через 3 и 6 месяцев после назначения инсулинотерапии отмечалось значительное снижение уровней гликемии и НbА1с. Через 6 месяцев инсулинотерапии в сочетании с метформином медиана НbА1с уменьшилась на 2,4% (р = 0,042), гликемии натощак — на 4,1 ммоль/л (р < 0,001) (табл. 3).
Таблица 3
Динамика антропометрических и метаболических показателей у пациентов с сахарным диабетом 2 типа на фоне комбинированной терапии Росинсулином М микс 30/70 в сочетании с метформином
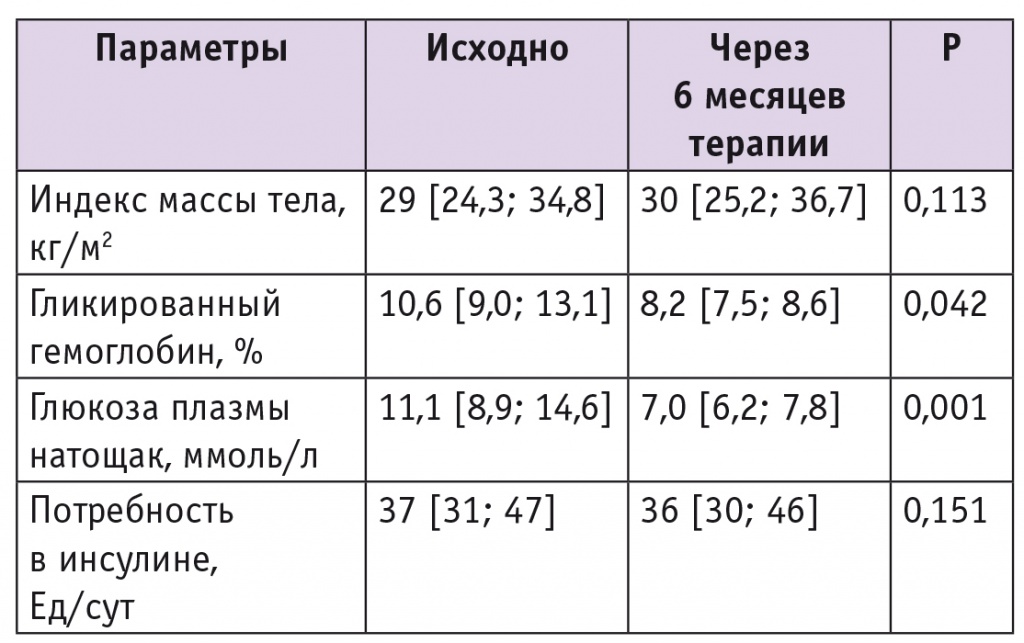
Несмотря на значительное снижение содержания НbА1с через 6 месяцев лечения, целевого уровня (менее 7,5%) достигло небольшое количество пациентов — 9 (25,0%), что связано с исходно плохим гликемическим контролем в исследуемой группе, повышенной осторожностью врачей в связи с риском развития гипогликемических состояний.
Один пациент сообщил о тяжелой гипогликемии через 3 месяца наблюдения. Частота легких гипогликемических состояний составила в среднем 2–4 в месяц на одного человека. Местных реакций на введение препарата и других нежелательных явлений не было.
ОБСУЖДЕНИЕ
Полученные результаты показали, что Росинсулин М микс 30/70 в комбинации с метформином обладает выраженным сахароснижающим эффектом у больных с неудовлетворительным контролем гликемии на фоне предшествующей комбинированной терапии метформином с сульфонилмочевиной. Следует отметить, что данные результаты были получены в условиях реальной клинической практики. По своим характеристикам участники исследования представляли типичную когорту пациентов с СД2: с избыточной массой тела или ожирением, сопутствующей АГ, у 50,0% имелась диабетическая ретинопатия, у 88,9% — диабетическая нейропатия, у 33,3% — ИБС, у 5,6% — ОНМК в анамнезе. За период наблюдения не было новых сердечнососудистых событий. Прибавка массы тела за 6месячный период наблюдения не отмечена. Один пациент сообщил о тяжелой гипогликемии через 3 месяца, поэтому доза инсулина была скорректирована, в дальнейшем тяжелые гипогликемии не повторялись.
Достижение значимого улучшения показателей углеводного обмена произошло на фоне незначительного количества зафиксированных гипогликемических состояний, что позволяет говорить о безопасности терапии генноинженерным комбинированным инсулином при соблюдении рекомендаций, изложенных в Алгоритмах диагностики и лечения СД.
Ранее проведенное авторами исследование показало, что использование инсулинов отечественных производителей позволяет достигать эффективного и безопасного гликемического контроля, получая при этом финансовые преимущества. Так, назначение генноинженерного человеческого инсулина продленного действия (Росинсулина С) в комбинации с пероральными сахароснижающими препаратами у пациентов с неудовлетворительным контролем гликемии на фоне предшествующей комбинированной терапии метформином с сульфонилмочевиной дает выраженный сахароснижающий эффект [11]. Под наблюдением находились 28 пациентов с СД2 (4 мужчины и 24 женщины). Исходно уровень HbА1c составил 8–14%, медиана — 11% [10%; 13%], средний возраст больных — 63 [57; 72] года, ИМТ — 33 [30; 35] кг/м2, окружность талии — 105 [99; 111] см, стаж СД2 — 7 [2; 11] лет. Введение инсулинаизофан производилось шприцручками Autopen.
При скрининге и через 3 и 6 месяцев определяли уровни HbА1c и гликемии натощак. Через 6 месяцев отмечено их статистически значимое снижение (р = 0,001). Назначенная доза генноинженерного человеческого инсулина продленного действия составила 23 [20; 29] Ед/сут, через 24 недели терапии — 27 [24; 33] Ед/сут. Тяжелых гипогликемических реакций, прибавки массы тела и других нежелательных эффектов на фоне интенсификации терапии генноинженерным человеческим инсулином продленного действия не было [11].
В 2009 г. при участии кафедры эндокринологии Первого Московского государственного медицинского университета им. И. М. Сеченова проведено многоцентровое открытое клиническое исследование по оценке эффективности и безопасности применения Росинсулина Р и Росинсулина С у больных СД1 и СД2 [12]. Длительность наблюдения составила 90 дней. В исследовании участвовали 96 человек в возрасте от 18 до 78 лет, которые исходно находились на инсулинотерапии препаратами инсулина человека. С целью оценки эффективности лечения определяли уровни HbА1c и гликемии натощак. Безопасность оценивали по динамике концентрации контринсулярных антител, данных лабораторных анализов и наличию побочных реакций.
В ходе исследования отмечена тенденция к снижению содержания HbА1c (с 7,56 ± 1,34% до 7,03 ± 0,82%) и гликемии натощак (с 8,91 ± 3,32 до 6,93 ± 2,41 ммоль/л). Авторы делают вывод, что полученные данные свидетельствуют о сохранении контроля гликемии как на протяжении всего исследования, так и ко времени заключительного визита. Не зафиксированы эпизоды тяжелой гипогликемии, кетоацидоза и липодистрофии [12].
В основе выбора инсулинотерапии должен лежать индивидуальный подход. В каждом случае при выборе лечения необходимо учитывать возраст пациента, ожидаемую продолжительность жизни, наличие осложнений и сопутствующих заболеваний, риск развития тяжелых гипогликемий, предпочтения больного по режиму введения инсулина.
ЗАКЛЮЧЕНИЕ
Учитывая изложенные данные, можно заключить что применение Росинсулина М микс 30/70 позволяет эффективно и без увеличения ИМТ на фоне незначительного количества легких гипогликемических состояний, без риска тяжелой гипогликемии, местных реакций и нежелательных явлений улучшить показатели углеводного обмена у больных СД2, не достигающих целевых значений гликемии на фоне проводимой терапии пероральными сахароснижающими препаратами. Режим инъекций комбинированного инсулина 2 раза в сутки в дополнение к метформину для пациентов с СД просто реализовать в качестве первого этапа введения инсулина.
Работа выполнена в рамках бюджетной темы ГЗ № 032420180001, рег. № ААААА171171128502802.








