Гиперандрогенемия — клинически значимое повышение уровней андрогенов в крови женщины — является распространенным эндокринным нарушением. По данным разных авторов, она встречается у 10–15% женщин репродуктивного возраста, у 15–20% пациенток с бесплодием, у 50–60% — с ановуляторным бесплодием [1–8]. Так как ановуляция — следствие эндокринных нарушений, можно сделать вывод о том, что гиперандрогенемия становится ведущей причиной эндокринного бесплодия. Повышение уровней андрогенов в крови может быть обусловлено различными заболеваниями, поэтому в каждом случае выявления гиперандрогенемии требуется дифференциальнодиагностический поиск для правильной диагностики заболевания.
Главным андрогеном является тестостерон (Т). Синтез Т в организме женщин происходит в яичниках, надпочечниках и жировой ткани [1]. Только очень небольшая доля от общего пула Т — 0,7–1% — циркулирует в плазме крови в свободном (биологически активном) виде. Основное количество циркулирующего Т связано с белками крови: до 25% находится в мобильном соединении альбумином и до 70–75% — с глобулином, который и носит название глобулина, связывающего половые гормоны (ГСПГ). Если концентрация альбумина в отсутствие серьезных заболеваний не подвергается значительным колебаниям, то концентрация ГСПГ может быть вариабельна (например, при инсулинорезистентности уровень ГСПГ значительно снижен), поэтому наличие гиперандрогенемии зависит от продукции не только Т, но и ГСПГ. Под воздействием двух основных ферментов из Т образуются другие гормоны: при участии ароматазы синтезируется эстрадиол, а при участии 5αредуктазы — дигидротестостерон, влияющий преимущественно на кожу.
Еще одним значимым андрогеном является дегидроэпиандростерона сульфат (ДГЭАС), который синтезируется преимущественно в надпочечниках. В физиологических условиях концентрация ДГЭАС в организме значительно превышает содержание других стероидных гомонов. Помимо Т и ДГЭАС, слабой андрогенной активностью обладают гормоныпредшественники андростендион и дегидроэпиандростерон, однако их физиологическое значение ограничено.
Исходя из особенностей физиологической секреции андрогенов, можно определить и возможные механизмы развития гиперандрогенемии, среди которых повышение уровней:
- общего Т (и ДГЭАС) вследствие их избыточного синтеза на фоне тех или иных заболеваний;
- свободного Т за счет снижения концентрации ГСПГ;
- общего Т за счет уменьшения его превращения в эстрадиол на фоне снижения активности ароматазы;
- дигидротестостерона за счет роста активности 5αредуктазы.
КЛИНИЧЕСКАЯ ДИАГНОСТИКА ГИПЕРАНДРОГЕНЕМИИ
К классическим клиническим проявлениям гиперандрогенемии относятся нарушения менструального цикла и дерматологические симптомы [2–4, 8–10].
Среди нарушений менструального цикла при гиперандрогенемии чаще встречается гипоменструальный синдром (олиго и/или опсоменорея, аменорея), но могут наблюдаться и аномальные маточные кровотечения [3]. Тем не менее у ряда пациенток может быть и овуляторный цикл с полноценной лютеиновой фазой. При регулярном менструальном цикле у женщин с кожными признаками гиперандрогенемии требуется фолликулометрия для подтверждения/исключения овуляторной дисфункции.
Характерные кожные симптомы гиперандрогенемии — гирсутизм, акне и андрогенная алопеция. Два последних (акне и алопеция) не являются самостоятельными клиническими маркерами гиперандрогенемии и имеют диагностическую значимость только при сочетании с овуляторной дисфункцией или другими проявлениями гиперандрогенемии (поликистозными изменениями структуры яичников, прибавкой массы тела, негроидным акантозом и пр.) [2, 8].
Гирсутизмом называют избыточный рост терминальных (стержневых, жестких и пигментированных) волос у женщин в условно выделенных андрогензависимых зонах. Оценка гирсутизма проводится визуально, наиболее часто применяют модифицированную шкалу Ферримана — Галлвея [4, 8, 11]. Интенсивность роста волос в выделенных зонах оценивается в баллах, сумма баллов определяет наличие и выраженность избыточного роста волос.
По данным различных исследований, о наличии гирсутизма свидетельствует сумма баллов ≥ 6–8 для представительниц европеоидной и негроидной рас [5–7, 12] и ≥ 3–6 для представительниц азиатской расы [13, 14]. Гирсутизм легкой степени диагностируется, если сумма баллов варьирует от 8 до 15 баллов, умеренной степени — от 16 до 25 баллов, выраженному (тяжелому) гирсутизму соответствует сумма баллов более 25. Выраженность гирсутизма обычно не коррелирует с уровнями андрогенов [2, 4]. Этот факт можно объяснить тем, что рост волос зависит не только от уровней гормонов, но и от плотности распределения андрогеновых рецепторов, а также от их индивидуальной функциональной активности.
К клиническим проявлениям гиперандрогенемии также относят прибавку массы тела, перераспределение жировой ткани по абдоминальному типу, повышение АД и гликемии [8, 15–18].
ПРИЧИНЫ ГИПЕРАНДРОГЕНЕМИИ
Наиболее частой причиной гиперандрогенемии является синдром поликистозных яичников (СПКЯ), который выявляется примерно у 70% женщин с гиперандрогенемией [2, 4, 8, 15–18]. Тем не менее СПКЯ — это диагноз исключения, т. е. должны быть исключены другие эндокринопатии, которые могут сопровождаться нарушениями менструального цикла и гиперандрогенемией. Суммируя рекомендации различных профессиональных сообществ, можно сказать, что к этим эндокринопатиям в первую очередь относятся неклассическая форма врожденной дисфункции коры надпочечников (нкВДКН), гиперпролактинемия, гипотиреоз, реже встречаются андрогенпродуцирущие опухоли, синдром HAIRAN, синдром гиперкортицизма, акромегалия [2, 4, 8–10, 16, 18]. Общество по избытку андрогенов также советует рассматривать возможность идиопатического гирсутизма (гирсутизм на фоне нормальных концентраций андрогенов, овуляторного регулярного цикла и нормальной морфологической структуры яичников) и идиопатической гиперандрогенемии (биохимически подтвержденная гиперандрогенемия у женщин с регулярным менструальным циклом и нормальной морфологической структурой яичников в отсутствие других эндокринных расстройств) [8, 17, 18]. Возможные причины гиперандрогенемии суммированы в таблице.
Таблица
Причины, проявления, диагностика и лечение гиперандрогенемии
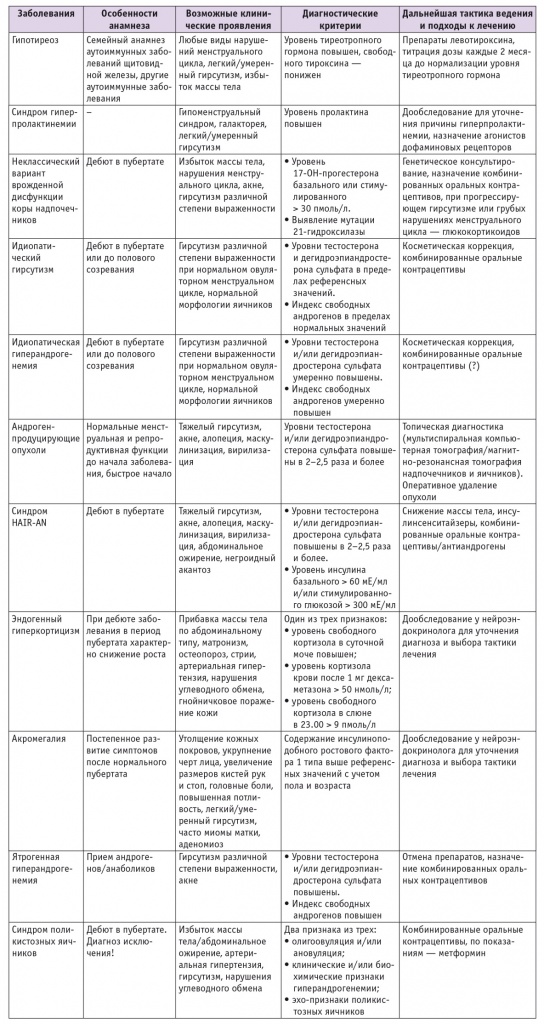
Как при гиперпролактинемии, так и при гипотиреозе снижается активность ароматазы, вследствие чего тормозится синтез эстрадиола из Т, и, соответственно, концентрация последнего повышается. Эти эндокринопатии часто сопровождаются нарушениями менструального цикла и фертильности, а также прибавкой массы тела, поэтому фенотип может быть схожим с СПКЯ.
При нкВДКН существенно повышается синтез андрогенов в коре надпочечников вследствие изменения активности ферментов, участвующих в синтезе кортизола. Наиболее часто это дефицит 21гидроксилазы — микросомального Р450зависимого фермента, который участвует в синтезе глюко и минералокортикоидов. В зависимости от степени снижения активности 21гидроксилазы выделяют различные клинические формы заболевания, которые обусловлены конкретной мутацией в гене CYP21. При неклассической форме заболевания сохраняется 20–30% от исходной активности фермента [9, 10, 19, 20]. Синтез минералокортикоидов при этом не страдает, снижается только синтез кортизола на этапе превращения 17ОНпрогестерона (17αгидроксипрогестерона) в дезоксикортизол (предшественник кортизола), что вызывает компенсаторное повышение секреции адренокортикотропного гормона. Надпочечники активно секретируют стероиды, предшествующие ферментативному блоку, в том числе 17ОНпрогестерон и андрогены, биосинтез которых не зависит от 21гидроксилазы. У девочек с нкВДКН может отмечаться небольшое ускорение процессов роста и костного созревания, однако конечный рост обычно не отличается от генетически детерминированного [9]. Характерным клиническим признаком является раннее адренархе (до 8 лет), опережающее телархе [9].
Синдром HAIRAN наблюдается приблизительно у 3% пациенток с гиперандрогенемией и проявляется более высокими уровнями андрогенов (по сравнению с СПКЯ) на фоне выраженной инсулинорезистентности и гиперинсулинемии [21]. Обычно этот синдром объединяет несколько схожих по клинической картине наследственных заболеваний — от разновидностей семейной липодистрофии до точечных мутаций генов рецептора инсулина, включая синдромы инсулинорезистентности типов А и В. Среди характерных клинических симптомов можно отметить абдоминальное ожирение и негроидный акантоз у пациенток с тяжелым гирсутизмом и алопецией [21].
Андрогенпродуцирующие опухоли встречаются относительно редко, среди причин гиперандрогенемии их доля составляет всего 0,1–3%. Из особенностей клинической картины заболевания, помимо аменореи, можно отметить признаки маскулинизации (снижение тембра голоса, увеличение мышечной массы) и вирилизации (увеличение клитора). Обычно заболеванию предшествует длительный период нормальной менструальной функции, возраст пациенток — старше 30 лет [22].
Акромегалия — нейроэндокринное заболевание, симптомокомплекс которого возникает на фоне избыточной секреции гормона роста опухолью гипофиза. Акромегалия в большинстве случаев диагностируется во время перехода к менопаузе или в постменопаузе, однако первые признаки заболевания, включающие нарушения менструального цикла, примерно у 50% пациенток появляются в репродуктивном периоде [9, 10]. Акромегалию следует заподозрить, если у женщины есть жалобы на утолщение кожных покровов, увеличение размеров кистей рук и стоп, укрупнение черт лица, избыточную потливость; также могут встречаться АГ, нарушения углеводного обмена, боли в суставах, изменение прикуса, огрубение голоса и другие проявления [10, 23, 24].
Синдром эндогенного гиперкортицизма — избыточная секреция гормонов коры надпочечников, в том числе и андрогенов. Он является относительно редким заболеванием, тем не менее необходимо рассматривать возможность его наличия у пациенток с гиперандрогенемией и прибавкой массы тела по абдоминальному типу. Могут наблюдаться и такие клинические признаки, как лунообразное лицо (матронизм), истончение кожи, мышечная слабость, нарушения углеводного обмена и другие [9, 10, 25].
ГОРМОНАЛЬНАЯ ДИАГНОСТИКА ГИПЕРАНДРОГЕНЕМИИ
Общество по избытку андрогенов рекомендует проводить обследование женщин с гирсутизмом вне зависимости от степени его тяжести и наличия менструальной дисфункции [8, 17, 18]. Вопервых, как уже отмечалось выше, выраженность гирсутизма не коррелирует с тяжестью гиперандрогенемии. В таких случаях следует обращать внимание на другие кожные проявления гиперандрогенемии, а также на метаболические нарушения, которые более значимо коррелируют со степенью повышения уровней андрогенов [8, 15–17]. Вовторых, регулярные менструальные циклы могут быть ановуляторными [2, 3, 9, 20, 26]. С другой стороны, при нкВДКН у 50–55% женщин могут наблюдаться регулярные овуляторные циклы [9, 17, 18, 20, 26], что не исключает наличие гиперандрогенемии. Однако нкВДКН ассоциирована с высоким риском заболеваемости потомства и в каждом случае требует генетического консультирования [20, 26]. Кроме того, существует овуляторный вариант СПКЯ [8, 15–17]. Поэтому если ранее рекомендовали исключение гиперандрогенемии при умеренном и тяжелом гирсутизме (≤ 16 баллов по шкале Ферримана — Галвея) в случае его прогрессирования и сочетания с нарушениями менструального цикла и другими кожными проявлениями гиперандрогенемии, то в настоящее время показания для обследования расширились [2–4, 8, 15–18].
Исследованием первой линии является определение уровня общего Т [8, 16–18, 27, 28]. Так как Т секретируется и яичниками, и надпочечниками, повышение уровня общего Т может отмечаться при гиперандрогенемии как овариального, так и надпочечникового генеза.
В настоящее время предъявляются высокие требования к методам определения концентрации Т. Применение ИФА признано недостаточно точным, особенно в случаях небольшого/умеренного повышения уровня гормона, которые и составляют большинство наблюдений [28–31]. Наиболее чувствительными и специфичными методами определения содержания общего Т считаются газовая или жидкостная хроматография с массспектрометрией (GC–MS или LC–MS) и радиоиммуный анализ с экстракцией органическими растворителями и последующей хромотографией [29–31]. Желательно, чтобы лаборатории имели собственные диапазоны референсных значений для указанных гормонов, полученные в ходе локальных популяционных исследований [28, 30].
Высоконормальный уровень общего Т (т. е. уровень в пределах верхней квартили референсных значений) не исключает наличие биохимической гиперандрогенемии и может маскировать избыток андрогенов за счет снижения содержания ГСПГ [27, 32, 33]. Если у пациентки с клиническими признаками гиперандрогенемии уровень общего Т не выходит за пределы референсных значений, требуется определение концентрации свободного Т и/или ГСПГ [27]. К сожалению, до сих пор доступные методики исследования свободного Т не отличаются необходимой точностью и дешевизной [30]. Поэтому многие эксперты рекомендуют измерение концентрации ГСПГ с подсчетом индекса свободных андрогенов (ИСА) по формуле:
ИСА = [общий Т (нмоль/л)/ГСПГ (нмоль/л)] × 100.
ИСА не имеет единиц измерения и у здоровых женщин обычно находится в пределах 7–10 [34]. Хотелось бы подчеркнуть, что ИСА не эквивалентен концентрации свободного Т, но является самостоятельным методом диагностики. Этот показатель считается наиболее чувствительным методом диагностики гиперандрогенемии у пациенток с СПКЯ [17, 18, 27].
ДГЭАС — преимущественно продукт коры надпочечников. Повышение его содержания заставляет подумать о наличии гиперандрогенемии надпочечникового генеза. Тем не менее умеренное повышение концентрации ДГЭАС отмечается у трети пациенток с СПКЯ [35] (с моделью овариальной гиперандрогенемии).
Определение уровня андростендиона с целью диагностики гиперандрогенемии не показано. Андростендион обладает слабой андрогенной активностью и является гормономпредшественником для Т. Результаты недавних исследований показали, что при СПКЯ повышение уровня андростендиона и индекса «андростендион/общий Т» ассоциировано с более выраженными метаболическими нарушениями [36, 37]. Однако речь шла о повышении уровня андростендиона у пациенток с подтвержденным диагнозом СПКЯ, а не о возможности применения андростендиона в диагностике гиперандрогенемии. Референсные значения концентрации андростендиона не стандартизированы в большинстве лабораторий, поэтому ее определение с диагностической целью на сегодняшний день имеет много ограничений.
ВЫЯВЛЕНИЕ ПРИЧИН ГИПЕРАНДРОГЕНЕМИИ И ОПРЕДЕЛЕНИЕ ТАКТИКИ ЛЕЧЕНИЯ
После подтверждения биохимической гиперандрогенемии необходимо поставить правильный диагноз, который будет определять дальнейшую тактику ведения пациентки (см. табл.).
При выявлении гиперпролактинемии требуется дальнейшее обследование согласно Федеральным клиническим рекомендациям [9, 38], после постановки точного диагноза определяется лечебная тактика. В большинстве случаев гиперпролактинемии средства терапии первой линии — агонисты дофаминовых рецепторов. При обнаружении гипотиреоза пациентка нуждается в назначении препаратов левотироксина с титрацией дозы до нормализации уровня тиреотропного гормона [9]. После достижения нормопролактинемии и/или эутиреоза проводится повторная оценка уровней андрогенов, и, если сохраняется гиперандрогенемия, продолжается поиск причин повышения уровней андрогенов (например, известно сочетание гиперпролактинемии и СПКЯ).
Критерием диагностики нкВДКН является значимое1 повышение базального уровня 17ОНпрогестерона в образце крови, взятом в ранние утренние часы (7.00–8.00) [8–10, 19, 20, 26]. Базальные концентрации 17ОНпрогестерона ниже этого порога, но выше 6 пмоль/л считаются пограничными, в таких случаях рекомендуется проведение стимуляционного теста с адренокортикотропным гормоном 1–24; уровень 17ОНпрогестерона > 30 пмоль/л в ходе теста подтверждает наличие ВДКН (при неклассической форме этот показатель обычно не превышает 300 пмоль/л). При базальной концентрации 17ОНпрогестерона < 6 пмоль/л и стимулированной < 30 пмоль/л диагноз нкВДКН маловероятен [10, 18–20].
При подтверждении диагноза решается вопрос о назначении глюкокортикоидов (ГК) и/или КОК. ГК назначают пациенткам с нкВДКН при наличии симптомов прогрессирующей гиперандрогенемии: гирсутизма, олигоменореи, бесплодия, вторичных поликистозных изменений яичников [9, 10, 19, 20]. Доза ГК подбирается индивидуально и титруется под контролем уровня общего Т в крови, который следует поддерживать на верхней границе референсных значений (при этом уровень 17ОНпрогестерона может оставаться повышенным) [9, 20]. Из препаратов ГК предпочтение отдается лекарственным средствам со свойствами, наиболее приближенными к физиологическим, — гидрокортизону или преднизолону. Метилпреднизолон и дексаметазон имеют более длительный период полувыведения, чаще ассоциированы с симптомами передозировки ГК и менее приемлемы для длительной заместительной терапии. У пациенток с легкими/умеренными признаками гирсутизма и регулярным менструальным циклом с косметической целью также рекомендуется использовать КОК [2–4, 9, 10, 19, 20, 39].
При андрогенпродуцирующих опухолях уровни андрогенов превышают верхнюю границу референсных значений в 2–2,5 раза и более [3, 8, 10, 22]. Возможными методами топической диагностики являются экспертное УЗИ яичников, МСКТ/МРТ яичников и надпочечников. Лечение — оперативное.
Схожее с опухолевым процессом повышение уровней андрогенов в сочетании с лабораторно доказанной гиперинсулинемией (уровень инсулина базальный > 60 мЕ/мл и/или стимулированный глюкозой > 300 мЕ/мл) свидетельствуют в пользу синдрома HAIRAN. В таких случаях лечение — комплексное, направленное на поддержание массы тела, преодоление инсулинорезистентности/повышение инсулиночувствительности [3, 21, 40]. При отсутствии противопоказаний возможно применение КОК.
В заключение диагностического поиска рассматривается возможность постановки диагноза СПКЯ (диагноз исключения), для чего требуется наличие двух диагностических
признаков из трех возможных [3, 8, 15–18, 27, 32, 33]:
- олиго или ановуляции;
- клинических/биохимических признаков гиперандрогенемии;
- эхопризнаков поликистозных яичников (т. е. объем яичника ≥ 10 см3 и/или наличие 25 фолликулов и более диаметром от 2 мм до 9 мм в эхографическом срезе каждого яичника при трансвагинальном исследовании с использованием высокочастотных датчиков).
Тактика лечения СПКЯ зависит от клинической симптоматики и часто включает КОК (первая линия лечения гирсутизма и акне), метформин (при наличии нарушений углеводного обмена), препараты для нормализации жирового обмена и функции печени [8, 15, 16, 32, 33].
КОМБИНИРОВАННЫЕ ОРАЛЬНЫЕ КОНТРАЦЕПТИВЫ В ЛЕЧЕНИИ НАИБОЛЕЕ ЧАСТЫХ ПРИЧИН ГИПЕРАНДРОГЕНЕМИИ
КОК обладают свойствами, которые используют с лечебной целью при таких гиперандрогенных состояниях, как СПКЯ, нкВДКН, идиопатическая гиперандрогенемия [2–4, 8–10, 15–18, 20, 27, 32, 33, 39]. При пероральным приеме этинилэстрадиол, проходя через печень, существенно активизирует синтез ГСПГ, поэтому увеличивается доля связанного Т и снижается содержание его свободной фракции. Кроме того, на фоне приема КОК блокируется выработка гипофизарного ЛГ, стимулирующего клетки теки яичников, таким образом снижается и синтез андрогенов.
Дополнительного косметического эффекта можно добиться при использовании КОК, в состав которых входят гестагены с антиандрогенными свойствами — ципротерона ацетат, дроспиренон, хлормадинона ацетат, диеногест. Эти типы гестагенов конкурентно ингибируют андрогенные рецепторы, блокируя действие циркулирующих андрогенов и снижая их биологические эффекты. Хотелось бы более подробно остановиться на свойствах дроспиренона, оказывающего не только антиандрогенное, но и антиминералокортикоидное действие [41].
Систематический обзор 18 рандомизированных контролируемых исследований применения различных КОК у женщин с СПКЯ продемонстрировал эффективность дроспиренонсодержащих препаратов в нормализации гормонального баланса и показателей углеводного и жирового обмена. По сравнению с ципротерона ацетатом и диеногестом дроспиренон обладал сходной или более высокой кардиопротективной активностью [42].
На фоне применения КОК отмечается повышение частоты венозных тромбозов, однако это не связано с видом гестагенов. В проспективном контролируемом неинтервенционном когортном исследовании, выполненном в 2285 центрах США и 6 европейских стран с участием 85 109 женщин, был отмечен сходный профиль безопасности у КОК, содержащих дроспиренон (24дневные и 21дневные схемы), левоноргестрел или другие гестагены [43]. У женщин, получавших различные препараты, не различалась частота венозных и артериальных тромбозов, фатальных исходов, онкологических заболеваний, тяжелой депрессии и других серьезных событий [43].
Таким образом, дроспиренонсодержащие оральные контрацептивы обладают доказанной эффективностью и безопасностью, что позволяет их успешно использовать в широкой клинической практике у пациенток с гиперандрогенными заболеваниями.
ЗАКЛЮЧЕНИЕ
Гиперандрогенемия — распространенное эндокринное расстройство. Главными клиническими маркерами гиперандрогенемии являются кожные проблемы (гирсутизм, акне и алопеция) и нарушения менструального цикла по типу гипоменструального синдрома, однако могут возникнуть и абдоминальное ожирение, и другие проявления. Подтверждение биохимической гиперандрогенемии — не заключительный, а начальный этап обследования, и требуется дифференциальнодиагностический поиск ее причин.
Наиболее частой причиной гиперандрогенемии является синдром поликистозных яичников (СПКЯ), однако СПКЯ — это диагноз исключения, т. е. должны быть исключены другие эндокринопатии, которые могут сопровождаться нарушениями менструального цикла и гиперандрогенемией. К ним относятся неклассическая форма врожденной дисфункции коры надпочечников (нкВДКН), гиперпролактинемия, гипотиреоз, реже встречаются андрогенпродуцирущие опухоли, синдром HAIRAN, синдром гиперкортицизма, акромегалия. КОК являются важной составляющей лечения СПКЯ, нкВДКН и некоторых других гиперандрогенных состояний.
___________________________
[1] Более 15 пмоль/л согласно [8], более 30 пмоль/л согласно [10, 24].








