ВВЕДЕНИЕ
Диабетическая нефропатия (ДН) занимает второе место после сердечно-сосудистых заболеваний в структуре причин смерти больных СД 1 типа, а при СД 2 типа — третье место после сердечно-сосудистых и онкологических заболеваний[1]. Согласно данным Федерального регистра, распространенность хронической болезни почек (ХБП) при СД среди взрослых пациентов составляет в России 49,95%, а частота регистрации новых случаев ХБП с 2013 по 2016 г. у больных СД 1 типа возросла в 2 раза, СД 2 типа — в 3,7 раза[2].
За последнее десятилетие изменились критерии и стандарты диагностики ХБП при СД, чему способствовало обнаружение факта нормоальбуминурии при сниженной скорости клубочковой фильтрации у большинства пациентов, особенно с СД 2 типа.
Данные 327 аутопсий больных показали, что спектр поражения почек при СД включает практически все морфологические варианты почечной патологии, а хронический пиелонефрит встречается так же часто (27,6% случаев), как и диабетический нефросклероз (23,9%)[3]. Изучая структуру причин ХБП при СД, М.В. Шестакова установила, что первое место среди них занимает мочевая инфекция — 60% [4]. По данным отечественной и зарубежной научной литературы, инфекция мочевых путей (ИМП) встречается у больных СД в 5–7 раз чаще, чем в общей популяции, что позволило, основываясь на характере течения ИМП на фоне СД, отнести ее к осложненным формам[5].
Причины столь высокой частоты инфицирования мочевого тракта при СД связаны с наличием не только общепопуляционных факторов риска, но и специфических для СД: гипергликемии и эндотелиальной дисфункции с нарушением ангиогенеза и гемостаза, глюкозурии (повреждающего фактора серозно-мукоидного слоя уроэпителия); микро- и макроангиопатий, приводящих к ишемии почек; нейропатии мочевого пузыря, нарушающей пассаж мочи; со снижением иммунной защиты.
Установлено, что у больных СД имеется вторичный иммунодефицит (ВИД)[6], который может ухудшить течение инфекционного процесса: замедлить процесс его купирования, привести к хронизации заболевания.
Несмотря на широкую распространенность ИМП у больных СД, ее участие в декомпенсации углеводного обмена, возникновении кетоацидоза, нередко неудовлетворительном исходе лечения, а также роль иммунных механизмов в развитии и течении ИМП у больных СД как фактора прогрессирования ДН в настоящее время изучены недостаточно. Известно, что воспаление верхних отделов мочевых путей прежде всего затрагивает интерстициальную ткань почек. Тубулоинтерстициальное воспаление с переходом в фиброз ускоряет развитие ДН. Поэтому профилактика обострений ИМП вносит значительный вклад в замедление прогрессирования ДН.
Состояние иммунитета макроорганизма во многом определяет, разовьется ли воспалительный процесс и то, каковы будут его выраженность и характер течения.
Механизмы иммунного реагирования у больных только ИМП и ИМП на фоне СД могут быть разными, этим, по-видимому, и объясняются бо́льшая частота встречаемости ИМП на фоне СД, различия в клинической симптоматике, характере течения заболевания, исходах ИМП при СД.
В конце XX века с внедрением методов оценки иммунного статуса в научную и клиническую практику интерес к изучению показателей врожденного и адаптивного иммунитета при различных заболеваниях и коморбидных состояниях значительно возрос. Были исследованы отдельные звенья иммунитета (клеточное, гуморальное) у больных ИМП, причем только одно исследование проведено у больных ИМП на фоне СД. Доказано, что на фоне ИМП у больных СД развивается ВИД, который требует иммунокоррекции.
В последние 20 лет с появлением современных безопасных иммуномодуляторов для обоснования их применения были проведены научные исследования у пациентов терапевтического и хирургического профиля. Изучены иммунологические показатели при ИМП с вторичным пиелонефритом на фоне нарушения пассажа мочи в урологической практике, в т. ч. у детей[7]. Ряд работ посвящен изучению иммунного статуса при остром пиелонефрите у больных СД[8]. Однако в отечественной научной литературе отсутствуют сведения о характере иммунного реагирования у пациентов с СД на фоне обострения хронической ИМП.
В зарубежной литературе нет данных о включении иммуномодуляторов в лечение инфекций в клинике внутренних болезней, в том числе при СД. Видимо, эта рекомендация считается недостаточно обоснованной с точки зрения доказательной медицины, хотя еще в 2000 г. зарубежные ученые высказали мысль о том, что применение только антибактериальных препаратов при лечении ИМП является принципиальной ошибкой, поскольку инфекция — это лишь пусковой механизм воспалительного процесса[9].
В России боле 50 лет успешно развиваются иммунофармакология и иммунотерапия в различных областях медицины. Группа ученых на основании иммунологического анализа больных с острой ИМП и обострением ее хронической формы, особенностей их течения разработала показания для назначения адресных корригирующих препаратов с использованием инновационных аналитических технологий[10]. Таким образом, наличие ВИД как при СД, так и при ИМП и неэффективность только антибактериальной терапии определили цель нашего исследования — выяснить целесообразность включения иммуномодулятора Имунофана в терапию обострения ИМП у больных СД 2 типа.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проводилось с 2017 по 2019 г. на базе ФГБОУ ВО БГМУ Минздрава России.
Критерии включения: наличие СД 2 типа; верифицированный диагноз ИМП; разрешение пациентов на исследование, подтвержденное подписью в письменном информированном согласии.
Критерии невключения: беременность и лактация; наличие острого воспалительного процесса или обострения хронического заболевания, кроме ИМП; онкологические, психические, атопические, системные и другие эндокринологические заболевания; хроническая почечная недостаточность; острые осложнения диабета.
Согласно Российским клиническим рекомендациям урологов 2016 г., критериями верификации диагноза ИМП у взрослых при соответствующей клинике служили следующие показатели:
- лейкоцитурия более 6 лейкоцитов в поле зрения в общем анализе мочи или более 4 × 103/мл в пробе по Нечипоренко;
- эритроцитурия (более 2 × 103/мл в пробе по Нечипоренко);
- протеинурия (в пределах 0–1 г/сут);
- бактериурия 1 × 104 КОЕ и более в 1 мл мочи при отсутствии клинической картины;
- ультразвуковые признаки: отек паренхимы почек при обострении; уменьшение размеров почки, ее деформация, повышенная эхогенность паренхимы (признаки нефросклероза) при длительно текущем пиелонефрите вне обострения при экскреторной урографии, проведенной с целью уточнения состояния мочевыводящих путей и диагностики нарушения пассажа мочи[5].
Диагноз СД 2 типа устанавливался, согласно Алгоритмам специализированной медицинской помощи больным СД (9-й выпуск, 2019 г.). Коррекция диабета проводилась индивидуально с учетом уровня гликемии.
В исследование включены 125 человек: 35 практически здоровых людей (контрольная группа); 30 больных СД без ИМП; 30 пациентов с ИМП на фоне СД 2 типа, получавших традиционную антибактериальную и симптоматическую терапию, и 30 больных СД 2 типа и ИМП, получавших кроме традиционной терапии иммуномодулятор аргинил-альфа-аспартил-лизил-валил-тирозил-аргинин (Имунофан) 1 мл в/м 1 раз в сутки в течение 10 дней. У всех участников выполнены:
- общий анализ крови;
- биохимическое исследование венозной крови;
- общий анализ мочи до лечения и после его проведения;
- бактериологическое исследование по методу Гоулда с определением чувствительности микроорганизмов к антибиотикам;
- УЗИ почек.
Обследование проводилось в 1-е сутки с момента обострения ИМП и начала терапии и через 8 недель, в фазу реконвалесценции.
Содержание цитокинов ИЛ-4, ИЛ-6, ИЛ-1β и ФНО-α в сыворотке крови определяли методом ИФА с применением поликлональных антител к ИЛ-4, ИЛ-6, ИЛ-1β и ФНО-α (тест-системы ЗАО «Вектор-Бест», г. Новосибирск). Для измерения уровней СD3, CD4, CD8, СD16, HLA-DR использовались моноклональные антитела, имеющие флуоресцентные метки. Концентрации иммуноглобулинов классов А, М, и G определяли в сыворотке крови обследуемых путем радиальной иммунодиффузии в геле методом Манчини (1965). Фагоцитарную активность лейкоцитов (ФАЛ) — процент активных фагоцитов от общего их числа — оценивали микроскопически после окрашивания мазков венозной крови по Романовскому — Гимзе азур-эозином.
Статистическую обработку проводили с использованием методов вариационной статистики, пакета программ Statistica 10. Проверку на нормальность распределения данных выполняли с помощью критерия Шапиро — Уилка. Значимости различий оценивали при вычислении медианы и интерквартильного интервала между 25-м и 75-м процентилями.
При сравнении значимости различий двух независимых групп по количественному признаку применяли непараметрический метод проверки статистических гипотез — критерий Манна — Уитни, двух зависимых групп — критерий Вилкоксона. Критический уровень значимости р для статистических критериев принимали равным 0,05.
РЕЗУЛЬТАТЫ
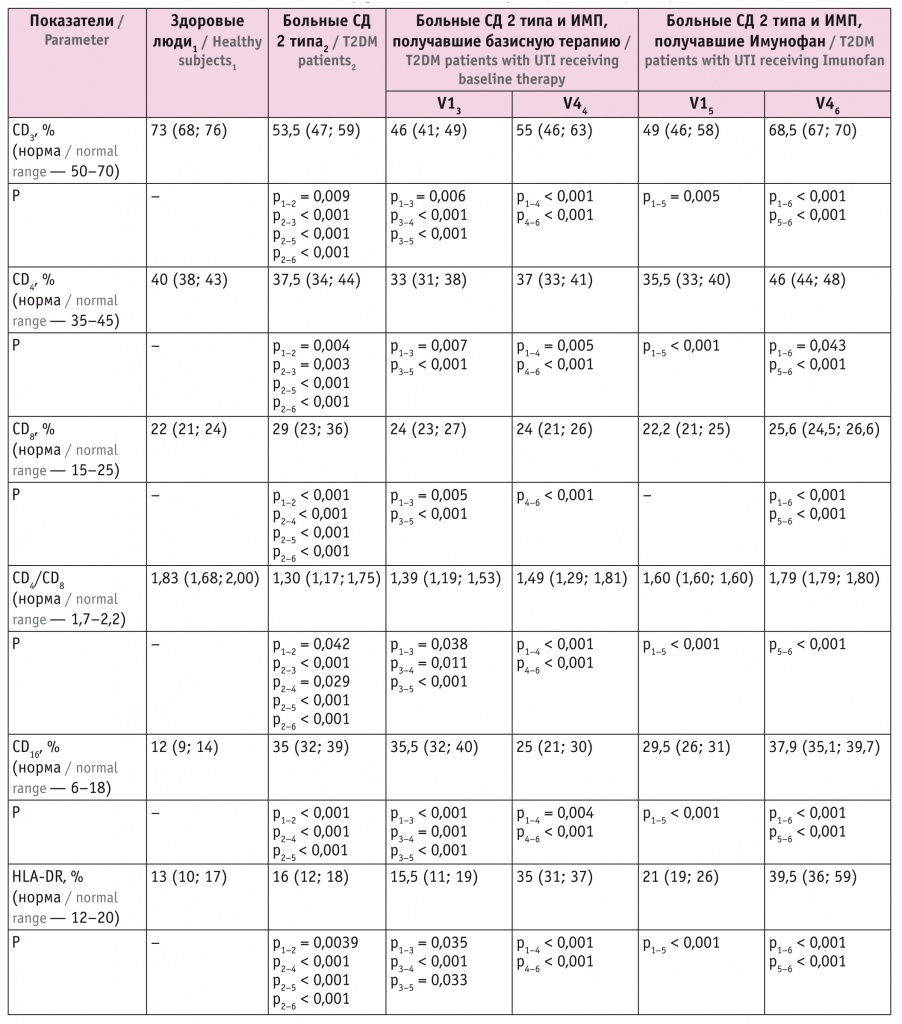
У пациентов с СД 2 типа и ИМП в острую фазу инфекции (V1) содержание Т-лимфоцитов СD3, CD4, иммунорегуляторный индекс (ИРИ) CD4/CD8 были снижены по сравнению с таковыми у здоровых лиц и у больных только СД.
Уровни лимфоцитов CD8 не отличались от аналогичных показателей контрольной группы, однако были значимо ниже, чем у больных СД 2 типа без ИМП.
Уровни натуральных киллеров (NK) — лимфоцитов CD16 у участников с СД и ИМП оказались существенно выше, чем у здоровых лиц, но меньше, чем у пациентов только с СД.
Количество активированных лимфоцитов (HLA-DR) превысило показатель контрольной группы, но не отличалось от аналогичного показателя у больных СД без ИМП (табл. 1).
Таблица 1
Показатели клеточного иммунитета у участников исследования, Ме (25; 75)
Примечание. Здесь и далее в таблицах: ИМП — инфекция мочевых путей, СД — сахарный диабет, V1 — до лечения, V4 — через 8 недель лечения.
На фоне традиционной базисной терапии ИМП общая популяция Т-лимфоцитов (СD3, СD4) увеличилась, ИРИ также значительно вырос, однако даже через 8 недель не достиг нижней границы нормы и показателя контрольной группы. Уровни NK (СD16) снизились, но не до показателя здоровых людей.
Включение в базисную терапию иммуномодулятора Имунофана способствовало коррекции иммунологического статуса: наблюдалось более значительное повышение концентраций Т-лимфоцитов СD3, СD4 и ИРИ (CD4/CD8). Содержание СD3, хотя и не достигло аналогичного показателя у практически здоровых лиц, находилось ближе к верхней границе нормы. Через 8 недель уровни СD4 выросли и, находясь в пределах нормальных значений, превысили показатель у здоровых людей.
Содержание СD8 под влиянием Имунофана несущественно повысилось (почти в пределах нормальных значений).
В результате количественных изменений Т-хелперов и Т-супрессоров сниженный ИРИ у получавших Имунофан больных восстановился до показателя участников контрольной группы. Субпопуляция СD16 продолжала увеличиваться и через 8 недель достигла уровня таковой у больных СД без ИМП. Содержание HLA-DR под влиянием Имунофана превысило верхнюю границу нормального диапазона.
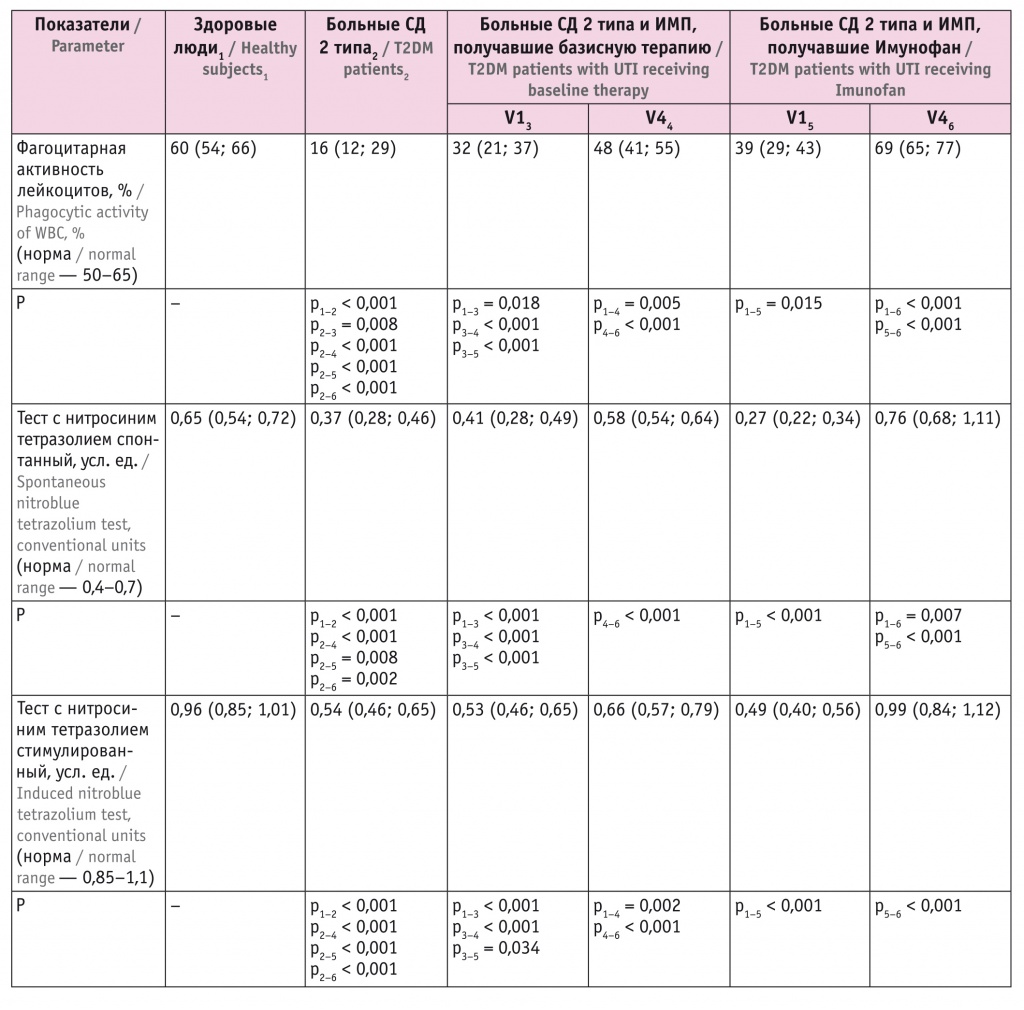
У всех больных СД 2 типа (с и без ИМП) были снижены все изучаемые показатели фагоцитарного звена врожденного иммунитета: ФАЛ, спонтанный и стимулированный тесты с нитросиним тетразолием (НСТ сп. и НСТ ст.) (табл. 2). В результате базисной терапии показатели фагоцитоза повысились: ФАЛ и НСТ сп. — до нижнего референсного значения, а НСТ ст. даже не достиг его. Терапия Имунофаном восстановила сниженные показатели: ФАЛ выросла до уровня у участников контрольной группы через 2 недели лечения, а через 8 недель (V4) превысила его и референсные значения. Показатель НСТ сп. в острую фазу ИМП был даже ниже, чем у больных СД без ИМП. Через 8 недель, в фазу поздней реконвалесценции, на фоне лечения Имунофаном он стал выше аналогичного показателя у здоровых лиц. Значение НСТ ст. достигло нижней границы нормы через 4 недели, а значения здоровых людей — через 8 недель.
Таблица 2
Показатели фагоцитарной активности лейкоцитов у участников исследования, Ме (25; 75)
Содержание IgМ у больных из группы Имунофана не отличалось от такового у участников контрольной группы, но было выше сниженного уровня у больных СД 2 типа без ИМП и в процессе комплексного лечения с включением Имунофана не изменилось (табл. 3).
Таблица 3
Показатели основных фракций иммуноглобулинов у участников исследования, Ме (25; 75)
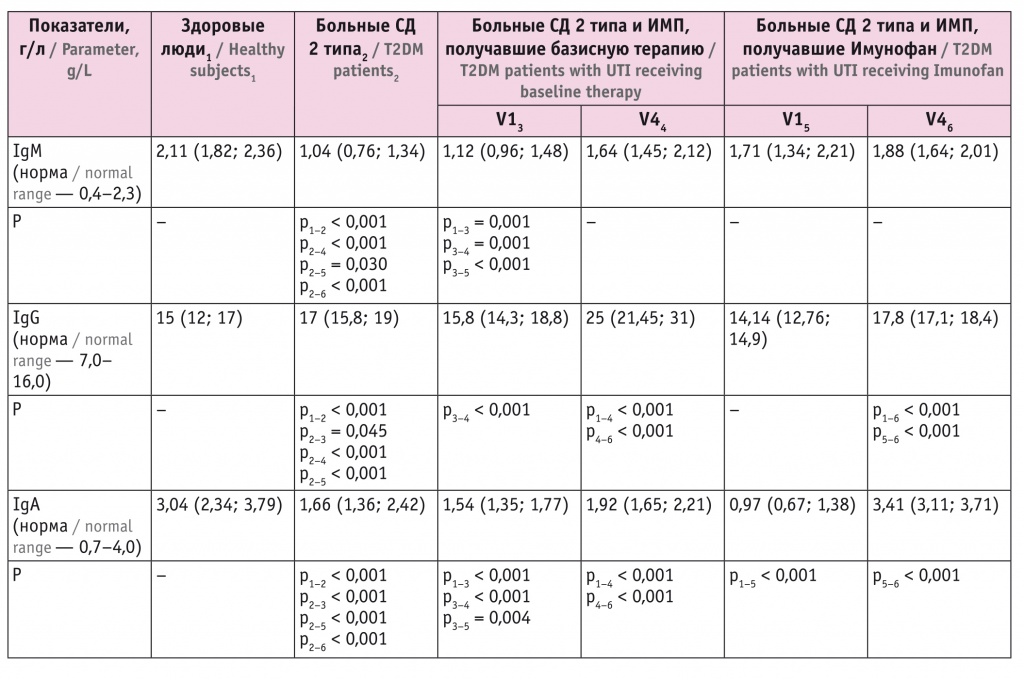
Уровень IgG при ИМП находился в диапазоне нормальных значений, но был ниже, чем у больных СД 2 типа без ИМП. На фоне базисной терапии ИМП он значительно увеличился, превысив референсные значения и аналогичный показатель у здоровых людей. У больных, получавших Имунофан, уровень IgG значимо повысился, но только до значения у пациентов с СД 2 типа без ИМП.
В обеих группах с ИМП концентрация IgA увеличилась в результате терапии, но только на фоне лечения Имунофаном поднялась до значения у здоровых участников.
Важную роль в реализации воспалительной реакции на внедрение инфекционного агента, а также контроля иммунного реагирования отводят цитокинам. Нами установлено, что уровни всех исследованных цитокинов у больных СД 2 типа без ИМП и в острую фазу ИМП на фоне СД были увеличены (табл. 4). В обеих группах с ИМП концентрация ИЛ-4 превысила таковую у больных только СД 2 типа. В группе получавших базисную терапию ИМП содержание ИЛ-6, ФНО-α и ИЛ-1β не отличалось от показателей у больных СД без ИМП.
Таблица 4
Уровни интерлейкинов (ИЛ) и фактора некроза опухоли (ФНО) α у участников исследования, Ме (25; 75)
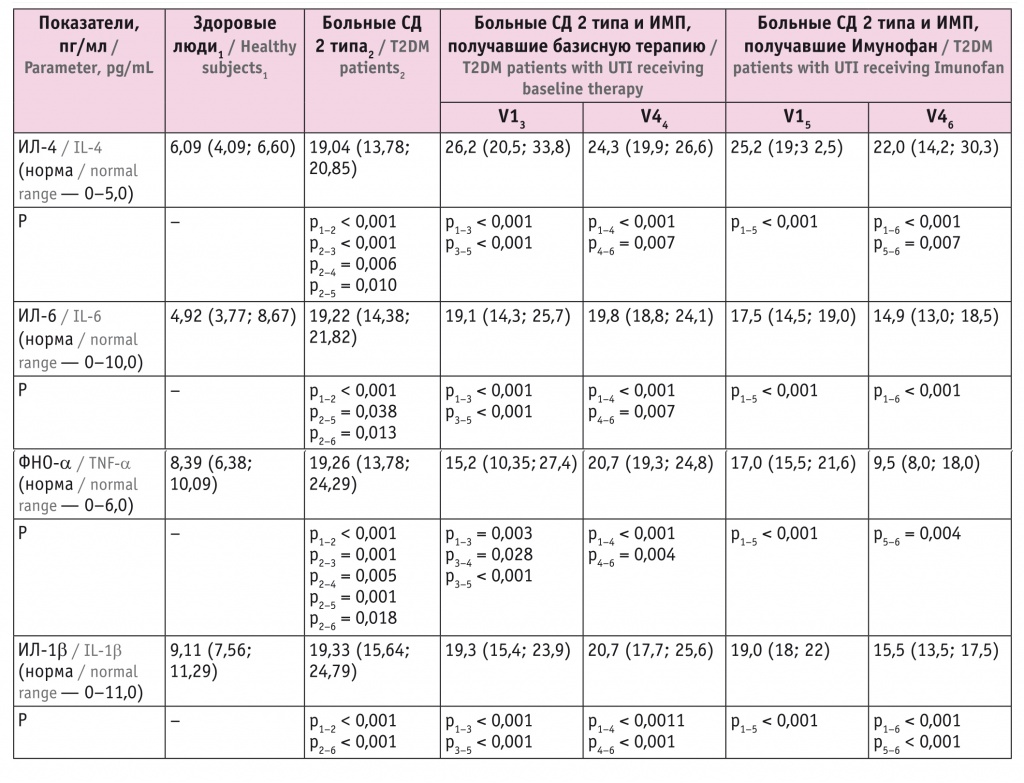
В динамике течения инфекционного процесса в группе базисной терапии уровень ИЛ-4 не изменился. У пациентов, получавших Имунофан, наблюдалось его значимое снижение, однако он оставался выше уровня у больных СД без ИМП.
Повышенные концентрации ИЛ-6 на фоне базисной терапии и на фоне лечения Имунофаном значимо не снизились.
Содержание ФНО-α через 8 недель, в позднюю фазу реконвалесценции, на фоне базисной терапии ИМП даже выросло, в группе Имунофана значимо уменьшилось и стало меньше такового у пациентов с СД без ИМП.
Иммунокорригирующий эффект Имунофана проявился и в динамике показателя ИЛ-1β: он значимо снизился, а на фоне базисной терапии не изменился даже через 8 недель.
ОБСУЖДЕНИЕ
Проведенное комплексное исследование показателей врожденного и адаптивного иммунитета позволило установить наличие у больных СД 2 типа хронического иммунного неспецифического воспалительного процесса, которое привело к ВИД: снижению содержания СD3 и СD4, CD4/CD8 (ИРИ), росту уровня СD16, нарушению фагоцитарного звена врожденного иммунитета, уменьшению ФАЛ, метаболической и бактерицидной активности (НСТ сп., НСТ ст.), гуморального звена иммунитета, уровня IgA и дисрегуляции цитокинового профиля.
Базисная терапия не привела к нормализации клеточного звена адаптивного иммунитета: ИРИ был ниже нормальных показателей, что свидетельствует о сохраняющемся иммунном отклонении. На фоне же терапии Имунофаном ИРИ нормализовался. Более значительное повышение содержания В-лимфоцитов в резульате иммуннокорригирующей терапии способствовало нормализации соотношения фракций иммуноглобулинов за счет увеличения уровня IgA и некоторого торможения синтеза IgG. Сохраняющийся повышенный уровень IgG в позднюю фазу реконвалесценции может привести к развитию иммунного воспаления в почечной ткани и прогрессированию ДН.
Лечение Имунофаном нормализовало показатели фагоцитарной и метаболической активности нейтрофилов. При ИМП на фоне СД отмечено повышение содержания всех цитокинов, что подтверждает наличие иммунного воспаления у больных СД 2 типа. В острую фазу ИМП только уровень ИЛ-4 превысил показатель в группе СД без ИМП, что свидетельствует o Th-II иммунном ответе. Концентрации всех изученных провоспалительных цитокинов снизились до значений у больных только СД 2 типа лишь при лечении Имунофаном.
ЗАКЛЮЧЕНИЕ
Изучение динамики состояния клеточного и гуморального звеньев врожденного и адаптивного иммунитета показало, что при инфекции мочевых путей (ИМП) на фоне СД 2 типа наблюдается вялотекущий воспалительный процесс с замедлением сроков реконвалесценции. Включение Имунофана в терапию ИМП корригирует нарушенные показатели и снижает риск прогрессирования хронической болезни почек при ИМП на фоне СД 2 типа.
Поступила: 03.03.2020
Принята к публикации: 24.03.2020








