ВЕДЕНИЕ
Сахарный диабет (СД) — это группа метаболических заболеваний, проявляющихся хронической гипергликемией, возникающей в результате инсулинорезистентности (ИР) или относительной инсулиновой недостаточности[1]. Учитывая появление новых аспектов патогенеза нарушений углеводного обмена и сопоставление их с клиническими проявлениями, некоторыми авторами предложена новая классификация СД, основанная на кластерах ряда признаков. Такое ранжирование предусматривает возможность раннего назначения патогенетического лечения и прогнозирование развития хронических осложнений СД[2].
Впервые новые принципы классификации СД были предложены Э. Альквист и соавт. в 2018 г. Авторы проанализировали клинические данные более 10 000 больных СД старше 18 лет из скандинавских стран. На основании ведущих признаков, а именно возраста пациента на момент манифестации заболевания, индекса массы тела (ИМТ), наличия антитител к глутаматдекарбоксилазе (GAD), уровня гликированного гемоглобина (HbA1c), индекса ИР (HOMA2-IR) и базальной секреции β-клеток (HOMA2-P) были предложены пять различных групп (кластеров) СД:
1. Тяжелый аутоиммунный диабет (severe autoimmune diabetes, SAID).
2. Тяжелый инсулин-дефицитный диабет (severe insulin-deficient diabetes, SIDD).
3. Тяжелый инсулинрезистентный диабет (severe insulin-resistant diabetes, SIRD).
4. Умеренный диабет, связанный с ожирением (mild obesity-related diabetes, MOD).
5. Умеренный возрастной диабет (mild age-related diabetes, MARD).
Первый кластер составляют больные молодого возраста со сниженным ИМТ, плохим гликемическим контролем, у которых определяются повышенный титр антител к GAD, высокий уровень HbA1C и выраженное снижение индекса HOMA2-Р. В классификации ВОЗ 1999 г. SAID соответствует СД 1 типа (СД1). Кластер SIDD значительно схож с SAID по набору признаков. Единственное отличие — отсутствие у принадлежавших к кластеру SIDD антител к GAD. Для пациентов с SAID и SIDD характерно развитие осложнений СД: кетоацидоза и диабетической ретинопатии. В кластер SIRD входят люди с высокими ИМТ и индексом HOMA2-IR. У этих больных СД часто снижена скорость клубочковой фильтрации и высок риск развития микроальбуминурии и хронической болезни почек. Для пациентов с SIRD также характерна более высокая частота развития неалкогольной жировой болезни печени. К кластеру MOD исследователи отнесли лиц с высоким ИМТ, умеренным повышением индекса HOMA2-IR и незначительным снижением индекса HOMA2-P. В кластер MARD попали пожилые пациенты со стабильным течением СД и нормальным индексом HOMA2-IR[2]. Данная классификация не учитывает моногенные формы СД, которые часто диагностируются в молодом возрасте.
У пациентов молодого возраста проведение дифференциальной диагностики типа СД в дебюте заболевания затруднено, поэтому необходимо представлять особенности манифестации каждого типа диабета[3]. Наиболее распространенными формами СД среди лиц молодого возраста (дебют до 45 лет) являются СД 1 и СД 2 типов (СД2). СД1 характеризуется абсолютной недостаточностью инсулина, поэтому единственным видом терапии СД1 является заместительная инсулинотерапия. СД2 — это многофакторное заболевание. К основным звеньям его патогенеза относят развитие ИР, дисфункцию α- и β-клеток поджелудочной железы, нарушение инкретинового ответа, парадоксальную реабсорбцию глюкозы в почках и др. Лечение СД2 осуществляется преимущественно пероральными сахароснижающими препаратами, действие которых основано на коррекции основных звеньев патогенеза данного заболевания[3, 4].
Цель обзора — изучить особенности течения разных типов СД у лиц молодого возраста.
ОСНОВНЫЕ ПОЛОЖЕНИЯ
Клинические симптомы СД2 с дебютом в молодом возрасте различны. По данным литературы, в Новосибирске в 59% случаев течение заболевания проходило бессимптомно[4]. Классические симптомы гипергликемии: полидипсия, полиурия, снижение остроты зрения, онемение и судороги в ногах — диагностируются в 20% случаев. В 25% случаев проявлением СД2 у молодых является кетоацидоз. У данных пациентов могут наблюдаться нарушение роста, ночной энурез, в некоторых случаях потеря веса[5]. Показано более выраженное нарушение липидного профиля среди пациентов с СД2 с ранним началом, чем у пациентов с поздним началом[6]. У пациентов в возрасте 18–45 лет иногда определяется полиморбидность, среди которой наиболее часто диагностируются артериальная гипертензия, заболевания печени и почек[7]. СД2 с дебютом в молодом возрасте имеет высокие риски развития осложнений, которые быстро прогрессируют[8]. Абсолютный риск сердечно-сосудистых осложнений у молодых пациентов с СД2 будет ниже, чем у пациентов среднего и пожилого возраста, но в дальнейшем из-за более длительной гипергликемии осложнения могут привести к раннему летальному исходу. Таким образом, пациент с дебютом СД2 в 25 лет будет иметь абсолютный риск осложнений ниже, чем пациент с дебютом СД2 в 55 лет, но к моменту, когда им исполнится 65 лет, ситуация изменится: абсолютный и относительный риск осложнений будет выше у того пациента, у которого СД2 диагностировали в молодом возрасте.
Манифестация СД1 в 80% случаев сопровождается кетоацидозом[9]. У большинства пациентов с СД1 достижение целевых значений НbА1с является сложной задачей, лишь треть лиц с этим типом СД в молодом возрасте имеют уровень НЬА1с менее 8%, а подавляющее большинство пациентов находятся в состоянии хронической декомпенсации заболевания[10]. Поэтому перед врачами стоит задача коррекции уровня глюкозы в крови при помощи интенсивной инсулинотерапии.
Кроме СД1 и СД2 в молодом возрасте могут быть верифицированы более редкие формы: медленно развивающийся иммуноопосредованный СД (Latent Autoimmune Diabetes mellitus in Adults, LADA), диабет взрослого типа у молодых (Maturity-Onset Diabetes of the Young, MODY) и др. Врачу не всегда удается безошибочно определить тип СД на основании клинических признаков. В этих случаях следует рассмотреть возможность использования гормональных, иммунологических и молекулярно-генетических методов исследования. Верификация корректного типа диабета при диагностировании СД у лиц молодого возраста необходима для определения тактики ведения данного заболевания[11].
MODY наследуется по аутосомно-доминантному типу и, по оценкам, составляет 1–2% случаев диабета. К развитию MODY приводят патогенные мутации в генах, кодирующих факторы транскрипции HNF1A, HNF4A и HNF1B, а также гликолитический фермент глюкокиназу (GCK). Гипергликемия при MODY диагностируется чаще на 2–4-м десятилетии жизни и не соответствует клиническим особенностям ни СД1, ни СД2. У пациентов с MODY отсутствует абсолютная потребность в инсулине, не характерен кетоз, в отличие от СД1. При MODY очень редко определяются избыточный вес, ожирение и признаки ИР, поэтому течение СД этого типа отличается от СД2. Часто СД диагностируется, по крайней мере, в двух поколениях, хотя это не абсолютный признак MODY.
Верификация патогенной мутации в генах, ассоциированных с MODY, является критерием для постановки диагноза[12]. HNF1A-MODY и HNF4A-MODY имеют очень похожие клинические признаки и приводят к прогрессирующей дисфункции β-клеток. Пациенты с HNF1A-MODY имеют сниженный почечный порог глюкозы, что приводит к глюкозурии, часто до верификации диагноза СД. При HNF4A-MODY часто определяется гиперинсулинемия внутриутробно с макросомией плода при рождении (> 4 кг) и транзиторная неонатальная гипогликемия. Гипогликемия при низких начальных дозах производных сульфонилмочевины (ПСМ) указывает на высокую вероятность HNF1A/4A-MODY[11]. Мутации в гене GCK вызывают снижение порога глюкозы для секреции инсулина, что приводит к невысокой гипергликемии без значительного постпрандиального повышения уровня глюкозы. Гипергликемия при GCK-MODY присутствует на протяжении всей жизни, но обычно протекает бессимптомно и выявляется при случайном измерении уровня глюкозы в крови (например, во время беременности). Наличие у пациента других клинических признаков в сочетании с диабетом должно рассматриваться как показание к проведению молекулярно-генетического исследования. Например, мутации в гене HNF1B связаны с почечными кистами и мочеполовыми аномалиями[12].
Правильная верификация типа СД у молодых пациентов позволяет назначить патогенетическую терапию[13]. Небольшая доза ПСМ является рекомендуемой терапией первой линии при HNF1A-/HNF4A-MODY. Типичная начальная доза составляет 30 мг гликлазида или 1,75 мг глибенкламида 1 раз в день. Большинство пациентов при этом лечении достигают целевых значений гликемии, а HbA1c остается в целевом диапазоне в течение многих лет[14]. Препараты, которые с осторожностью назначают при HNF1A-MODY, относятся к классу ингибиторов котранспортера натрия/глюкозы 2 (SGLT2), поскольку дефицит HNF1A уже снижает экспрессию SGLT2. Пациенты с HNF1B-MODY не чувствительны к ПСМ и обычно нуждаются в инсулине раньше, чем другие подтипы MODY. Антигипергликемическая терапия при GCK-MODY не рекомендуется, и лечение, которое было начато ранее, может быть прекращено, а уровень HbA1c не меняется при отмене антигипергликемических препаратов[15]. При любом типе MODY родственникам с диабетом следует предложить генетическое исследование на мутацию, определенную у пробанда, поскольку они могут иметь бессимптомную гипергликемию[16].
LADA — это аутоиммунный диабет, который начинается после 35 лет и не требует назначения инсулина для гликемического контроля по крайней мере в течение первых 6 мес после постановки диагноза. Он имеет общие генетические, иммунологические и метаболические особенности с СД1 и СД2[16]. LADA — это по определению болезнь взрослых.
Общество иммунологии диабета определило три критерия для диагностики LADA:
-
возраст старше 35 лет;
-
положительные аутоантитела к островковым β-клеткам;
-
отсутствие абсолютной потребности в инсулине в течение по крайней мере первых 6 мес после постановки диагноза.
LADA иммунологически подобен СД1, поскольку присутствуют антитела к островковым β-клеткам, хотя и в более низких титрах, а разрушение β-клеток поджелудочной железы прогрессирует гораздо медленнее по сравнению с классическим СД1[17]. У большинства этих пациентов наблюдается гипергликемия, уровень которой ниже, чем при СД1, часто LADA не диагностируется и лечится как СД2[18]. Только позже становится понятно, что уровень глюкозы у пациентов с этим типом СД плохо контролируется пероральными сахароснижающими препаратами, особенно ПСМ, что в конечном итоге требует назначения инсулинотерапии[19]. Основные характеристики СД различных типов у лиц молодого возраста представлены в табл.
Таблица
Характеристики различных типов СД у лиц молодого возраста
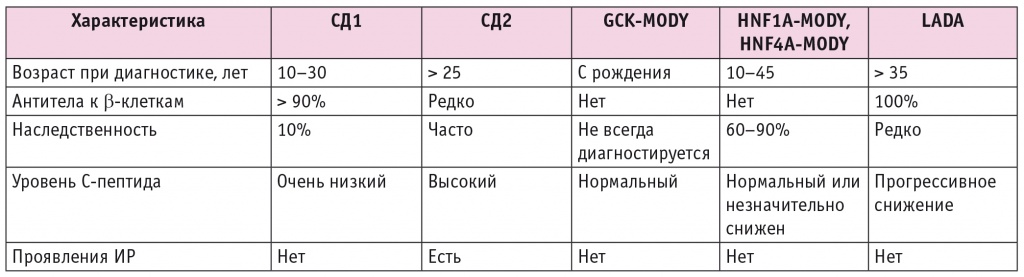
LADA представляет собой гетерогенное заболевание, при котором у одних пациентов выявляются высокие титры антител, низкий ИМТ, и они быстрее переходят на инсулинотерапию, а у других пациентов с низкими титрами антител, признаками ИР (высокий ИМТ) позже появляется потребность в инсулинотерапии[20]. В развитии LADA имеют значение и генетические факторы. Как и при СД1, риск развития LADA наиболее высок у носителей определенных гаплотипов HLA. Гены HLA кодируют основные антигены гистосовместимости, которые выполняют важные иммунорегуляторные функции, поэтому не удивительно, что LADA вызывается нарушением регуляции иммунитета. Однако факторы, провоцирующие аутоиммунитет, не установлены. Оценка ИР с помощью HOMA-IR показала, что у пациентов с LADA ИР сходна с таковой при СД2 даже после коррекции ИМТ[21]. Таким образом, патофизиология этого типа СД включает как аутоиммунные, так и метаболические нарушения при ИР.
У пациентов с LADA остаточный уровень С-пептида обычно выше, чем при СД1, но ниже, чем при СД2[22]. Уровни С-пептида при этом типе СД обратно пропорциональны титру антител к GAD. После постановки диагноза LADA назначаются немедикаментозные методы лечения, включая диету с подсчетом углеводов и калорий, физические упражнения, и проводится профилактика осложнений. Поскольку LADA является гетерогенным состоянием, фармакологическое лечение должно быть персонализировано для достижения максимального терапевтического эффекта. Терапия, которая сохранит функцию β-клеток, является приоритетной[23]. ПСМ — не оптимальный выбор при LADA. Эти препараты вызывают истощение β-клеток, о чем свидетельствует падение уровня С-пептида, более ранняя потребность в инсулинотерапии. Хотя метформин может изначально помочь в контроле гликемии у пациентов с LADA с высоким ИМТ, он сам по себе не может сохранить функцию β-клеток или замедлить их разрушение. Тиазолидиндионы оказывают противовоспалительное действие на β-клетки и могут продлевать их выживание, а также могут быть полезны при использовании на ранней стадии LADA. Их можно комбинировать с инсулином. Розиглитазон — единственный препарат, изучаемый при данном типе СД[24]. Необходимы более длительные исследования других препаратов этого класса, таких как пиоглитазон.
Ингибиторы дипептидилпептидазы-4 (ДПП4) показали многообещающие результаты в отдельности или в сочетании с инсулином в сохранении функции β-клеток при LADA[25]. ДПП4 влияют на метаболический контроль, увеличивая уровни глюкагоноподобного пептида-1 (ГПП1) и других пептидов. Их основное действие заключается в повышении уровня ГПП1, подавлении глюкагона и увеличении секреции инсулина после нагрузки глюкозой путем активации рецепторов ДПП4 в желудочно-кишечном тракте и головном мозге. Рецепторы ДПП4 также идентифицированы на поверхности Т-лимфоцитов, где они могут влиять на иммунную регуляцию. Это последнее действие может иметь важное значение для замедления разрушения β-клеток иммунной системой при LADA[26, 27]. До сих пор эти исследования с ингибиторами ДПП4 были либо недостаточными, либо непродолжительными. Эта категория препаратов имеет потенциальную ценность, и необходимы дополнительные исследования, прежде чем рутинно рекомендовать их для пациентов с LADA.
Таким образом, СД представляет собой гетерогенную группу различных патологий, характеризующихся этиологическими, патогенетическими и клиническими особенностями. В связи с этим не существует универсальных советов по ведению пациентов с СД. Начальные исследования при выявлении гипергликемии у пациентов молодого возраста должны включать определение глюкозы, HbA1c, С-пептида и антител к β-клеткам, GAD, тирозинфосфотазе, инсулину, транспортеру цинка 8. Если уровень глюкозы > 15 ммоль/л, следует проверить уровень кетонов, при MODY они обычно отсутствуют[28, 29]. Определение уровня С-пептида является необходимым исследованием, поскольку показывает эндогенную секрецию инсулина, которая резко снижается при СД1 через 1–3 года после постановки диагноза[30, 31]. При MODY С-пептид остается в пределах нормы, а антитела отрицательные. Незначительная гипергликемия натощак и HbA1c < 7,0% указывают на GCK-MODY.
ЗАКЛЮЧЕНИЕ
При обнаружении гипергликемии у лиц молодого возраста необходима тщательная дифференциальная диагностика типа СД. При выявлении у пациента нетипичных клинических и лабораторных проявлений заболевания целесообразно проанализировать возможность наличия у него неклассических форм диабета.
Поступила: 21.03.2023
Принята к публикации: 15.05.2023








