Сахарный диабет (СД) — заболевание, характеризующееся нарушением секреции инсулина и/или резистентности тканей к нему, вследствие чего возникает хроническая гипергликемия[1]. СД может развиваться вторично по отношению к заболеваниям поджелудочной железы. Этот особый тип диабета ранее называли панкреатогенным диабетом или СД 3с типа, последнее название было закреплено в ежегодно публикуемых документах American Diabetes Association.
В 2019 г. Всемирная организация здравоохранения утвердила название «СД в исходе заболеваний экзокринной части поджелудочной железы», в мировой литературе его сокращенно называют ДЭП[2, 3]. В данной статье мы будем придерживаться именно этого термина.
Из-за отсутствия четких критериев диагностики ДЭП, а также низкой настороженности врачей-эндокринологов в отношении сопутствующих заболеваний поджелудочной железы диагноз ДЭП не всегда устанавливается своевременно, и, несмотря на то что клиническая картина дебюта явно не соответствует таковой при классических СД 1 типа (СД1) или СД 2 типа (СД2), в большинстве случаев один из указанных диагнозов фигурирует в медицинской карте пациента.
В настоящем обзоре описан патогенез ДЭП с акцентом на уменьшении массы функционирующих островковых клеток и на обусловленных этим нарушениях секреции и взаимодействия вырабатываемых ими гормонов, а также снижении внешнесекреторной функции поджелудочной железы.
В отличие от СД1 и СД2 масштабных эпидемиологических исследований о распространенности ДЭП не существует, как не существует и общепринятых критериев постановки указанного диагноза. По данным Y. Cui и соавт., распространенность ДЭП составляет 5–10% среди всех случаев СД в западной популяции, в то же время продолжительные (до 25 лет) наблюдения показали, что общая частота СД после установления диагноза хронического панкреатита (ХП) — 40–50% через 10 лет и > 80% через 25 лет[4, 5].
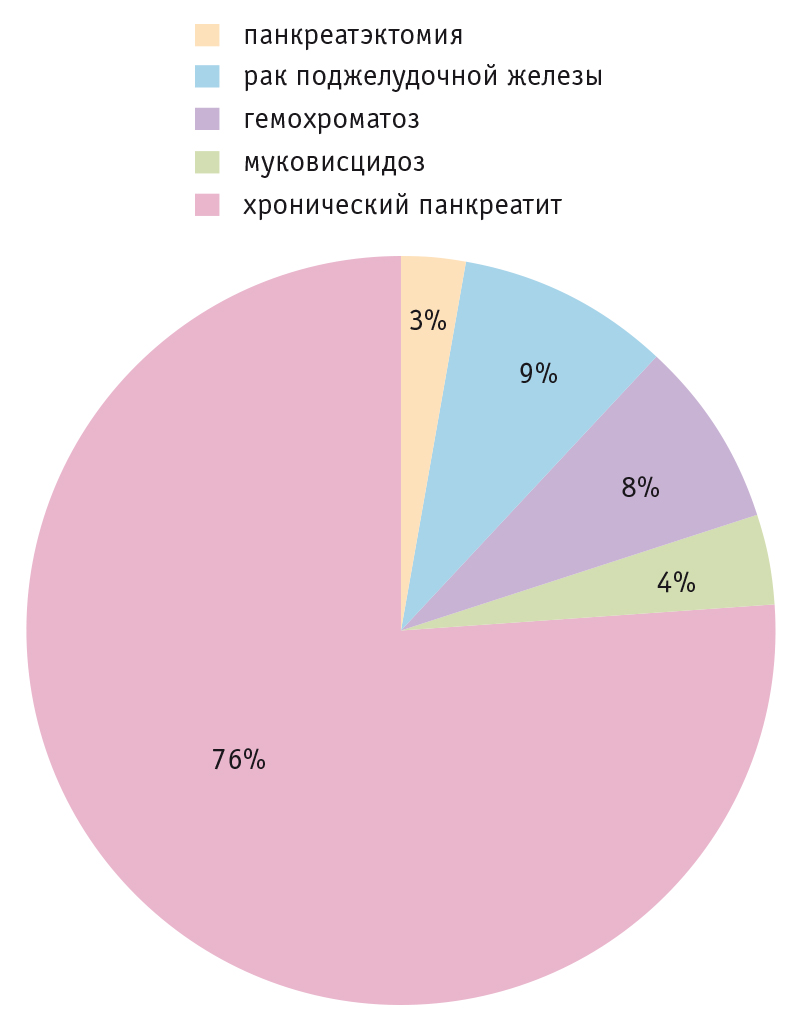
К наиболее частым причинам ДЭП относят ХП (в первую очередь калькулезный), протоковую аденокарциному поджелудочной железы, гемохроматоз, муковисцидоз и резекцию поджелудочной железы[3].
Структура причин ДЭП представлена на рисунке 1[6].
Рис. 1. Распространенность этиологических причин сахарного диабета в исходе заболеваний экзокринной части поджелудочной железы (адаптировано из[6])
С учетом большого разнообразия заболеваний, при которых развивается ДЭП, создана его этиологическая классификация[3].
Этиологическая классификация ДЭП
1. Врожденное или приобретенное отсутствие островков поджелудочной железы:
-
агенезия поджелудочное железы;
-
тотальная дуоденопанкреатэктомия.
2. Приобретенное частичное отсутствие функциональных островков поджелудочной железы:
-
ХП;
-
частичная панкреатэктомия (проксимальная или дистальная);
-
тяжелый острый панкреатит;
-
муковисцидоз;
-
гемохроматоз.
3. Паранеопластический синдром при протоковой аденокарциноме поджелудочной железы.
4. Другое, например транзиторная гипергликемия при остром панкреатите.
Приведенное разделение вполне оправдано, так как механизм поражения островков поджелудочной железы различается в зависимости от исходного ее заболевания. В первых двух пунктах классификации сделан акцент именно на уменьшении массы и функции островковых клеток как на основной причине развития ДЭП.
При остром панкреатите и на ранних этапах ХП в паренхиме поджелудочной железы присутствует огромное количество провоспалительных цитокинов, что сопровождается дисфункцией β-клеток вплоть до полной утраты их функции (рис. 2)[7, 8]. По мере прогрессирования ХП обширный фиброз, вызванный воспалением экзокринной части поджелудочной железы, медленно продолжает разрушать островковые клетки, в первую очередь массу функционирующих β-клеток.
Рис. 2. Развитие сахарного диабета в исходе заболеваний экзокринной части поджелудочной железы (ДЭП) при остром (ОП) или хроническом панкреатите (ХП) (адаптировано из[8])

Показано, что снижение секреции инсулина при СД, вторичном по отношению к ХП, коррелирует с уменьшением массы поджелудочной железы и количеством функционирующих β-клеток. Сходный механизм наблюдается и при ДЭП вследствие частичной резекции поджелудочной железы[9].
Стоит отметить интересные данные, опубликованные Североамериканским консорциумом по изучению панкреатита в 2017 г., продемонстрировавшие влияние на риск развития СД при ХП не только специфических характеристик ХП (длительности, наличия кальцинатов, выраженности экзокринной недостаточности, резекции поджелудочной железы), но и традиционных факторов риска СД2 (возраста, избыточной массы/ожирения, семейного анамнеза СД)[10].
В 2019 г. М.О. Goodarzi и соавт. опубликовали работу, в которой показано, что у пациентов с ДЭП и с СД2 одинаковый генетический профиль риска[11]. Тот факт, что оба заболевания имеют одинаковую генетическую основу и демографические факторы риска, заставляет многих авторов задуматься: является ли ДЭП самостоятельным типом СД или все же подтипом СД2[12].
В научной работе 2022 г. установлено, что при СД1 и СД2 с высокой частотой встречается экзокринная недостаточность поджелудочной железы (ЭНПЖ), при этом наибольшее снижение уровней панкреатической амилазы и эластазы 1 отмечено при СД1 и его варианте LADA. Нужно подчеркнуть, что оценка содержания панкреатический эластазы в кале является одним из точных и доступных методов диагностики ЭНПЖ. В той же работе убедительно доказано, что происходит статистически значимое уменьшение объема и размеров поджелудочной железы в период 1–5 лет от начала заболевания[13].
Однако все же при ДЭП повреждение экзокринной части поджелудочной железы первично по отношению к СД и более обширно — страдает секреция всех ферментов, следовательно, симптомы мальдигестии и мальабсорбции выражены в большей степени. Единственным исключением является рак поджелудочной железы, при котором экзокринная недостаточность на ранних этапах может быть выражена минимально или вообще отсутствовать[14].
Патогенез экзокринной недостаточности при СД1 и СД2 многофакторный и включает в себя такие причины, как атрофия и снижение активности ацинарных клеток из-за уменьшения трофического влияния инсулина, накопление эктопического жира, фиброз паренхимы. По мере прогрессирования СД присоединяются диабетическая микроангиопатия и автономная нейропатия[15, 16].
Наиболее часто пациенты предъявляют жалобы на стеаторею, диарею и метеоризм. Эти проявления объясняются недостаточностью панкреатической липазы, при дефиците которой переваривание жиров нарушается. Некоторые больные могут не иметь подобных жалоб даже при тяжелом дефиците липазы, поскольку давно интуитивно исключили из рациона жиры, поэтому сбор анамнеза об особенностях питания имеет большое значение. Из-за дефицита липазы нарушается всасывание жирорастворимых витаминов (A, D, E, K) и появляются симптомы их дефицита.
Основной метод лечения пациентов с ЭНПЖ — заместительная терапия адекватными дозами микронизированных ферментов[17]. Два метаанализа, опубликованные в 2017 и 2019 г., продемонстрировали, что заместительная ферментная терапия способствовала улучшению переваривания жиров и белков, а также снижению выраженности симптомов со стороны желудочно-кишечного тракта[17, 18].
ДИАГНОСТИКА САХАРНОГО ДИАБЕТА В ИСХОДЕ ЗАБОЛЕВАНИЙ ЭКЗОКРИННОЙ ЧАСТИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Несмотря на общие черты с СД1 и СД2, клинические проявления ДЭП имеют определенные особенности, которые представлены на рисунке 3.
Рис. 3. Взаимосвязь между разными типами сахарного диабета (СД) (адаптировано из[19])
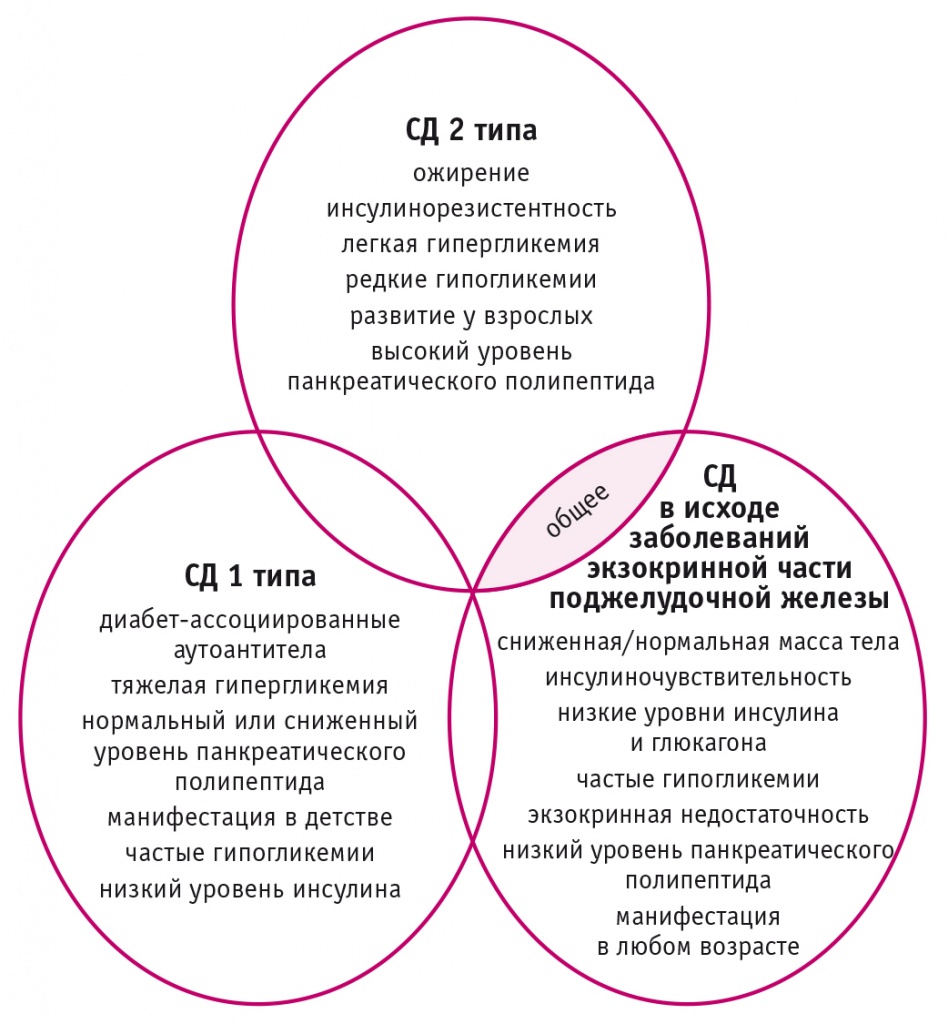
Как видно на рисунке 3, у некоторых пациентов с ДЭП много общих черт с больными СД1 и СД2.[19]. Именно поэтому необходимы конкретные критерии диагностики ДЭП, тем более что, по данным PancreasFest 2012, СД2 и ДЭП могут сосуществовать одновременно[20]. В работе N. Ewald и P.D. Hardt[21] предложено использовать следующие обязательные критерии диагностики ДЭП:
-
экзокринная недостаточность поджелудочной железы;
-
визуализация структурной патологии поджелудочной железы;
-
отсутствие аутоантител к β-клеткам, ассоциированных с СД1.
Кроме того, они представили несколько дополнительных критериев, включающих:
-
отсутствие секреции панкреатического полипептида;
-
нарушение секреции инкретинов, отсутствие инсулинорезистентности (модель HOMA-IR);
-
нарушение функции β-клеток (модель HOMA-B или соотношение глюкоза/С-пептид);
-
низкие уровни жирорастворимых витаминов в сыворотке крови.
К сожалению, на сегодняшний день достоверность и точность некоторых критериев остаются спорными.
В частности, у пациентов с СД1 и тяжелой автономной нейропатией может быть существенно нарушена регуляция секреции панкреатического полипептида, что следует иметь в виду при использовании его уровня в качестве диагностического критерия[22]. Более того, не у всех пациентов с ХП есть дефицит жирорастворимых витаминов. Однако, если учесть все вышеописанные недостатки, критерии N. Ewald и P.D. Hardt сейчас являются наиболее точными в дифференциальной диагностике данного типа СД.
ВЗАИМОСВЯЗЬ ГОРМОНОВ ПАНКРЕАТИЧЕСКИХ ОСТРОВКОВ
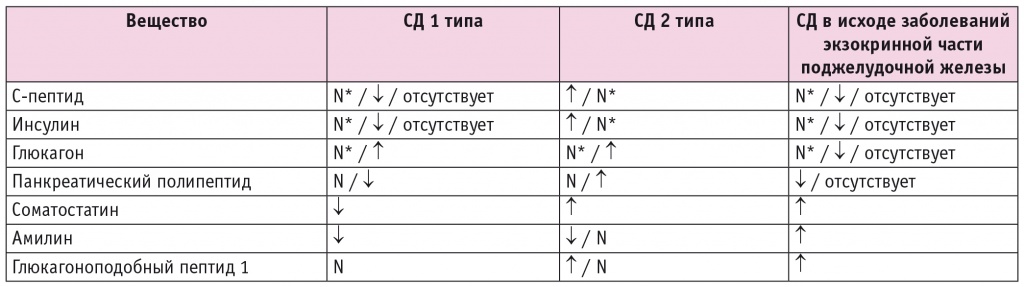
В таблице, по данным PancreasFest 2012, дополненным авторами статьи, представлены основные различия в уровнях гормонов при разных типах СД[20].
Таблица
Уровни гормонов панкреатических островков и глюкагоноподобного пептида 1 в зависимости от типа сахарного диабета (СД)[20, 23, 24]
С-пептид
ДЭП занимает промежуточное положение между СД1 и СД2 по уровню секреции С-пептида. Ввиду отсутствия специфических аутоантител против β-клеток их количество и функциональная активность напрямую зависят от степени выраженности деструктивного и/или воспалительного процесса во всей поджелудочной железе. Иначе говоря, при первом эпизоде острого панкреатита или нетотального панкреонекроза С-пептид определяется, однако, возможно, в количествах, недостаточных для поддержания гомеостаза глюкозы.
В работе I. Ghosh и соавт.[25] показано, что у пациентов с ДЭП концентрации С-пептида и инсулина натощак и через 1 час после приема 75 г глюкозы ниже, чем у больных СД2. Но даже при длительном течении ХП небольшая остаточная секреция С-пептида всегда присутствует, что объясняет низкий риск развития кетоацидоза при декомпенсации СД[26].
Глюкагон
По данным исследований, при первом эпизоде острого панкреатита концентрация глюкагона может повышаться примерно в 9 раз по сравнению с контрольными значениями, однако при рецидивах острого панкреатита она уменьшается[20].
При ХП концентрация глюкагона более низкая как при измерении базального уровня, так и при аргинин-стимулирующей пробе. При классических СД1 или СД2 уровень глюкагона повышен[25–27].
Для ДЭП характерны бо́льшая длительность гипогликемии и замедленное восстановление гликемии до целевых значений, в отличие от СД1. Вероятно, они вызваны сниженным уровнем глюкагона и обусловленным этим нарушением процессов гликогенолиза[28].
Содержание глюкагона коррелирует с уровнями панкреатического полипептида, инсулина и соматостатина, что также влияет на характер гипогликемий при ДЭП[29].
Дефект α-клеток островков поджелудочной железы может развиваться как при активации иммунной системы, так и при хирургических вмешательствах. Показано, что резекция 50% ткани поджелудочной железы приводит к дефициту глюкагона[30], однако именно при дистальной резекции следует ожидать более выраженного снижения его уровня, даже если объем удаленной ткани будет меньше. Это связано с различной морфологией панкреатических островков в разных частях поджелудочной железы.
Дефицит глюкагона можно рассматривать как вторую причину более редкого диабетического кетоацидоза у пациентов с ДЭП. Известно, что при СД1 патологическая гиперглюкогонемия и индуцированный ею липолиз, сопровождающийся высвобождением свободных жирных кислот, служащих субстратом формирования кетоновых тел в печени, запускают механизм развития диабетического кетоацидоза. В условиях абсолютного дефицита глюкагона указанный механизм не реализуется[31].
Соматостатин
Соматостатин — пептидный гормон, экпрессируемый эндокринными клетками многих тканей и органов, обладает широким спектром физиологических эффектов, преимущественно ингибиторных. Он снижает экспрессию генов инсулина, глюкагона и панкреатического полипептида, ингибирует высвобождение бикарбоната и пищеварительных ферментов из экзокринной части поджелудочной железы[32]. Вырабатываясь в островках поджелудочной железы, он является ингибитором как эндо-, так и экзокринной функции[33]. Помимо этого, соматостатин обладает иммунномодулирующим эффектом, подавляя продукцию провоспалительных цитокинов[33].
При ХП соматостатин уменьшает концентрации провоспалительных цитокинов, играющих важную роль в стимуляции звездчатых клеток, ответственных за развитие фиброза железы[32].
Секреция соматостатина D-клетками островков снижает секрецию инсулина после еды, позволяя избежать нежелательной гипогликемии и предотвратить снижение чувствительности к инсулину в тканях-мишенях. Секреция соматостатина стимулируется при повышении гликемии. Следовательно, гормон может быть вовлечен и в коррекцию гипергликемии путем ингибирования секреции глюкагона[34].
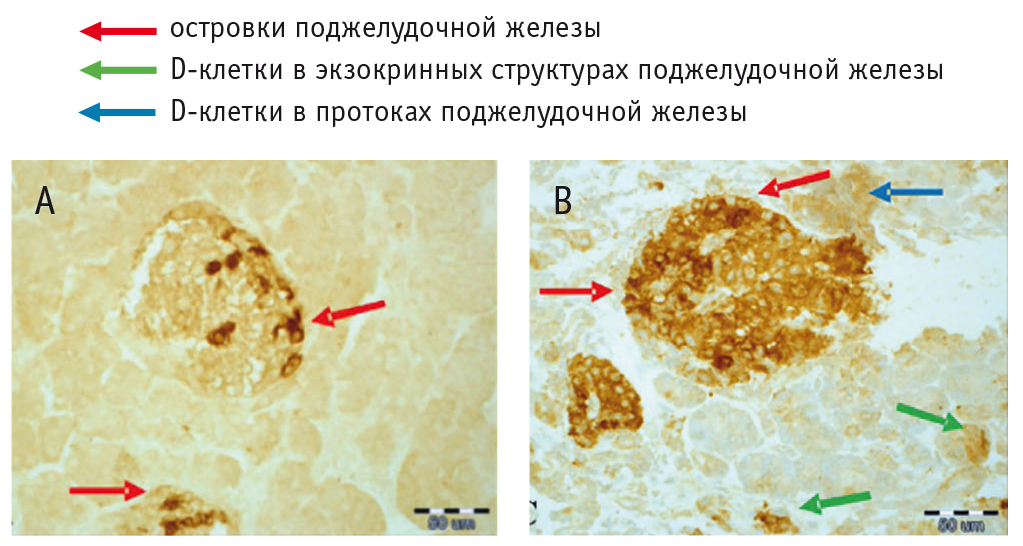
На гистологических срезах пациентов с ХП и ДЭП выявлено большее количество соматостатина, чем в контрольной группе лиц без СД и панкреатита в анамнезе. В тканях, характеризующихся большей деструкцией из-за хронического воспаления, наблюдалась более выраженная иммуногистохимическая реакция на соматостатин в экзокринной части, следовательно, можно предположить уникальный компенсаторный механизм, характерный для ДЭП (рис. 4)[26].
Рис. 4. Иммуногистохимическая локализация соматостатина в ткани поджелудочной железы (адаптировано из[26]): А — у человека без хронического панкреатита и сахарного диабета (интактная поджелудочная железа); В — у пациента с сахарным диабетом в исходе заболеваний экзокринной части поджелудочной железы (диабет + хронический панкреатит)
Амилин
Амилин играет важную роль в энергетическом балансе, в основном экспрессируется β-клетками поджелудочной железы[35]. Недавние результаты исследования COSMOS group показали повышение концентрации амилина у пациентов с нарушениями углеводного обмена после единичного эпизода острого панкреатита[36]. В этой работе также выявлено, что уровни амилина и инсулина имеют статистически значимые положительные корреляции (p = 0,003).
Еще одно исследование включало 12 пациентов с острым панкреатитом, его авторы обнаружили, что уровень амилина коррелировал с выраженностью гипергликемиии, инсулинорезистентностью и тяжестью течения острого панкреатита на 3-й день от начала заболевания[29]. На основании этих данных можно предположить, что повышенный уровень амилина является предиктором развития ДЭП вследствие острого панкреатита.
Амилин может способствовать развитию инсулинорезистентности, более того, накопление амилоида (производного амилина) предшествует возникновению нарушений гликемии натощак[37, 38]. С. Westwell-Roper и соавт. предположили, что амилоид вызывает дисфункцию островков не только за счет прямого токсического воздействия на β-клетки, но и за счет запуска локальной воспалительной реакции[39]. Это предположение вполне обосновано: экспрессия амилина ассоциирована с активностью провоспалительных цитокинов (фактора некроза опухоли α и MCP-1), а на фоне применения антагонистов рецептора интерлейкина 1 функция островковых клеток улучшается[39]. Терапия, направленная на снижение экспрессии и образования амилоида, может быть важна не только для сохранения β-клеток, но и для коррекции нарушенной секреции инсулина, связанной с провоспалительными цитокинами.
Панкреатический полипептид
В ответ на прием смешанной пищи клетки островков поджелудочной железы, вырабатывающие панкреатический полипептид, начинают его секретировать, он усиливает действие инсулина на метаболизм глюкозы в печени. По-видимому, существует много причин нарушения продукции глюкозы печенью и изолированной резистентности печени к инсулину при ДЭП. В эксперименте на крысах показано, что при ХП дефицит панкреатического полипептида приводит к развитию инсулинорезистентности в печени из-за снижения чувствительности рецепторов. В свою очередь, введение экзогенного панкреатического полипептида восстанавливает афинность рецепторов к инсулину[3].
При ДЭП, в отличие от СД2, базальный уровень панкреатического полипептида всегда снижен[25]. Более того, в случае резекции поджелудочной железы наибольшее уменьшение уровня панкреатического полипептида фиксируется у лиц, перенесших панкреатодуоденальную резекцию[40].
Глюкагоноподобный пептид 1
Глюкагоноподобный пептид 1 (ГПП-1) вырабатывается преимущественно L-клетками кишечника. К его основным эффектам относят влияние на углеводный обмен, как за счет прямого воздействия на β-клетки поджелудочной железы, так и за счет влияния на чувство насыщения при приеме пищи и моторику кишечника[41, 42]. При ДЭП, в условиях дефицита инсулина, уровень ГПП-1, как базальный, так и постпрандиальный, в 2 раза выше, чем у лиц без нарушений углеводного обмена, и в 1,5 раза выше, чем у больных СД2. Возможно, это обусловлено наличием отрицательной обратной связи по аналогии с другими эндокринными системами[15]. Несмотря на то что ГПП-1 активирует пролиферацию β-клеток поджелудочной железы путем влияния на рецептор эпидермального фактора роста (EGF), маловероятно, что ГПП-1 может воздействовать на восстановление ткани всей поджелудочной железы[15, 18].
ЗАКЛЮЧЕНИЕ
Все вышесказанное свидетельствует о том, что при ДЭП происходит одновременное прогрессирующее снижение эндо- и экзокринной функций поджелудочной железы. Ацинарные клетки и островки Лангерганса существуют в тесной взаимосвязи, и функции их ухудшаются одновременно.
Более того, в отличие от классического СД1, при котором аутоантитела высоко специфичны только к β-клеткам, при ДЭП снижается функция всех островковых клеток, например дефицит важнейшего гормона глюкагона обусловливает развитие тяжелых и затяжных гипогликемии, но в то же время уменьшает риск диабетического кетоацидоза.
Одними из отличительных черт ДЭП являются мальдигестия/мальабсорбция и вызванные ими значительная вариабельность гликемии и непредсказуемая потребность в сахароснижающих препаратах, сильно зависящая от степени повреждения ткани железы и адекватности заместительной терапии ферментами.
На сегодняшний день показано, что частота СД после установления диагноза ХП составляет 40–50% через 10 лет и > 80% через 25 лет. С учетом мировой тенденции к росту числа случаев как ХП, так и СД дифференциальная диагностика ДЭП становится все более актуальной.
Отсутствие рекомендаций по ведению таких пациентов, закрепленных в документах международных диабетологических ассоциаций, вызывает вопросы по выбору тактики лечения.
В заключение стоит подчеркнуть, что диагностика и ведение больных ДЭП становятся актуальной проблемой. Дальнейшие изучение этиологии и разработка новых, более простых критериев диагностики данного вида СД позволят оптимизировать терапию и повысить качество жизни больных в долгосрочной перспективе.
Поступила: 17.04.2023
Принята к публикации: 06.06.2023








