ВВЕДЕНИЕ
Рак предстательной железы (РПЖ) — одно из наиболее распространенных злокачественных заболеваний у мужчин. Ежегодно в мире регистрируют более 550 тыс. новых случаев РПЖ[1]. Одним из методов лечения РПЖ (при биохимическом рецидиве после оперативного вмешательства, при продвинутых стадиях) на сегодняшний день является андрогендепривационная терапия (АДТ), которая способствует увеличению выживаемости таких пациентов[2, 3].
Зависимость клеток опухоли предстательной железы от уровня тестостерона в сыворотке доказана в 1941 г. (С. Huggins и соавт.), тогда же продемонстрирована эффективность гормональной терапии у пациентов с РПЖ[4]. В настоящее время с целью медикаментозной кастрации применяют агонисты или антагонисты ЛГ рилизинг-гормона (ЛГРГ).
Синтетические аналоги ЛГРГ содержат замены аминокислотных остатков природного гормона — D-аминокислоты — в положении 6 и этиламидзамещающий глицин в положении 10[5]. Такая конформация молекулы обеспечивает ей более выраженное сродство к рецепторам ЛГРГ и более длительный период полураспада, что, в свою очередь, приводит к даунрегуляции клеток гипофиза, прекращению выработки ЛГ и, как следствие, прекращению синтеза андрогенов. Механизм действия антагонистов ЛГРГ заключается в блокировании рецепторов к ЛГРГ в клетках гипофиза.
Но, несмотря на хороший прогноз при АДТ, важно помнить о неблагоприятных метаболических нарушениях, к которым она приводит[6–8]. На фоне отсутствия синтеза андрогенов гонадами сетчатая доля коры надпочечников и жировая ткань продолжают синтезировать эстрогены, что клинически проявляется такими симптомами, как гинекомастия, приливы, метаболический синдром, отличающийся от классического метаболического синдрома у лиц, не получающих АДТ. Прекращается анаболическое действие мужских половых гормонов на организм, что ведет к уменьшению мышечной массы, истончению и сухости кожи, остеопорозу, повышению инсулинорезистентности[9–11]. Врачам важно знать и осведомлять своих пациентов о побочных эффектах, а также своевременно принимать меры по профилактике и коррекции осложнений, возникающих на фоне длительной АДТ.
Некоторые из изменений, происходящих у мужчин на фоне АДТ, сходны с клиническими проявлениями, наблюдаемыми при гипотиреозе. При гипотиреозе, как и при проведении АДТ, часто диагностируют увеличение жировой массы, дислипидемию и изменения гомеостаза глюкозы[12, 13]. Кроме того, при снижении концентрации циркулирующих глобулинов, связывающих половые гормоны (ГСПГ), и половых гормонов клинические проявления гипотиреоза у взрослых мужчин включают дисфункцию гонад и нарушение фертильности[14, 15].
В 2004 году были опубликованы результаты проспективного исследования по оценке функции щитовидной железы (ЩЖ) у пациентов с РПЖ, получавших только радикальную лучевую терапию, и у тех, кто получал радикальную лучевую терапию и АДТ. Первые полгода значимых различий в уровнях ТТГ, свободного Т4 (сТ4) и тиреоид-связывающего глобулина не было, но через 6 и 12 месяцев после старта терапии содержание сТ4 в группе пациентов, получавших АДТ, снизилось, при этом уровень ТТГ не повышался. В группе больных, получавших только лучевую терапию, изменения со стороны ЩЖ не отмечены[16].
Результаты другого похожего исследования, однако, не подтвердили эти данные. Всего у 2,2% мужчин, получавших АДТ, наблюдались изменения функции ЩЖ — субклинический гипотиреоз; при этом такой же результат (2% случаев зафиксированного субклинического гипотиреоза) был и в группе контроля, состоявшей из пациентов после радикальной простатэктомии без АДТ[17].
R. Hoermann и соавт.[18] провели расширенное исследование, посвященное этой теме. Они оценивали совместно с уровнями гормонов ЩЖ содержание тестостерона, эстрадиола, ГСПГ, лептина, а также метаболические изменения в составе тела, вес и ИМТ. У пациентов на фоне АДТ происходило выраженное увеличение уровня ТТГ через 12 месяцев, которого не было в группе контроля. Эти результаты коррелировали с изменениями веса и ИМТ и были им обратно пропорциональны, но не имели никакой связи с окружностью талии (ОТ), висцеральным ожирением и резистентностью к инсулину. Отмечена также прямая корреляция между концентрациями ТТГ и лептина. Уровень свободного Т3 оставался неизменным, а концентрация сТ4 через 12 месяцев возросла по сравнению с таковой в контрольной группе.
По результатам данного исследования сделан вывод, что работа гипоталамо-гипофизарно-тиреоидной оси при АДТ может быть изменена, и, по-видимому, это в большей степени ассоциировано с изменениями в составе тела, а не напрямую с дефицитом андрогенов[19].
Результаты приведенных выше исследований не совсем однозначны, а работ, посвященных связи АДТ с функцией ЩЖ, на данный момент немного. На наш взгляд, эта тема нуждается в дальнейшем изучении.
Цель исследования: оценка функции ЩЖ и метаболических нарушений у пациентов с местно-распространенным РПЖ (pT3N0M0) или биохимическим рецидивом после радикальной простатэктомии по поводу локализованного РПЖ, получавших лечение агонистами ЛГРГ (аЛГРГ).
МАТЕРИАЛЫ И МЕТОДЫ
В данное исследование вошли 102 мужчины с диагнозом местно-распространенного РПЖ (рT3N0M0) после радикального лечения или с рецидивом после радикальной простатэктомии по поводу локализованного РПЖ, диагностированным биохимически по уровню простатспецифического антигена (ПСА).
Полностью завершили исследование и были включены в статистический анализ 99 пациентов. Их возраст составил от 42 до 82 лет, средний возраст — 69 лет (95%-ный ДИ: 61,5–79,2 года).
Все участники проходили лечение на базе ГБУЗ «ГКБ им. Д.Д. Плетнева» (ГБУЗ ГКБ № 57), структурного подразделения ГБУЗ «ГКБ им. Д.Д. Плетнева» Онкологический диспансер № 3, ГАУЗ МГОБ № 62 ДЗМ (Поликлиническое отделение) с 2014 г. по декабрь 2019 г. включительно.
Работа одобрена локальным этическим комитетом ФГАОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России (протокол заседания № 185 от 20 мая 2019 г.). Все мужчины перед выполнением обследования ознакомились с информацией для пациента и после объяснения им цели и характера протокола исследования подписали информированное согласие на участие в процедурах.
Критериями включения в исследование являлись морфологически подтвержденный первичный местно-распространенный РПЖ (рT3N0M0) (n = 48) или биохимический рецидив после радикальной простатэктомии по поводу локализованного РПЖ (n = 51), назначение аЛГРГ в непрерывном режиме, ожидаемая продолжительность жизни не менее 3 лет.
Критерии исключения:
- метастатический РПЖ (Т1-4N1M0, Т1-4N0M1);
- тяжелые заболевания или патологические состояния: выраженные изменения в лабораторных анализах на момент или за 30 дней до включения в исследование;
- активная неконтролируемая инфекция, пептическая язва;
- аутоиммунные заболевания (системная красная волчанка, склеродермия, ревматоидный артрит);
- прием глюкокортикостероидов;
- одновременное лечение другими экспериментальными препаратами, противоопухолевыми препаратами (окончание терапии не менее чем за 30 дней до начала настоящего исследования);
- сомнения в комплаентности пациента.
У всех больных определяли уровни ТТГ и сТ4 перед началом АДТ и спустя 12 месяцев терапии, оценивали ИМТ и ОТ, уровень общего холестерина (ОХ) исходно и спустя 3, 6 и 12 месяцев АДТ.
Для биохимических тестов были взяты образцы крови с утра натощак. Тесты проводились в одной лаборатории. Концентрации гормонов ЩЖ определялись методом иммунохемилюминесцентного ИФА. Диапазон нормальных показателей сT4 — 7,86–14,41 пмоль/л, сывороточного ТТГ — 0,38–5,33 мкМЕ/мл. Исследования выполнены на оборудовании UniCel DXI 800 (Beckman Coulter, США).
Андрогенная депривация подразумевала прием препаратов в постоянном режиме. Препараты ЛГРГ: гозерелин в дозе 3,6 мг подкожно 1 раз в 28 дней или в дозе 10,8 мг 1 раз в 12 недель, либо трипторелин в дозе 3,75 мг в/м 1 раз в 28 дней, либо бусерелин в дозе 3,75 мг в/м 1 раз в 28 дней, либо лейпрорелин 7,5 мг подкожно 1 раз в 28 дней или 22,5 мг подкожно 1 раз в 12 недель.
Уровень ПСА на старте терапии существенно варьировал — от 1,67 до 423 нг/мл — и в среднем составил 42,11 нг/мл. Уровень тестостерона до начала терапии был не менее 6,0 нмоль/л, в среднем — 13,4 нмоль/л. У всех пациентов в выборке достигались целевые низкие значения тестостерона на фоне терапии (менее 1,7 нмоль/л). Уровень ПСА исследовался каждые 3 месяца и через год от начала лечения составлял в среднем 0,18 нг/мл.
Полученные данные обрабатывались в программе IBM SPSS Statistics 23.0. Для парных выборок использовался t-критерий, парные сравнения проводились с помощью анализа на межгрупповые различия с течением времени по данным модели повторных измерений (MANOVA). Различия считали статистически значимыми при p < 0,05.
РЕЗУЛЬТАТЫ
В ходе исследования 3 пациента были исключены: двое начали терапию препаратом, потенциально влияющим на результаты, один больной исключен в связи с прогрессией заболевания. Наиболее частыми побочными эффектами терапии ожидаемо были приливы, потливость, утомляемость, снижение либидо, тошнота. Гинекомастия отмечалась у 3 пациентов. Эти нежелательные явления не требовали прекращения терапии.
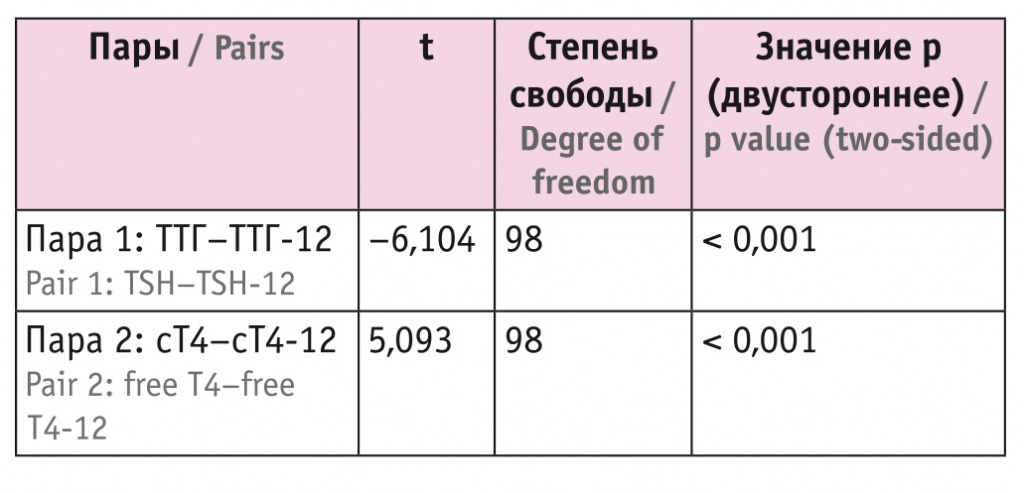
Средний уровень ТТГ в начале терапии составлял 1,67 мкМЕ/мл, через 12 месяцев он повысился до 1,91 мкМЕ/мл (данная разница статистически значима, p < 0,001) (табл. 1, рис. 1).
Таблица 1
Динамика средних значений тиреотропного гормона (ТТГ) и свободного тироксина (сТ4)
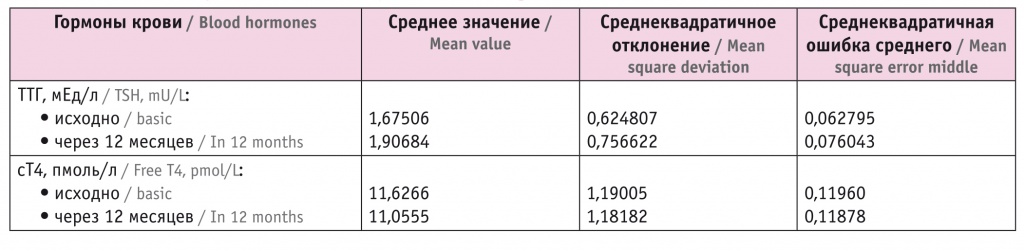
Рис. 1. Динамика средних значений тиреотропного гормона (ТТГ)
Как видно из таблицы 1, оба средних значения ТТГ находятся в рефренсном диапазоне, который составляет 0,4–4,0 мЕд/л.
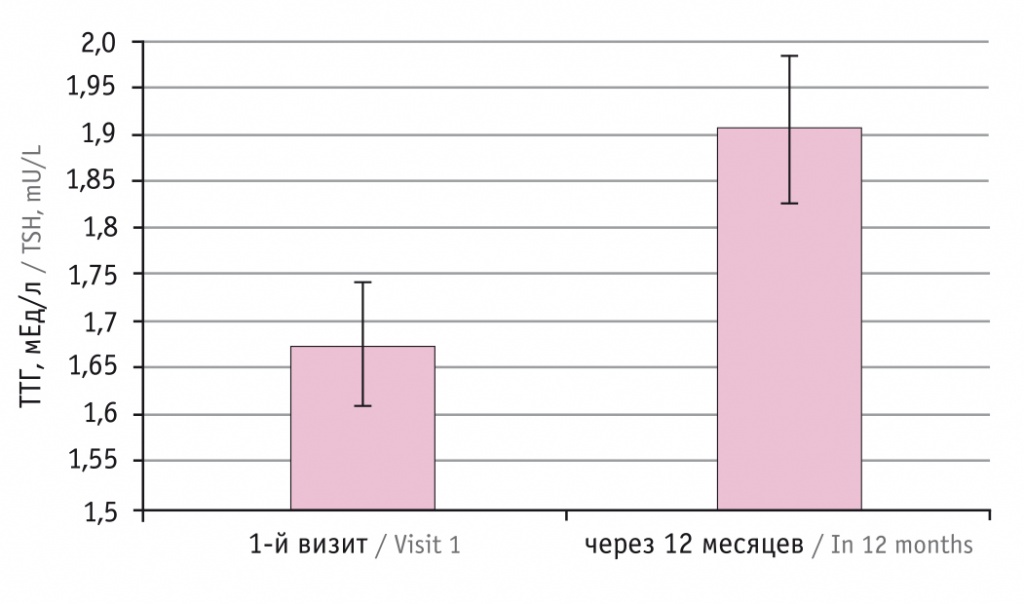
Средний уровень сТ4 перед началом АДТ был 11,63 пмоль/л, спустя год он снизился до 11,05 пмоль/л (данная разница статистически значима, p < 0,001) (см. табл. 1, рис. 2).
Рис. 2. Динамика средних значений свободного тироксина (сТ4)
При сравнении показателей ТТГ и сТ4 методом парных выборок разница оказалась статистически значимой (табл. 2).
Таблица 2
Сравнение выборок тиреотропного гормона и свободного тироксина (сТ4) до и через 12 месяцев после начала гормонотерапии (t-критерий для парных выборок)
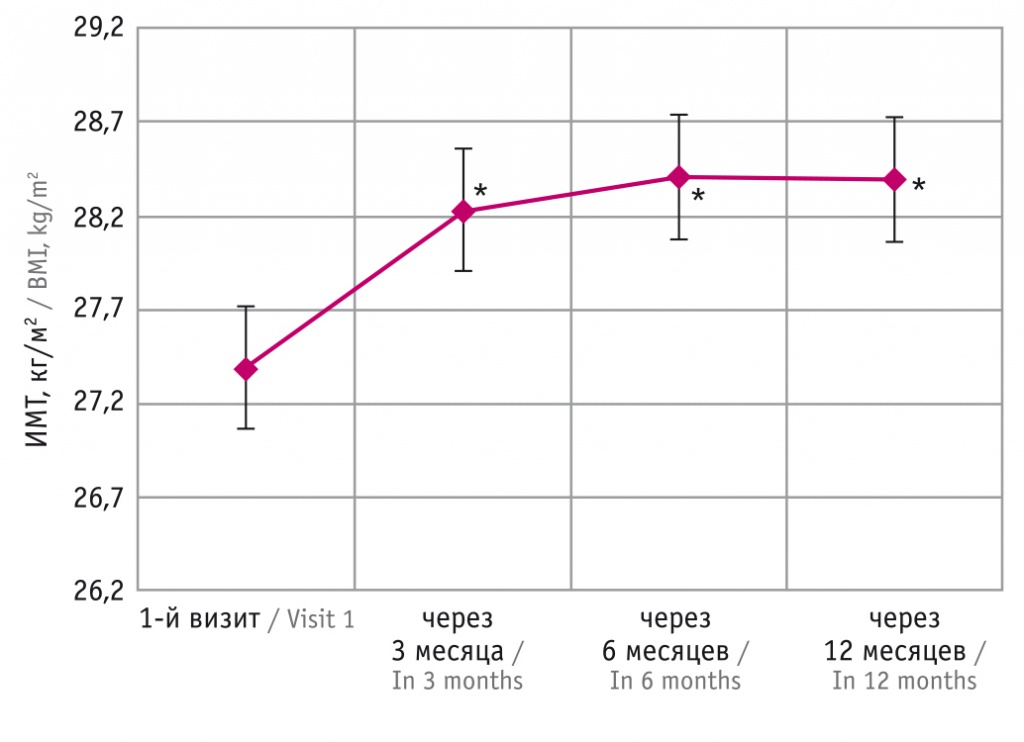
У пациентов также измеряли ИМТ и ОТ в начале терапии и спустя 3, 6 и 12 месяцев. Средний ИМТ участников исследования увеличился по сравнению с первоначальным уже через 3 месяца АДТ, но через 6 и 12 месяцев менялся менее выражено (для различия между результатами через 6 и 12 месяцев p = 0,995) (табл. 3, рис. 3).
Таблица 3
Динамика средних значений индекса массы тела (ИМТ), кг/м2
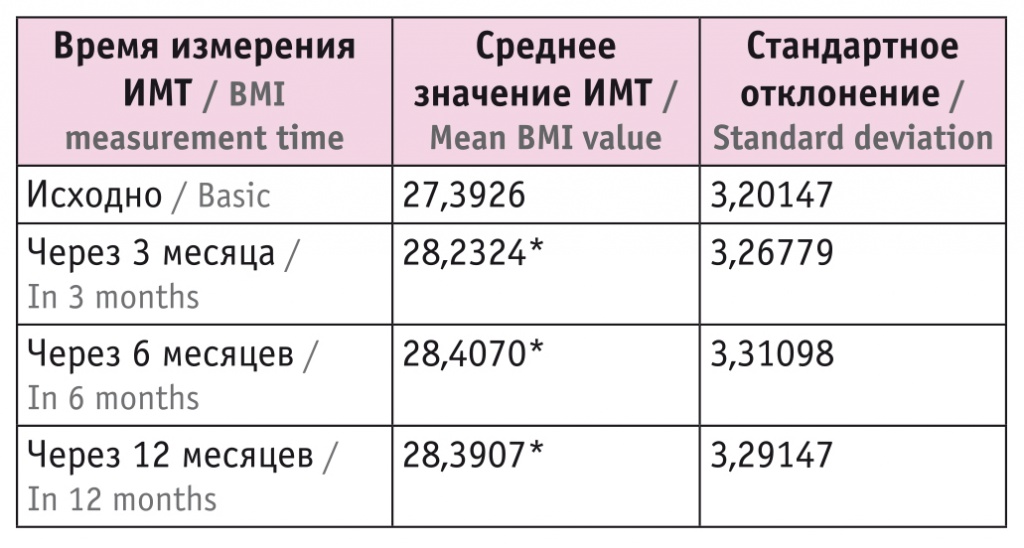
* Отличия от исходного показателя статистически значимы (p ≤ 0,004).
Рис. 3. График изменения средней величины индекса массы тела (ИМТ) с течением времени.
* Отличия от исходного показателя статистически значимы (p ≤ 0,004)
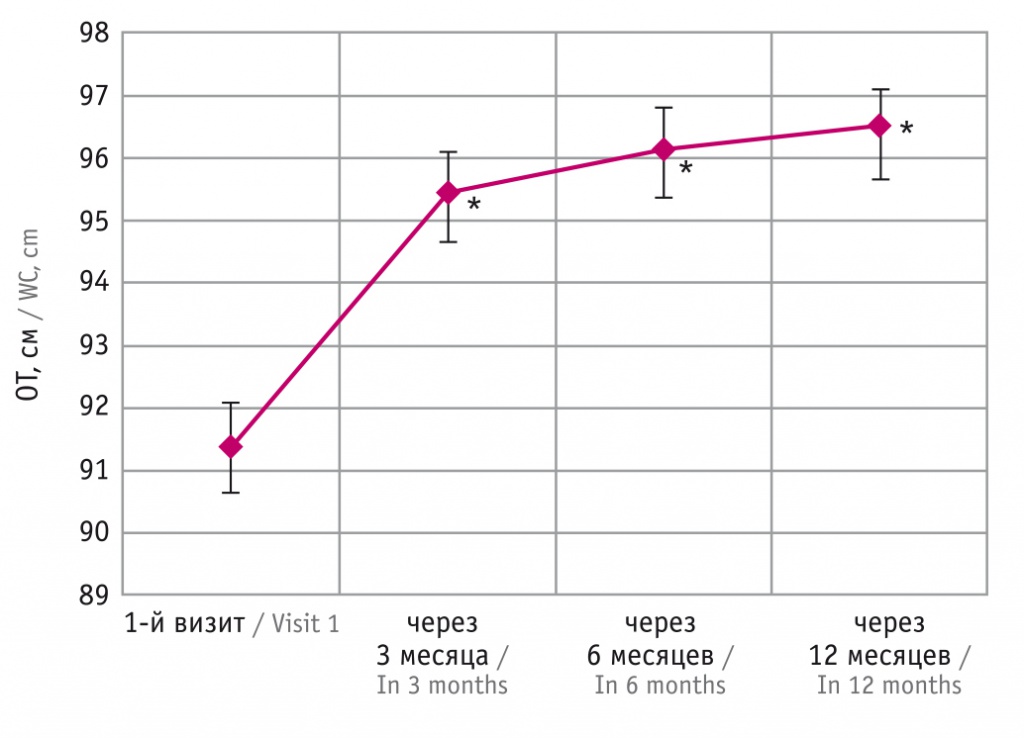
ОТ увеличилась на 4 см за первые 3 месяца терапии и на 1 см за последующие 3 месяца. Результат измерения ОТ через 12 месяцев АДТ незначимо отличается от результатов, зафиксированных спустя полгода терапии. При этом увеличение ОТ на фоне АДТ происходило быстрее прироста ИМТ (табл. 4, рис. 4).
Таблица 4
Динамика средней величины окружности талии (ОТ), см
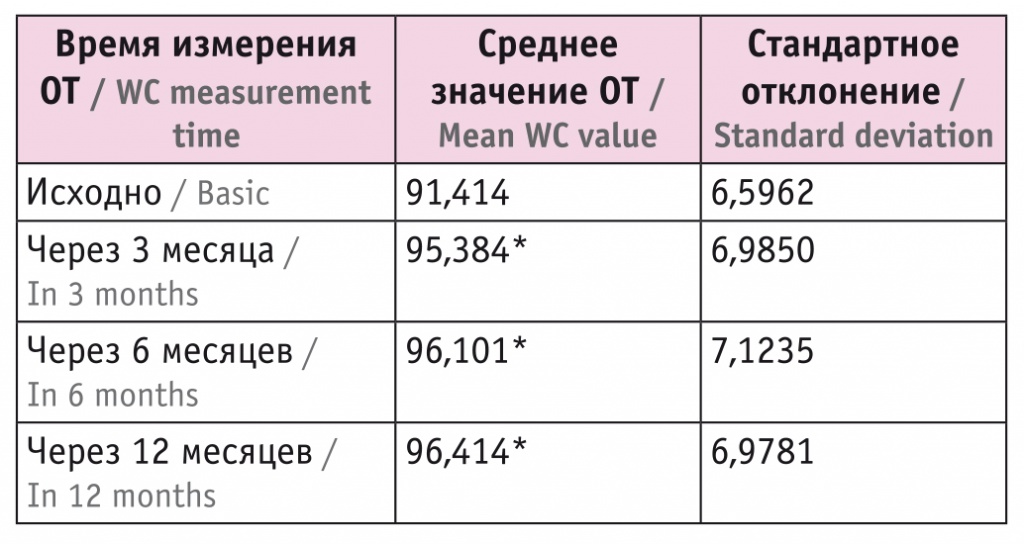
* Отличия от исходного показателя статистически значимы (p ≤ 0,017).
Рис. 4. График изменения средней величины окружности талии (ОТ) с течением времени.
* Отличия от исходного показателя статистически значимы (p ≤ 0,017)
Анализ по показателям ИМТ и ОТ на межгрупповые различия с течением времени производился по данным модели повторных измерений (MANOVA) — различия статистически значимы (p < 0,001).
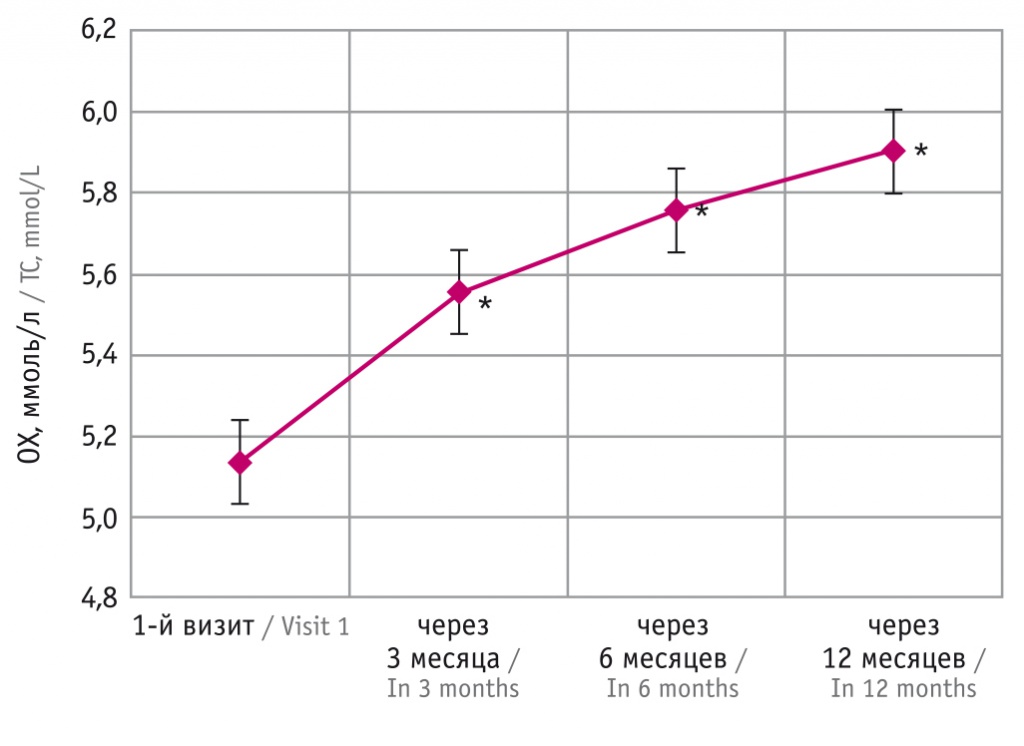
В исследовании оценивали и уровень ОХ. Выявлено, что перед началом лечения он составил 5,15 ± 0,83 ммоль/л. Через 3 месяца после начала терапии отмечено статистически значимое увеличение показателя, изменение составило 0,43 ммоль/л. Далее в течение года сохранялась тенденция к повышению значения, что представлено в таблице 5. Наиболее значительные изменения произошли в первые 3 месяца (рис. 5). За год прирост среднего значения ОХ составил 0,75 ммоль/л.
Таблица 5
Изменение средних значений общего холестерина (ОХ) с течением времени, ммоль/л
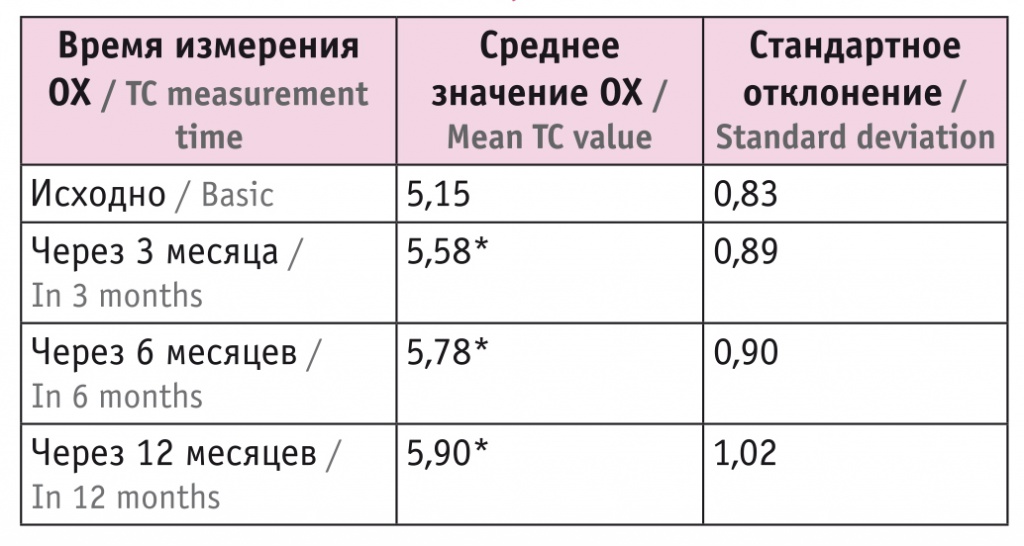
* Отличия от исходного показателя статистически значимы (p < 0,001).
Рис. 5. График изменений средних значений общего холестерина (ОХ) с течением времени.
* Отличия от исходного показателя статистически значимы (p < 0,001)
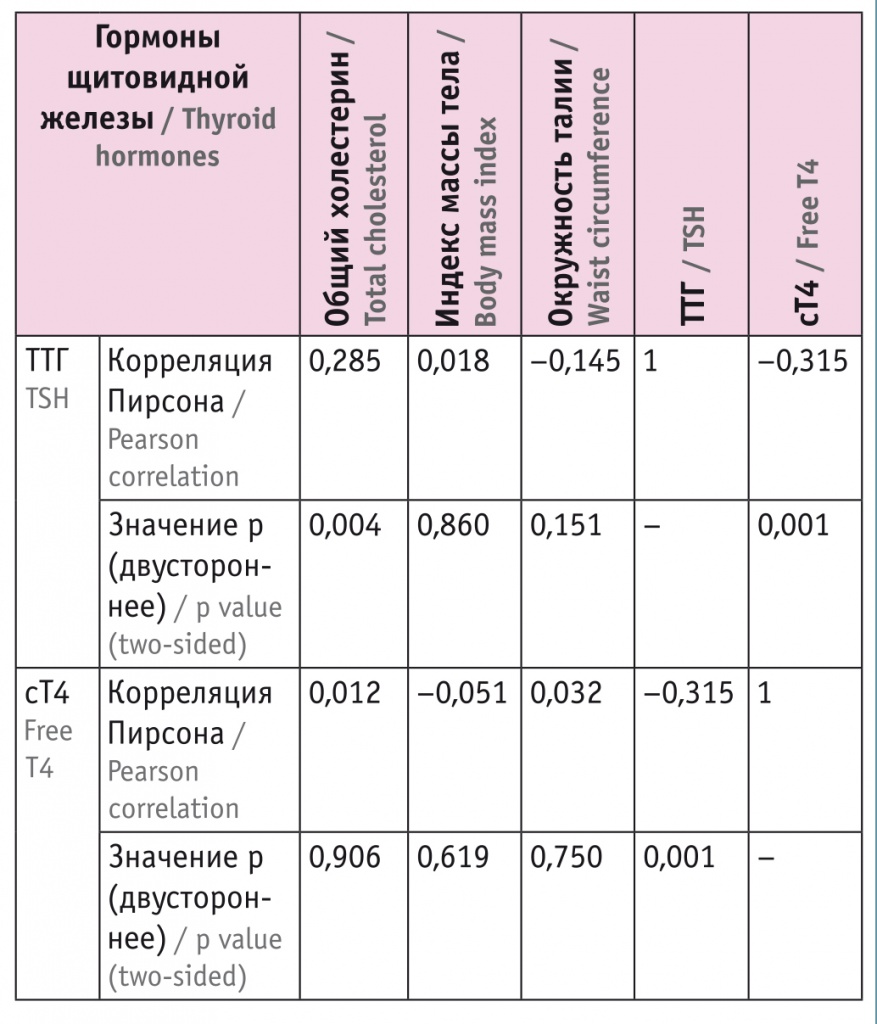
При статистическом анализе методом парных сравнений выявлена статистическая значимость изменения среднего показателя в каждой временно́й точке. С целью установления возможных связей мы оценили корреляцию показателей функции ЩЖ между собой и с другими параметрами (табл. 6). Статистически значимая положительная корреляция получена между динамикой уровней ТТГ и ОХ (R = 0,285, p = 0,004), статистически значимая отрицательная корреляция — между динамикой содержания ТТГ и сТ4 (R = –0,315, p = 0,001).
Таблица 6
Корреляции изменений уровней тиреотропного гормона (ТТГ) и свободного тироксина (сТ4) с динамикой других показателей
ЗАКЛЮЧЕНИЕ
В ходе исследования мы отмечали увеличение уровня ТТГ и снижение содержания сТ4 спустя год андрогендепривационной терапии (АДТ), хотя средние их значения не выходят за рамки рефренсных. При этом наблюдается корреляция уровней ТТГ и сТ4 между собой (отрицательная) и ТТГ и уровня общего холестерина (ОХ) (положительная).
Можно предположить, что одним из механизмов повышения уровня ОХ, посредством которого реализуются метаболические нарушения, являются изменения в гипоталамо-гипофизарно-тиреоидной оси. При этом также прогрессирует висцеральное ожирение, о чем говорит более значительный прирост окружности талии (ОТ) в течение года АДТ по сравнению с изменением ИМТ. Максимальное увеличение ОТ происходило в первые три месяца от начала АДТ. Однако корреляция показателей функции щитовидной железы и ИМТ и ОТ в нашей работе не выявлена.
Результаты данного исследования перекликаются с результатами, полученными R. Hoermann и соавт.[18]: наряду с повышением ИМТ зарегистрирован рост уровня ТТГ спустя 12 месяцев АДТ, — но и отличаются от конечных данных австралийского исследования тем, что зафиксировано небольшое, но статистически значимое снижение содержания сТ4, а также увеличение ОТ, позволяющее сделать вывод о прогрессировании висцерального ожирения.
Влияние гормонотерапии агонистами ЛГ рилизинг-гормона на метаболические параметры обусловлено андрогенной депривацией: резким и выраженным снижением концентраций мужских половых гормонов. Тем не менее еще раз подтверждаются изменения работы гипоталамо-гипофизарно-тиреоидной оси при АДТ. Требуются дальнейшие, более длительные исследования влияния гормонотерапии при лечении рака предстательной железы на метаболические параметры с целью выявления их нарушений и возможной коррекции.
Поступила: 18.02.2020
Принята к публикации: 23.03.2020








