В настоящее время ожирение является одной из ведущих медицинских проблем в Российской Федерации. По данным ВОЗ, распространенность избыточной массы тела и ожирения в российской популяции составила 59,2% и 23,1% соответственно, т. е. приобрела характер пандемии[1]. По результатам проведенного в РФ многоцентрового наблюдательного исследования ЭССЕ-РФ (Эпидемиология сердечно-сосудистых заболеваний и их факторов риска в регионах РФ) с участием 25 224 человек в возрасте 25–64 года, частота ожирения в популяции достигла 29,7%[1].
ОЖИРЕНИЕ КАК ФАКТОР РИСКА ВИРУСНЫХ ЗАБОЛЕВАНИЙ
Сегодня ожирение рассматривается как важнейший фактор риска множества коморбидных заболеваний, включая СД 2 типа (СД2), патологию сердечно-сосудистой системы, нейродегенеративные заболевания, онкологию и неалкогольную жировую болезнь печени. Особую роль ожирение играет в развитии инфекций. Показано, что пациенты с ожирением более подвержены инфекционным заболеваниям и их отягощенному течению[3].
При анализе результатов обследования 268 больных, госпитализированных с гриппом А (H1N1) в Калифорнии, отмечено, что у 58% из них диагностировано ожирение (ИМТ ≥ 30 кг/м2), причем наличие морбидного ожирения (ИМТ ≥ 40 кг/м2) ассоциировалось с летальным исходом.
Исследование, проведенное в Мексике, подтвердило более высокий риск госпитализации при наличии ожирения (особенно морбидного) не только при гриппе, но и при заболеваниях, вызванных другими вирусными патогенами, включая коронавирус, метапневмовирус, парагрипп и риновирус[4].
Начало 2020 г. ознаменовалось пандемией новой коронавирусной инфекции, которая характеризуется высокой летальностью (от 2% до 10%)[5]. В результате проведенных эпидемиологических исследований стало понятно, что тяжесть течения инфекции COVID-19 и риск летальных исходов связаны с такими факторами, как пожилой возраст пациентов[6] и наличие сопутствующих заболеваний — СД2, сердечно-сосудистых заболеваний, АГ и онкологии[7]. Недавние исследования, проведенные во многих странах, показали, что важный независимый фактор прогнозирования риска инфицирования COVID-19 и неблагоприятного исхода данного заболевания — наличие ожирения[8].
Наиболее крупным и значимым по числу проанализированных случаев в настоящий момент является отчет Национального центра аудита и исследований интенсивной терапии (ICNARC) Великобритании. В нем изучены данные по 5578 пациентам, госпитализированным в отделение интенсивной терапии в связи с тяжелым течением COVID-19, среди которых 63% имели ожирение или избыточную массу тела. Более того, из 1795 пациентов, которым потребовалась расширенная респираторная поддержка, почти у 70% отмечалось ожирение или избыток массы тела1.
По результатам других исследований, проведенных в США, среди пациентов с ИМТ > 30 кг/м2 частота госпитализаций по поводу инфекции COVID-19 в обычное отделение стационара или в ОРИТ оказалась в 2 раза и в 1,8 раза выше, чем у пациентов без ожирения. Более заметное различие отмечено у пациентов с ИМТ > 35 кг/м2, для которых повышение вероятности госпитализации в обычные отделения стационара или в ОРИТ составило 2,2 и 3,6 раза соответственно[9].
Еще одно подтверждение тесной связи ожирения и тяжести течения инфекции COVID-19 получено во французском исследовании A. Simonnet, по результатам которого среди больных с тяжелым течением COVID-19, находившихся на ИВЛ, доля лиц с ожирением оказалась в 2 раза больше, чем с нормальной массой тела[10]. Кроме того, в группе пациентов с ИМТ > 35 кг/м2 частота тяжелого течения инфекции с необходимостью использования ИВЛ могла достигать 90%[10].
Таким образом, имеющиеся эпидемиологические данные о протекании COVID-19 позволяют выделить ожирение в качестве важнейшего прогностического фактора риска тяжелого течения этого заболевания, критических состояний и смерти[10].
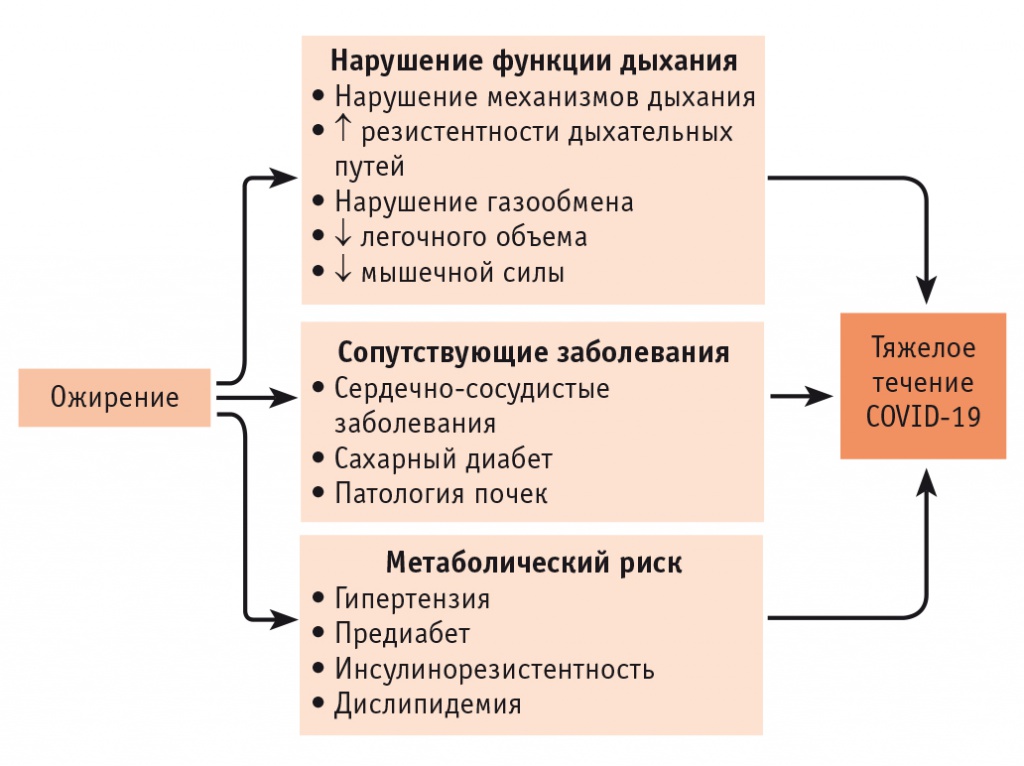
В основе более высокой частоты встречаемости и тяжести течения инфекции COVID-19 у пациентов с ожирением лежит комплекс факторов, главными из которых являются увеличение сердечно-сосудистого риска, в том числе склонность к тромбозам, снижение эффективности дыхательной системы, нарушение иммунного ответа, наличие хронического воспалительного состояния, а также нарушение метаболического ответа (рис. 1) [11].
Рис. 1. Множественные патогенетические пути, обеспечивающие взаимосвязь ожирения и увеличения тяжести течения инфекции COVID-19[11]
Ожирение считается общепризнанным источником хронического воспаления, поскольку сопровождается продукцией провоспалительных цитокинов и увеличением содержания белков острой фазы[12]. Пациенты с ожирением имеют более высокую активность ядерного фактора транскрипции (NF-κB) и более высокую экспрессию РНК провоспалительных цитокинов, таких как ФНО-α, ИЛ-2 и ИЛ-6[12]. Нарушение баланса между про- и противовоспалительными факторами снижает резистентность организма в борьбе с инфекциями и способствует развитию осложнений со стороны различных органов-мишеней вируса COVID-19, в том числе одного из самых опасных осложнений — цитокинового шторма. Причиной развития последнего является активация выработки интерферона, интерлейкинов, хемокинов, ФНО и колониестимулирующего фактора, однако главное патогенетическое звено связано с гиперпродукцией ИЛ-6[13].
По данным метаанализа крупных рандомизированных многоцентровых исследований, уровень ИЛ-6 — сильный и независимый предиктор летальных исходов при инфекции, вызванной COVID-19[14]. Поскольку жировая ткань человека является главным источником ИЛ-6 и его рецептора ИЛ-6R[14], она способна обеспечивать резервуар для активации ИЛ-6 и каскадной передачи сигналов при вирусной инфекции.
Распространение вируса из пораженных органов в окружающую их жировую ткань занимает несколько дней, что способствует у пациентов с ожирением развитию отсроченного цитокинового шторма с повреждением сердца, легких и печени[14].
Негативные эффекты хронического воспаления у больных с ожирением дополняются нарушениями клеточного иммунитета. Известно, что важным фактором иммунодефицита у лиц с ожирением становится нарушение структуры и целостности лимфоидной ткани за счет избыточного отложения жировой ткани[15]. Любое изменение архитектуры лимфоидной ткани может отрицательно повлиять на ее функционирование, что приводит к изменению распределения популяций иммунных клеток, нарушению активности Т-клеток и снижению иммунной защиты.
По данным В. Adler и соавт., ожирение и метаболический синдром оказывают сильное влияние на функционирование лимфоидной ткани[16]. Ожирение приводит к увеличению отложения липидов в первичных лимфоидных органах (костном мозге и тимусе), что нарушает распределение популяции лейкоцитов и вызывает заметное изменение общей иммунной защиты[16].
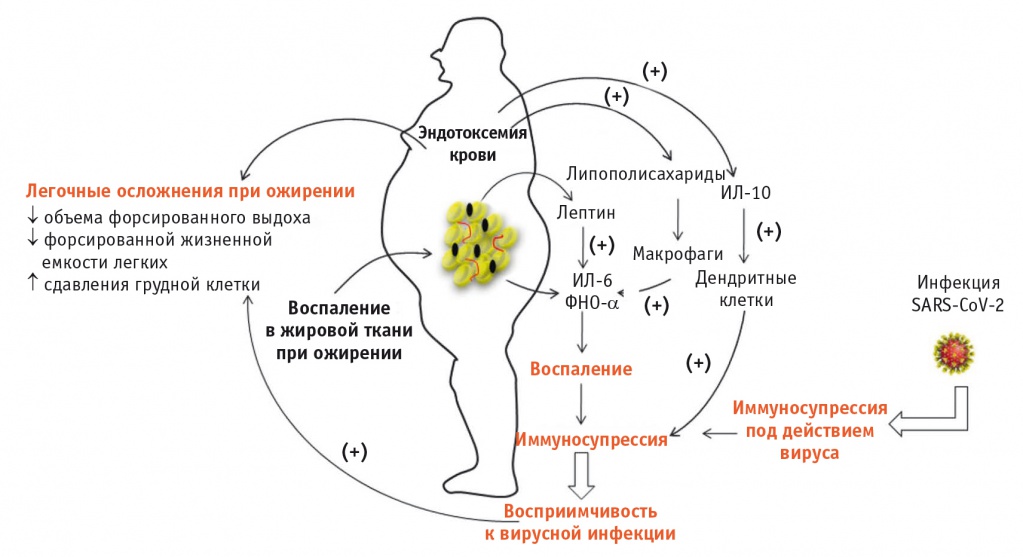
Предполагается, что ожирение способствует преждевременному «старению» иммунной системы, а наиболее заметные изменения наблюдаются у пожилых людей[17]. В целом ожирение нарушает целостность иммунной системы и значительно воздействует на развитие, миграцию и разнообразие лейкоцитов у пациентов с COVID-19 (рис. 2).
Рис. 2. Схема развития иммуносупрессии у пациентов с ожирением[18].
Примечание: ИЛ — интерлейкин, ФНО — фактор некроза опухоли
Не меньшее значение в патогенезе COVID-19 у пациентов с ожирением имеет увеличение сердечно-сосудистых рисков. В последние годы стало понятно, что повышенная масса тела не всегда ассоциируется с высоким сердечно-сосудистым риском и ухудшением прогноза[19]. Традиционные показатели для определения наличия и степени ожирения, такие как окружность талии и ИМТ, продемонстрировали низкую специфичность[20]. Этим объясняется возрастающий интерес к изучению висцерального (или эктопического) ожирения, которое, по результатам многочисленных исследований, стало считаться патогенетической платформой для развития метаболических нарушений, сердечно-сосудистых заболеваний, а также тяжелого течения инфекции COVID-19[21].
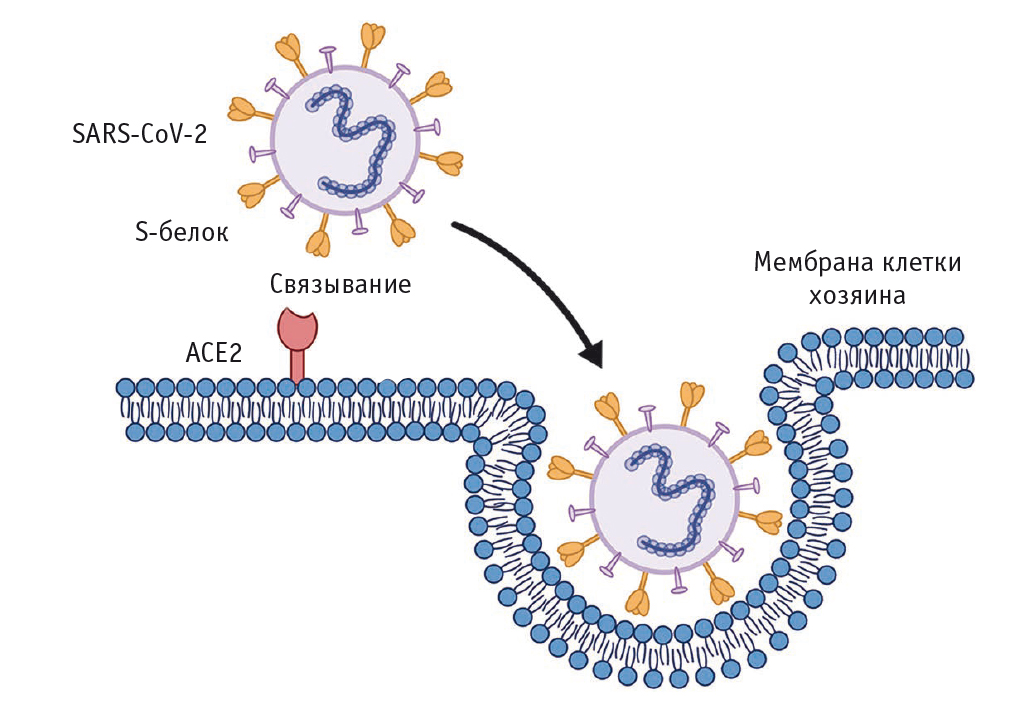
Особую роль играет жировая ткань, окружающая сердце и коронарные сосуды, в частности эпикардиальная жировая ткань (ЭЖТ). По сравнению с подкожными жировыми клетками в эпикардиальных адипоцитах отмечена более сильная экспрессия ангиотензинпревращающего фермента 2 (ACE2) — активного транспортера вируса в клетку организма-хозяина. Это обусловливает негативную роль ЭЖК в качестве вирусного резервуара при COVID-19 (рис. 3)[22].
Рис. 3. Схема проникновения вирусных частиц SARS-CoV-2 в эпикардиальную жировую ткань с участием ангиотензинпревращающего фермента 2 (ACE2)[23]
Объемная и гиперваскуляризованная ЭЖТ у людей с ожирением может способствовать более активному распространению вируса, иммунному ответу и большей секреции провоспалительных цитокинов[24]. Кроме того, у пациентов с COVID-19 ЭЖТ способна непосредственно передавать провоспалительный секрет в миокард через сеть мелких кровеносных сосудов vasa vasorum, а также паракринно. Это, в свою очередь, усиливает сигнальный воспалительный каскад и способствует развитию дисфункции кардиомиоцитов, миокардита и ХСН.
Высокие сердечно-сосудистые риски у пациентов с ожирением тесно связаны с еще одним патогенетическим фактором — повышенной склонностью к тромбообразованию[25]. Известно, что ожирение само по себе увеличивает риск тромбоэмболий легочной артерии[25]. Это объясняется более высокими уровнями факторов свертываемости крови, повышенным соотношением тромбин/антитромбин, а также гиперактивацией тромбоцитов[26]. Согласно данным К.Н. Borch и соавт., у больных с ожирением риск артериальных тромбозов и венозных тромбоэмболий повышен в 2–5 раз[27].
Анализ свертывающей системы показал, что при коронавирусной инфекции значимо увеличиваются уровни D-димеров и антифосфолипидных антител, поэтому одним из важных элементов лечения данной категории пациентов является адекватная гипокоагуляция для профилактики тромботических осложнений[27].
Еще один негативный эффект ожирения — снижение эффективности дыхательной системы. В первую очередь это связано с рестриктивными нарушениями дыхания за счет уменьшения остаточного объема и жизненной емкости легких. Кроме того, отложение жировой ткани вокруг ребер повышает массу грудной клетки и снижает растяжимость ее стенок, что обусловливает затруднения в увеличении объема грудной клетки на вдохе и выдохе. Отложение жировой ткани в средостении ограничивает подвижность легких, а при избыточном отложении жира в брюшной полости уменьшается экскурсия диафрагмы[28].
Отмеченное у таких больных снижение объема форсированного выдоха также свидетельствует о вкладе ожирения в патогенез дыхательных нарушений и обструктивной составляющей[28]. По этой причине даже у относительно здоровых людей с ожирением наблюдается смешанный характер дыхательных нарушений, который объясняет склонность к снижению сатурации крови кислородом и развитию гиперкапнии. Дополнительный вклад в развитие гипоксии у подобных пациентов вносит высокая частота синдрома апноэ во сне[29].
Таким образом, ожирение снижает резервы дыхательной системы, повышая риски легочных осложнений и ухудшая прогноз пациентов с инфекцией COVID-19.
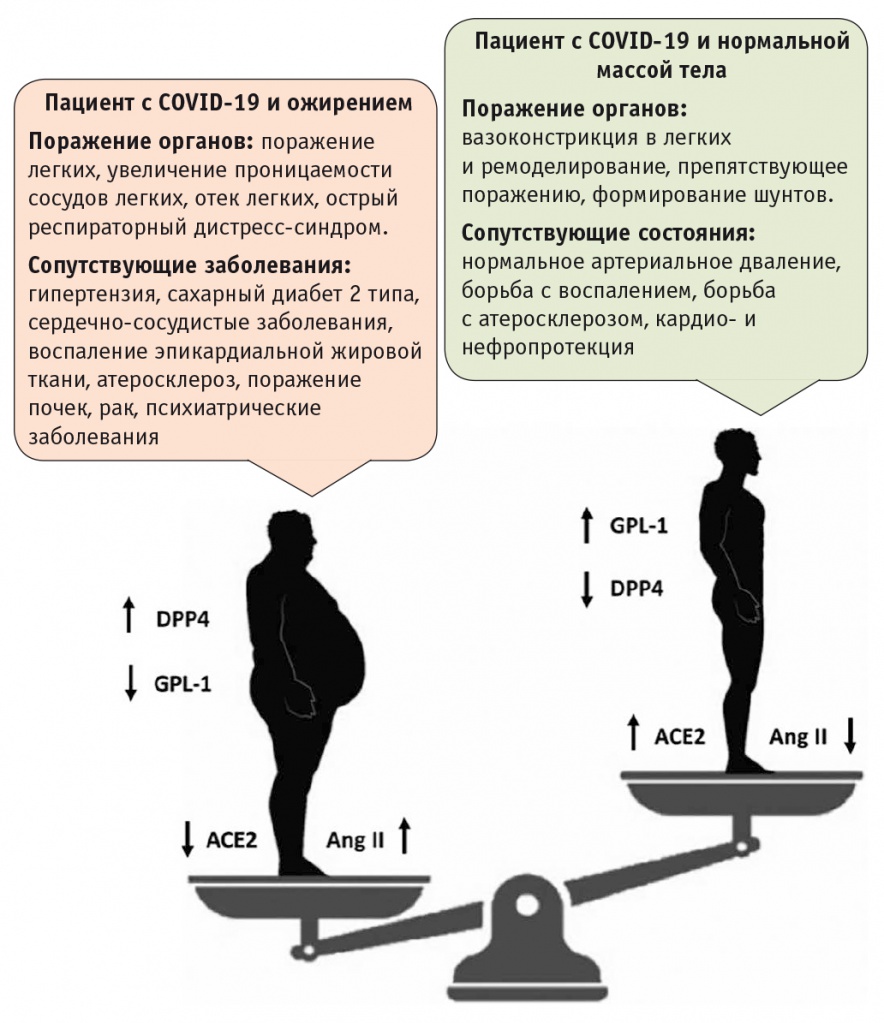
Не вызывает сомнений, что перечисленные патогенетические пути, обеспечивающие взаимосвязь ожирения и тяжести течения COVID-19, приводят к значительному увеличению числа осложнений у таких больных (рис. 4). В последнее время в качестве важного маркера возможных осложнений COVID-19 стали рассматривать соотношение уровней дипептидилпептидазы 4 типа (DPP-4) и глюкогоноподобного пептида 1 типа (GLP-1) — важных биологически активных веществ, принимающих участие в регуляции углеводного обмена. Показано, что трансмембранный белок DPP-4 может выступать в качестве функционального рецептора для спайк-белка многих вирусов, в том числе для вируса ближневосточного респираторного синдрома (MERS)-CoV[24]. Кроме того, DPP-4 играет важную роль в процессах регуляции иммунной системы, активируя пути Т-клеток и NK-κB[30].
Рис. 4. Дисбаланс факторов, приводящих к развитию осложнений у пациентов с инфекцией COVID-19 и нормальной массой тела или ожирением[24].
Примечание: ACE2 — ангиотензинпревращающий фермент 2, Ang II — ангиотензин II, DPP-4 — дипептидилпептидаза 4 типа, GLP-1 — глюкогоноподобный пептид 1 типа
Пептид GLP-1, напротив, обладает плейотропными защитными свойствами, которые включают кардиопротективное, противовоспалительное и иммуномодулирующее, антифибротическое, антитромботическое и вазопротективное действие[31]. Выявленные особенности обмена биологически активных веществ могут использоваться для разработки подходов к лечению инфекции COVID-19 у пациентов с ожирением.
Анализ последствий пандемии COVID-19 показал, что ее негативные эффекты связаны не только с самой инфекцией и ее осложнениями, но и с изменениями образа жизни населения. Проведение национальных карантинных мероприятий привело к повышению распространенности гиподинамии, усилению стресса и изменению пищевого поведения населения, замыкая порочный круг и способствуя повышению массы тела. По данным итальянского исследования пищевых привычек и изменения образа жизни во время пандемии COVID-19, в котором приняли участие 3533 человека в возрасте от 12 до 86 лет, 34,4% респондентов отмечали усиление аппетита, 40,3% — незначительную прибавку массы тела, 8,3% — значительную прибавку[32].
Получены данные, что снижение ежедневной физической активности у молодых здоровых мужчин всего на 2 недели приводит к потере мышечной массы и увеличению висцеральной жировой массы, инсулинорезистентности и повышению уровня триглицеридов в плазме[33]. Еще более заметные изменения метаболизма наблюдаются в результате соблюдения постельного режима во время инфекции COVID-19[34]. Наконец, часто выявляемые депрессия и тревога после перенесенной инфекции COVID-19 также способствуют увеличению массы тела[35].
Понимание взаимоотягощающего влияния ожирения и COVID-19 определяет необходимость превентивных мер, направленных на уменьшение рисков не только неблагоприятных исходов коронавирусной инфекции, но и прогрессирования хронических заболеваний, а также снижения общего иммунного ответа организма.
СОВРЕМЕННЫЕ ПОДХОДЫ К БОРЬБЕ С ОЖИРЕНИЕМ В УСЛОВИЯХ ПАНДЕМИИ НОВОЙ КОРОНАВИРУСНОЙ ИНФЕКЦИИ
Усилия врачей терапевтических специальностей должны быть направлены в первую очередь на повышение устойчивости к инфекции среди больных ожирением. Самым эффективным нефармакологическим методом иммуномодуляции является умеренная аэробная физическая нагрузка, снижающая выработку провоспалительных цитокинов, повышающая уровень адипонектина и позитивно влияющая на инсулино- и лептинорезистентность[36].
Наиболее вероятным клеточным механизмом действия физической активности в данном случае считается активация АМФ-зависимой протеинкиназы. Другие рекомендации по увеличению устойчивости к инфекции должны включать отказ от употребления переработанных продуктов с низким содержанием клетчатки[37], ограниченное употребление гиперкалорийных продуктов и алкоголя[38], достаточный сон (не менее 7–8 часов в сутки)[39], а также стремление избегать хронического психоэмоционального стресса[40].
При рассмотрении фармакологической терапии у пациентов с ожирением в условиях пандемии COVID-19 следует отметить, что одной из первых групп препаратов, которые предложили использовать для борьбы с липотоксичностью при различных патологических состояниях, стали статины[41]. Ингибирование ГМГ-КоА-редуктазы под вилянием статинов приводит к снижению плазменных уровней холестерина ЛПНП и триглицеридов, что препятствует развитию липотоксичности под действием окисленных ЛПНП и обеспечивает противовоспалительный, антиоксидантный и антипролиферативный эффекты[42].
В наблюдательных исследованиях показана эффективность лечения статинами при вирусных инфекциях — снижение количества госпитализаций и смертельных исходов у пациентов с гриппом[43]. В настоящее время не вызывает сомнений, что с учетом небольшой стоимости, хорошей переносимости и большого объема накопленных клинических данных использование статинов в составе комплексной терапии пациентов с COVID-19 позволяет снизить массу и объем жировой ткани, а также уменьшить число инфекционных осложнений[44].
Одним из наиболее изученных и широко применяемых препаратов первого ряда для лечения ожирения является метформин[45]. Результаты недавних экспериментальных исследований свидетельствуют, что, помимо хорошо изученного механизма — индукции АМФ-активируемой протеинкиназы печени, играющей важную роль в поддержании энергетического баланса клетки, метформин обладает важными альтернативными механизмами действия[45]. Он улучшает организацию митохондрий, позитивно влияет на функцию кардиомиоцитов за счет активации процесса аутофагии, а также снижает выработку воспалительных цитокинов ИЛ-6 и ФНО-α[46].
По данным ретроспективного исследования C.T. Bramante и соавт. с участием более 9 тыс. пациентов с инфекцией COVID-19 и избыточной массой тела или ожирением (ИМТ > 25 кг/м2), использование мефтормина в когорте амбулаторных больных связано со значимым снижением смертности от COVID-19 (отношение рисков (ОР) = 0,32; 95%-ный ДИ: 0,15–0,66, p = 0,002), а также с тенденцией к уменьшению числа госпитализаций по поводу COVID-19 (ОР = 0,78, 95%-ный ДИ: 0,58–1,04; p = 0,087)[47].
Вместе с тем при тяжелом течении инфекции COVID-19 с декомпенсацией углеводного обмена применение метформина может сопровождаться рисками развития лактацидоза, обезвоживания и острого почечного повреждения. В связи с этим у таких пациентов рекомендован переход на лечение инсулином короткого действия2.
С учетом описанной ранее роли DPP-4 в развитии COVID-19 предприняты попытки изучения эффективности ингибиторов DPP-4 (таких как ситаглиптин, вилдаглиптин и линаглиптин) в качестве средств, блокирующих взаимодействие вируса и DPP-4 и препятствующих проникновению вируса внутрь клетки[48]. Известно, что ингибирование DDP-4 уменьшает воспаление и имеет антифибротические свойства. Ингибиторы DPP-4 могут обеспечивать некоторые защитные эффекты при тяжелом течении COVID-19, однако эффективность и безопасность данной группы препаратов при инфекции COVID-19 требует дополнительного изучения[48].
Еще одной группой препаратов, которая привлекла внимание ученых с учетом важной роли GLP-1 в защите организма от COVID-19, стали агонисты рецепторов GLP-1 (АрГПП-1). Показана выраженная противовоспалительная активность АрГПП-1[49], которая теоретически может блокировать воспалительный ответ на вирус SARS-CoV2 со стороны легких.
Получены данные о дозозависимом увеличении выработки NO в культуре эндотелиальных клеток под действием лираглутида за счет активации эндотелиальной NO-синтазы, а также о сопутствующем угнетении экспрессии генов молекул клеточной адгезии и маркеров воспаления (VCAM-1, E-селектина, ICAM-1, хемоаттракционного белка моноцитов 1), что объясняет выраженные кардиопротективные и нефропротективные эффекты представителей класса АрГПП-1[50].
Недавно выяснено, что применение препаратов из группы АрГПП-1 до инфицирования вирусом COVID-19 сопровождалось снижением риска смерти и других неблагоприятных исходов, например госпитализаций в обычные отделения стационара или в ОРИТ[51].
Таким образом, с учетом выраженного противовоспалительного действия и позитивных метаболических и кардиоренальных эффектов АрГПП-1 в настоящее время являются одним из лучших вариантов лечения СД2 и ожирения в условиях пандемии COVID-19[52].
Негативные эффекты препаратов данной группы при тяжелом течении инфекции могут быть связаны со снижением аппетита и побочными реакциями со стороны ЖКТ, поэтому в каждом случае решение о продолжении лечения препаратами АрГПП-1 на фоне инфекции COVID-19 следует принимать индивидуально[52].
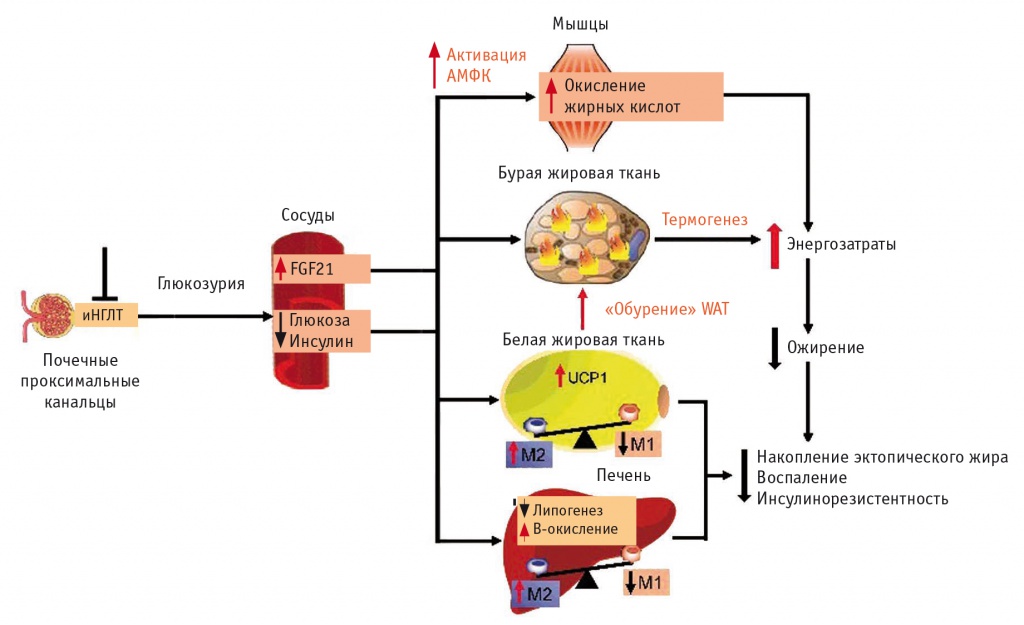
Наиболее заметное влияние на массу жировой ткани отмечено у сахароснижающих препаратов из группы ингибиторов натрий-глюкозного котранспортера 2 типа (иНГЛТ-2), или глифлозинов, — единственной группы антигипергликемических препаратов с доказанным эффектом снижения массы тела. Механизм действия иНГЛТ-2 связан с селективным подавлением активности НГЛТ-2, что приводит к снижению почечного порога глюкозы, уменьшению реабсорбции глюкозы и натрия в проксимальных почечных канальцах и увеличению экскреции глюкозы с мочой и осмотическому диурезу. Повышенная потеря глюкозы с мочой (70–80 г/сут) как энергетического субстрата сопровождается снижением массы тела и уменьшением центральной и периферической инсулинорезистентности[52].
Другие протективные эффекты иНГЛТ-2 включают активизацию АМФ-активируемой протеинкиназы и стимуляцию процесса фосфорилирования ацетил-КоА-карбоксилазы в скелетной мускулатуре, что сопровождается развитием существенного липолитического эффекта. Кроме того, иНГЛТ-2 стимулируют процесс преобразования белой жировой ткани в бурую, что усиливает расходование энергии[52].
Другой позитивный эффект иНГЛТ-2 связан с увеличением чувствительности инсулиновых рецепторов за счет поляризации макрофагов M2 в жировой ткани и в печени, что снижает накопление эктопического жира, уменьшает выраженность воспаления и инсулинорезистентности (рис. 5).
Рис. 5. Протективные эффекты ингибиторов натрий-глюкозного котранспортера 2 типа (иНГЛТ-2) у пациентов с ожирением[53].
Примечание: АМФК — АМФ-активируемая протеинкиназа, FGF21 — фактор роста фибробластов 21, UCP1 — разобщающий белок 1 типа, WAT — белая жировая ткань
Применение иНГЛТ-2 у пациентов, госпитализированных по поводу инфекции COVID-19, изучалось в ходе исследования DARE-19 — единственного рандомизированного двойного слепого исследования применения сахароснижающих препаратов у больных, госпитализированных с COVID-19, с наличием по крайней мере одного фактора кардиометаболического риска[54]. В исследовании показано, что использование иНГЛТ-2 дапаглифлозина было безопасным и характеризовалось хорошей переносимостью, однако не сопровождалось значимым снижением частоты дисфункции внутренних органов или смерти, а также не приводило к улучшению клинического состояния пациентов[54].
Вместе с тем с учетом возможных рисков развития кетоацидоза и острого почечного повреждения при тяжелом течении COVID-19 от использования данной группы препаратов следует отказаться, а коррекцию показателей гликемии проводить препаратами инсулина короткого действия3.
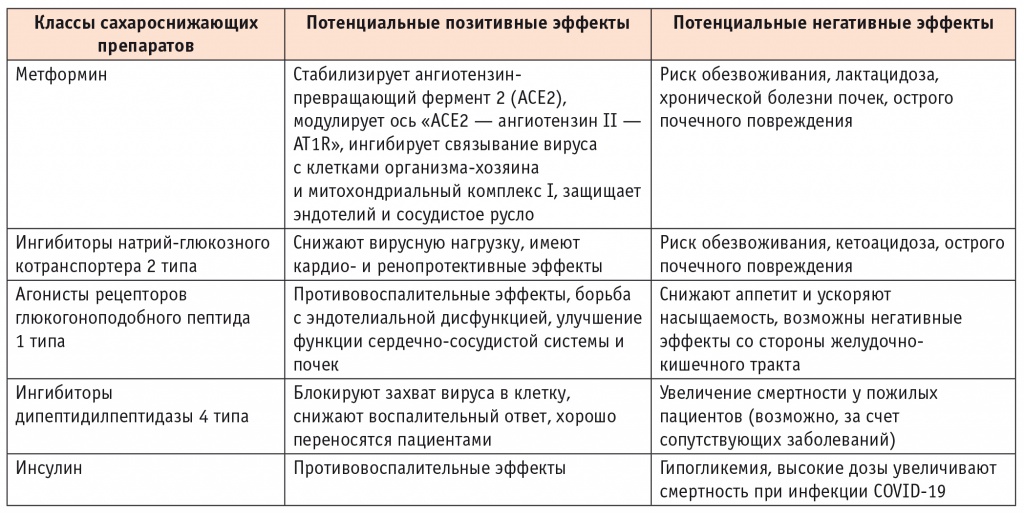
Сводные данные о положительных и негативных эффектах сахароснижающих препаратов у пациентов с инфекцией COVID-19 представлены в таблице. Важно отметить, что многие из этих данных получены в ходе ретроспективных исследований со значительным влиянием искажающих факторов в виде различных показаний к применению препаратов, различий профиля риска и тяжести инфекции COVID-19 у изученных пациентов.
Таблица
Потенциальные эффекты сахароснижающих препаратов у пациентов с инфекцией COVID-19[55]
ЗАКЛЮЧЕНИЕ
Ожирение является очевидным и важным фактором риска заболеваемости тяжелыми формами и смертности от COVID-19. Сочетание пандемий ожирения и инфекции COVID-19 требует реализации четких стратегий борьбы с ожирением, пропаганды здорового питания и повышения физической активности.
Представленный в настоящем обзоре существенный вклад ожирения в развитие COVID-19 определяет возможность использования врачами-инфекционистами и эндокринологами отдельных групп препаратов, влияющих на наиболее уязвимые патогенетические триггеры развития ожирения и сопутствующей патологии: процессы голода и насыщения, снижение чувствительности к инсулину, развитие липотоксичности и хронического воспаления. Спектр позитивных эффектов новых антигипергликемических препаратов из групп агонистов рецепторов глюкогоноподобного пептида 1 типа и ингибиторов натрий-глюкозного котранспортера 2 типа в сочетании с хорошо изученным профилем эффективности и безопасности представляет новую возможность для лечения ожирения в условиях пандемии COVID-19.
Поступила: 11.02.2022
Принята к публикации: 21.02.22
________
1 ICNARC report on COVID-19 in critical care 08 May 2020. URL: https://www.icnarc.org/Our-Audit/Audits/Cmp/Reports (дата обращения — 15.02.2022).
2 Royal United Hospitals Bath. NHS Foundation Trust. Urgent safety notice: use of SGLT2 inhibitors during the COVID-19 crisis. 2020. URL: https://www.ruh.nhs.uk/ (дата обращения — 15.02.2022).
3 Royal United Hospitals Bath. NHS Foundation Trust. Urgent safety notice: use of SGLT2 inhibitors during the COVID-19 crisis...







