ВВЕДЕНИЕ
Ревматоидный артрит (РА) — одно из самых распространенных хронических воспалительных заболеваний суставов, встречающееся у 1% населения мира. Несмотря на то что начало болезни чаще приходится на четвертое десятилетие жизни, РА может возникнуть в любом возрасте[1]. В первую очередь при РА поражаются суставы, что проявляется в виде прогрессирующего эрозивного синовита и деструктивного артрита. Однако у значительного числа пациентов (в 18–41% случаев) наряду с суставным синдромом возникают внесуставные (системные) проявления (ВП)[1–3]. Спектр ВП охватывает различные состояния с разными прогнозами: от ревматоидных узелков до поражения легких, сердечно-сосудистой системы и системного васкулита. Достаточно часто развитие системных ВП сопровождается инвалидностью, психическими расстройствами, что приводит к снижению качества жизни, сокращению ее продолжительности и представляет собой серьезное экономическое и социальное бремя как для отдельных людей, так и для общества в целом[1, 2, 4].
Наиболее частыми ВП являются сердечно-сосудистые заболевания, заболевания легких (у 30–50% больных) и кожные проявления (у 20–35% пациентов)[2]. При сердечно-сосудистых и легочных болезнях имеет место высокий риск преждевременного летального исхода. Основная причина смерти больных РА — сердечно-сосудистые заболевания, у таких пациентов риск смерти от сердечно-сосудистых заболеваний на 50% выше, чем в общей популяции[2, 5].
Более того, ВП иногда возникают и как первое проявление РА. Ряд широко распространенных и серьезных сопутствующих заболеваний, вызванных РА, таких как атеросклероз, дисфункция миокарда, интерстициальное заболевание легких и саркопения, могут клинически проявляться за годы до возникновения боли в суставах или синовита[1, 2, 4].
Появление в последние годы новых стратегий в лечении РА позволило контролировать активность заболевания с последующим уменьшением риска тяжелых ВП. Тем не менее, несмотря на снижение частоты тяжелых ВП и риска преждевременной смерти у больных РА, в диагностике и терапии заболевания все еще остаются проблемы, обусловленные прежде всего теоретическими пробелами в знаниях об этиологии и патогенезе РА[2].
Считается, что взаимодействия между различными факторами провоцируют нарушения иммунитета и вызывают воспалительный процесс, приводящий к повреждению синовиальных структур. Важную роль в этом процессе играет окислительный стресс (ОС) — состояние, при котором пул активных форм кислорода (АФК) и активных форм азота (АФА) увеличивается с течением времени либо за счет усиления их производства, либо за счет снижения антиоксидантной защиты, либо за счет комбинации этих факторов[6, 7].
В физиологических условиях АФК и АФА необходимы для поддержания окислительно-восстановительного баланса клетки и играют значительную роль в защитных механизмах против различных патогенов. В случае если их концентрации превышают физиологические уровни, они способны повреждать различные клеточные структуры, способствуя возникновению ОС и развитию воспаления[7]. Тот факт, что ОС имеет решающее значение в запуске и поддержании процессов, наблюдаемых при системных воспалительных состояниях, включая РА, не вызывает сомнений. Точные же механизмы, посредством которых ОС может способствовать возникновению и сохранению местного (в суставах) и системного воспаления при РА, особенно на ранних стадиях, еще предстоит определить[7]. Однако уже известно, что взаимодействие между клетками иммунной системы и эндогенными и/или экзогенными антигенами запускает в организме продукцию АФК и АФА.
Важная роль в этом процессе отводится Т- и В-лимфоцитам[8]. Основным источником супероксидных радикалов в Т-лимфоцитах признается никотинамидадениндинуклеотидфосфатоксидаза (НАДФ-оксидаза). Но авторы допускают возможность продукции АФК многими другими ферментами: цитохромами P450 и b5, липоксигеназой, циклооксигеназой, α-кетоглутарат- и глицеролфосфатдегидрогеназой, оксидоредуктазой (дегидрогеназой, оксидазой, монооксигеназой, диоксигеназой, пероксидазой)[9].
Одним из источников АФК и АФА является ксантиноксидоредуктаза (КОР; ЕС 1.17.3.2), образованная двумя компонентами: ксантиндегидрогеназой (КДГ; ЕС 1.17.1.4) и ксантиноксидазой (КО; ЕС 1.17.3.2). Обе формы КОР представляют собой важный компонент врожденной иммунной системы и вносят определенный вклад в генерацию свободных радикалов при различных заболеваниях[10–12]. В то же время роль энзима в патогенезе РА остается невыясненной. С учетом сопряженности иммунных и оксидантных механизмов в патогенезе РА определенный интерес представляет изучение активности КОР в лимфоцитах — специфических иммунных клетках, являющихся ключевыми участниками врожденного и адаптивного иммунного ответа.
Цель исследования: изучить в лизатах лимфоцитов зависимость активности ферментов комплекса КОР (КО и КДГ) от наличия ВП у больных РА.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проводилось на базе ФГБНУ «НИИ КиЭР им. А.Б. Зборовского». Протокол исследования одобрен локальным этическим комитетом. Письменное информированное согласие получено от всех участников.
В исследование вошли 112 человек, из них 77 (больные РА) составили основную группу (20 мужчин (26%) и 57 женщин (74%), средний возраст — 45 [37; 49] лет); 35 (16 (45,7%) мужчин и 19 (54,3%) женщин, средний возраст — 39 [34; 46] лет) практически здоровых доноров станции переливания крови — контрольную группу. Группы были сопоставимы по полу (р = 0,064, критерий χ2 с поправкой Йейтса) и возрасту.
Все больные проходили лечение на базе ревматологического отделения ГУЗ «Городская клиническая больница скорой медицинской помощи № 25» г. Волгограда. Верификация диагноза осуществлялась на основе ACR/EULAR критериев 2010 года, уровень активности оценивался по шкале Disease Activity Score (DAS28).
Критерии включения в основную группу: верифицированный диагноз РА, возраст старше 18 лет и подписанное информированное согласие. Критерии исключения: возраст младше 18 лет, наличие воспалительных заболеваний иного генеза, онкологических заболеваний, беременность, отказ от участия в исследовании.
Объект исследования — лимфоциты венозной крови здоровых людей и больных РА, выделенные методом А. Böyum в лимфосепе (JCN Biomedicals) с градиентом плотности 1,077–1,079 г/мл[13]. Забор крови у пациентов производили на момент поступления в ревматологическое отделение. Для определения жизнеспособности лимфоцитов суспензию клеток окрашивали 0,2%-ным раствором трипанового синего, живые клетки подсчитывали микроскопическим методом в камере Горяева. Окрашенные клетки признавались нежизнеспособными и исключались из подсчета. Далее лимфоциты лизировали в 1%-ном растворе тритона Х-100 с последующим трехкратным замораживанием-оттаиванием.
Активность КО в лизатах лимфоцитов оценивали при помощи метода H.M. Kalckar в кинетическом варианте, разработанном Е.Г. Дягиной[14], концентрацию ксантина (субстрата КО) при этом измеряли спектрофотометрически при 293 нм.
Активность КДГ в лизатах лимфоцитов определяли кинетическим методом по Z.J. Devenyi и соавт.[15] с использованием ксантина и никотинамидадениндинуклеотида, регистрируя образующийся восстановленный никотинамидадениндинуклеотид спектрофотометрически при 340 нм.
Для обеспечения аналитической специфичности значения активностей КО и КДГ вычислены разности активностей основной пробы и контрольной пробы без ксантина. Активность энзимов в лизатах лимфоцитов выражали в нмоль/мин/мл в пересчете на 107 клеток в 1 мл.
Статистическую обработку результатов проводили с помощью программного пакета Statistica 6.0. Для сравнения групп использовали критерий Манна — Уитни. Для анализа статистических связей признаков выполняли корреляционный анализ по Спирмену. Полученные в результате статистического анализа данные представляли в виде Мe [Q25; Q75], где Мe — медиана, Q25 и Q75 — 25-й и 75-й процентили. Статистически значимыми различия считались при р < 0,05.
РЕЗУЛЬТАТЫ
Анализ распределения пациентов по гендерному признаку демонстрирует преобладание женщин среди пациентов с РА. Основной контингент (74%) составили больные в возрасте от 30 до 50 лет. Данный факт согласуется с результатами клинико-демографических исследований больных РА в различных популяциях[1].
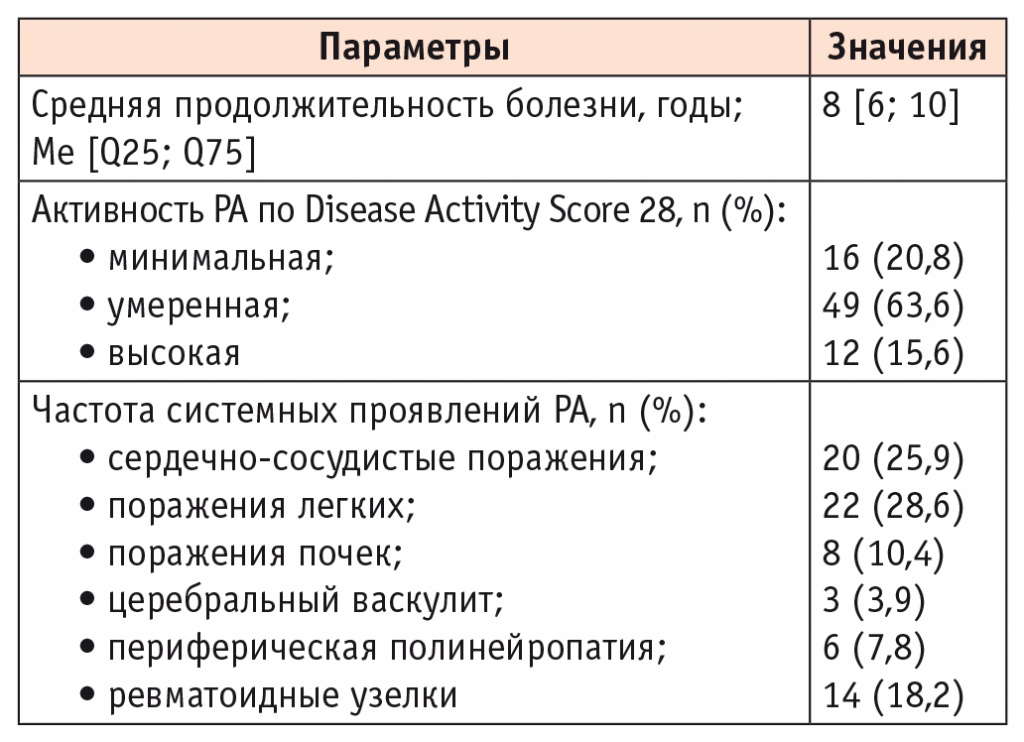
Клиническая характеристика включенных в исследование пациентов с РА отражена в таблице 1. Больше всего оказалось пациентов со 2-й степенью активности (63,6%). В результате комплексного клинико-лабораторного и инструментального обследования у 26 (33,8%) больных РА нами выявлены ВП (см. табл. 1). Преимущественно диагностировалось одновременное поражение нескольких систем органов. Сходные данные получены и в зарубежных исследованиях[1–5].
Таблица 1
Клиническая характеристика больных ревматоидным артритом (РА) (n = 77)
Референтный диапазон (95-процентильный интервал) для КО составил 14,11–31,33 нмоль/мин/мл, для КДГ — 18,62–39,64 нмоль/мин/мл. Пол и возраст при изучении энзимной активности в группе больных РА не учитывались, т. к. в контрольной (референтной) группе не была установлена зависимость активности ферментов КОР от этих параметров.
По сравнению с показателями референтной группы у больных РА в целом, а также в подгруппах с ВП и без них в лимфоцитах обнаружено существенное снижение активности обоих ферментов (табл. 2). В группе больных РА с ВП активность КО и КДГ снижена в большей степени, чем у пациентов с РА без ВП.
Таблица 2
Активность энзимов в лимфоцитах больных ревматоидным артритом (РА) в зависимости от наличия внесуставных проявлений (ВП), нмоль/мин/мл; Me [Q25; Q75]
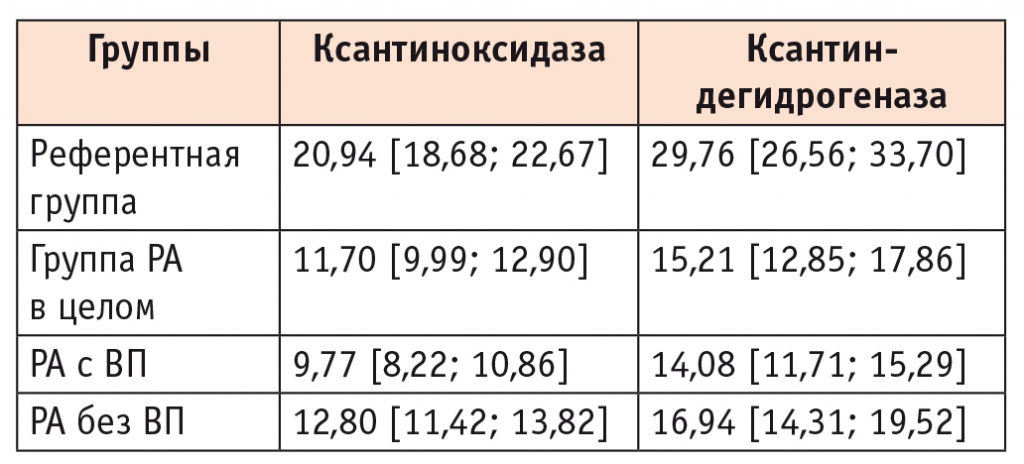
Примечание. И для ксантиноксидазы, и для ксантиндегидрогеназы все значения статистически значимо различались (р < 0,001, критерий Манна — Уитни): при сравнении референтной группы с больными РА в целом и с подгруппами РА с ВП и без ВП, а также при сравнении подгрупп РА с ВП и без ВП друг с другом.
По результатам корреляционного анализа Спирмена выявлена зависимость активности КО и КДГ от наличия ВП: прямые корреляции умеренной силы для КО (ρ = 0,6; p < 0,001), для КДГ (ρ = 0,499; p = 0,000041). Между активностью КО и КДГ обнаружена сильная прямая корреляционная связь, интенсивность которой была выше при появлении в клинической картине РА ВП: ρ = 0,72; p = 0,025 и ρ = 0,87, p = 0,004 для РА только с поражением суставов и для РА с ВП соответственно.
ОБСУЖДЕНИЕ
Согласно многочисленным литературным данным, в патогенез РА вовлечен ОС. Свободные радикалы инициируют и способствуют прогрессированию суставных и сердечно-сосудистых повреждений, поддерживая окислительно-восстановительные модификации белка и продукцию цитокинов, которые дополнительно увеличивают образование прооксидантных агентов и тем самым замыкают порочный круг[1, 6, 7]. Полученные нами данные свидетельствуют о значительном изменении активности энзимов прооксидантного комплекса КОР в периферических лимфоцитах крови у больных РА, зависящем от наличия внесуставных (системных) проявлений. Эти изменения имеют однонаправленный характер и проявляются снижением активности КО и КДГ.
По-видимому, эти данные указывают на то, что в лимфоцитах больных РА реализация свободно-радикальных процессов и генерация АФК и АФА происходит не за счет активации ферментного комплекса КОР, а в результате иных механизмов, сопровождающихся образованием свободных радикалов и ОС или непосредственно в лимфоцитах, или за счет АФК и АФА, продуцируемых другими иммунными клетками, находящимися рядом с лимфоцитами в очаге воспаления, например фагоцитами, нейтрофилами[7, 9].
Кроме того, в ранее опубликованных исследованиях нами продемонстрировано увеличение активности КО в плазме при обеих формах заболевания с более существенным повышением активности фермента при наличии у больных ВП. Активность КДГ в плазме была также повышена в присутствии системных поражений[16].
Снижение активности прооксидантных энзимов в лимфоцитах периферической крови на фоне повышения их активности в плазме, по-видимому, является следствием увеличения проницаемости мембран лимфоцитов. Более того, снижение активности КО и КДГ можно объяснить присутствием в клетках специализированных антиоксидантных систем (супероксиддисмутазы, каталазы, глутатионпероксидазы, пероксиредоксинов и др.), контролирующих производство АФК. Однако для получения более полной картины состояния окислительного-восстановительного баланса необходимо изучение компонентов антиоксидантной защиты, что станет предметом наших дальнейших исследований.
Вместе с тем не стоит забывать и о том, что КО и КДГ являются частью пуринового метаболизма, представляющего собой сопряженную мультиферментную систему, в которой метаболиты первой реакции служат субстратом для последующей, и активность энзимов пуринового каскада зависит от активности соседних ферментов цикла, от содержания продуктов, образующихся в ходе катализируемых ими реакций, и от присутствия активаторов/ингибиторов энзимных реакций. Поскольку активность аденозиндезаминазы, катализирующей образование гипоксантина/ксантина, являющихся субстратом для КОР, снижена в лимфоцитах больных РА[17], логично ожидать уменьшения активности изучаемых нами ферментов, что мы и наблюдаем.
Вероятно, на фоне сниженной активности АДА в лимфоцитах имеется повышенное содержание аденозина со всеми вытекающими из этого негативными последствиями для функций лимфоцитов, проявляющимися дискоординацией иммунных процессов, гиперпродукцией антител В-клетками на фоне снижения числа супрессорных Т-клеток, а сопутствующее повышение активности АМФ-дезаминазы и снижение активности 5´-нуклеотидазы являются адаптационными, компенсаторными реакциями, направленными на уменьшение содержания внутриклеточного аденозина.
ЗАКЛЮЧЕНИЕ
В патогенезе ревматоидного артрита (РА) принимает участие окислительный стресс (ОС), проявления которого наблюдаются в различных биологических средах организма[16, 18]. При этом лимфоциты не являются исключением, о чем свидетельствуют ранее опубликованные данные[7, 8]. Однако в силу снижения активности ксантиноксидазы (КО) и ксантиндегидрогеназы (КДГ) вклад ферментного комплекса ксантиноксидоредуктазы (КОР) в реализацию ОС в лимфоцитах не может рассматриваться как значимый. Активация свободно-радикальных процессов в лимфоцитах, вероятно, происходит в результате образования активных форм кислорода и активных форм азота посредством иных механизмов. В лимфоцитах же на первый план выступают изменения в адениловом звене пуринового метаболизма, способные вызвать нарушение функциональных свойств лимфоцитов и дискоординацию иммунных процессов.
Усугубление иммунных нарушений при генерализации ревматоидного процесса с развитием внесуставных проявлений (ВП) характеризуется существенными изменениями пуринового метаболизма. Эти изменения сопровождаются снижением в лимфоцитах субстрата для КОР, что объясняет наиболее низкие показатели активности фермента именно в данной группе пациентов.
Поскольку в лимфоцитах больных РА наблюдаются изменения энзимного профиля КОР, интенсивность которых зависит от наличия или отсутствия ВП в клинической картине заболевания, возможно, ориентируясь на показатели активности ферментов, прогнозировать наличие/присоединение ВП. При уровне активности КО ниже 10,86 нмоль/мин/мл и/или активности КДГ ниже 14,31 нмоль/мин/мл у больных РА предположительно присутствуют ВП. В этом случае рекомендуется углубленное обследование пациента для более раннего их выявления с целью коррекции проводимой терапии.
Поступила: 16.09.2021
Принята к публикации: 21.11.2021







