ВВЕДЕНИЕ
В списке актуальных проблем, стоящих перед здравоохранением, одни из лидирующих позиций занимают ожирение и недостаточная обеспеченность витамином D, достигшие эпидемических масштабов[1]. В настоящее время недостаток витамина D рассматривается не только в числе причин нарушения фосфорно-кальциевого обмена и развития остеопороза, но и в аспекте комплексного негативного воздействия на метаболизм — как проблема, ассоциированная с развитием ожирения, сахарного диабета, нарушением репродуктивной функции[2, 3]. Экспериментальные данные свидетельствуют об однозначно негативном влиянии ожирения на метаболизм кости. Известно, что это влияние осуществляется несколькими путями, в частности посредством клеточных факторов[4–10].
Широкий спектр воздействий витамина D на здоровье человека вызывает значительный интерес ученых и врачей. Работы в этой области тем более актуальны, что распространенность D-дефицитного статуса остается очень высокой.
Целью исследования стала оценка взаимосвязи уровня витамина D с показателями костной ультрасонометрии и маркерами костного метаболизма у детей с ожирением.
МАТЕРИАЛЫ И МЕТОДЫ
Проспективное контролируемое исследование проведено на клинической базе Детской клинической больницы г. Смоленска и Смоленской областной детской клинической больницы с согласия родителей детей и самих обследуемых. Протоколы исследования и информированные согласия рассмотрены и одобрены на заседании этического комитета Смоленского государственного медицинского университета.
В основную группу (n = 31) вошли дети и подростки с первичным экзогенно-конституциональным ожирением, постоянно проживавшие в Смоленске и Смоленской области и соответствовавшие критериям включения:
-
возраст от 4 до 15 лет;
-
ожирение согласно критериям ВОЗ и клиническим рекомендациям РФ (ИМТ ≥ +2,0 SDS ИМТ для данного пола и возраста);
-
отсутствие признаков острого заболевания или обострения хронического заболевания на момент включения в исследование;
-
неприменение препаратов витамина D на протяжении не менее чем одного месяца до включения в исследование;
-
письменное информированное согласие родителей либо законных представителей ребенка на участие в исследовании.
Критерии исключения из основной группы:
-
ожирение вследствие других эндокринных заболеваний (гипотиреоз, гиперкортицизм, гипопитуитаризм и др.);
-
ожирение вследствие травм гипоталамо-гипофизарной области;
-
ожирение как проявление генетических синдромов (синдромы Кохена, Дауна, Прадера — Вилли, Лоуренса — Муна — Барде — Бидля и др.);
-
наличие хронических заболеваний пищеварительного тракта, печени и почек.
В основной группе были выделены 3 подгруппы в зависимости от значений SDS ИМТ:
-
SDS ИМТ от +2,0 до +2,5 — ожирение I степени (1-я подгруппа, n = 9);
-
SDS ИМТ от +2,6 до +3,0 — ожирение II степени (2-я подгруппа, n = 9);
-
SDS ИМТ от +3,1 до +3,9 — ожирение III степени (3-я подгруппа, n = 4).
При SDS ИМТ +4,0 и более констатировали морбидное ожирение.
Группу контроля (n = 40) составили дети и подростки без ожирения (ИМТ < +1,0 SDS ИМТ для данного пола и возраста). Основная и контрольная группы были сопоставимы по возрасту (средний возраст — 9,6 и 9,4 года соответственно) и полу: 74,2% (n = 23) и 52,5% (n = 21) обследованных мужского пола соответственно.
Антропометрическое обследование. Измерение роста проводили с использованием медицинского ростомера Р-Ст-МСК (МСК-234) (Россия) с точностью до 0,1 см. Масса тела измерялась на медицинских напольных весах ВЭМ-150-А1 (Россия) с точностью до 0,1 кг. Показатель ИМТ рассчитывали по формуле:
вес (кг) / рост2 (м).
ИМТ оценивали по стандартам ВОЗ и клиническим рекомендациям РФ с расчетом SDS.
Инструментальное обследование. Состояние костной ткани изучали методом ультразвуковой остеоденситометрии с помощью ультразвукового денситометра Omnisense omni (Sunlight Medical Ltd, Израиль), оснащенного специализированной программой и датчиком. Метод является скринингом для выявления начальных проявлений остеопенического синдрома, позволяя оценивать состояние костной ткани по скорости прохождения ультразвуковой волны через кость (англ. speed of sound, SOS) и величине ее затухания в кости (англ. broadband ultrasound attenuation). Названные показатели отражают эластичность, жесткость и прочность кости.
Количественное УЗИ, основанное на аксиальной трансмиссии ультразвуковой волны вдоль кортикального слоя трубчатых костей, позволяет охарактеризовать состояние костной ткани по скорости прохождения ультразвуковой волны. При этом оценивается скорость прохождения вдоль кортикального слоя большеберцовых костей в абсолютных значениях (SOS, м/сек) или в виде интегрального показателя (SOS, Z-score). Z-score учитывает отклонение фактических значений костной плотности от среднестатистической нормы для конкретной возрастной группы и выражается в единицах стандартного отклонения (англ. standard deviation, SD). Умеренное снижение костной плотности диагностируют при скорости ультразвука ниже 10-го перцентиля (Z-score < –1 SD), выраженное снижение костной плотности — при скорости ультразвука ниже 5-го перцентиля (Z-score < –2 SD). Z-score от –1 до 0 SD расценивается как тенденция к снижению костной плотности.
Лабораторное обследование. Оценку статуса витамина D путем определения концентрации общего 25(ОН)D в сыворотке крови и оценку биохимических параметров костного метаболизма выполняли на базе Научно-исследовательского центра Смоленского государственного медицинского университета. Забор крови у детей обеих групп проводили натощак в утренние часы в период с конца сентября по ноябрь. Уровень 25(ОН)D3 определяли хемилюминесцентным методом с применением анализатора Liaison 25 OH Vitamin D Total Assay (Германия). Интерпретация результатов осуществлялась в соответствии с Национальной программой «Недостаточность витамина D у детей и подростков Российской Федерации: современные подходы к коррекции»1: дефицит витамина D — 25(ОН)D3 до 20 нг/мл включительно (≤ 50 нмоль/л); недостаточность витамина D — 25(ОН)D3 от 21 до 29 нг/мл (51–75 нмоль/л); нормальное содержание витамина D — 25(ОН)D3 от 30 до 100 нг/мл (76–250 нмоль/л).
Концентрации общего и ионизированного кальция, щелочной фосфатазы (ЩФ), фосфора определяли на биохимическом анализаторе Clima MC-15 (RAL, Испания) с использованием стандартных наборов («Ольвекс Диагностикум», Россия). Результаты оценивались по нормативам, прилагаемым к тест-наборам. Уровни остеокальцина и C-концевых телопептидов коллагена I типа — β-CrossLaps (фрагмент белка, который образуется при расшеплении коллагена, входящего в состав внеклеточного матрикса костной ткани) устанавливали на тест-системе «Остеокальцин и CrossLaps TM» фирмы Nordic Bioscience Diagnostics A/S (Дания).
Статистическая обработка. Полученные данные обрабатывали с использованием программного пакета Microsoft Office 2016. Для описания количественных данных рассчитывали среднее арифметическое (М), выборочное стандартное отклонение (σ), ошибку среднего арифметического (m), медиану (Me), а для интервальной оценки — верхний и нижний квартили [Q1; Q3], так как исследовавшиеся выборки не были подчинены закону нормального распределения. Качественные признаки анализировали с помощью таблиц сопряженности с применением критерия хи-квадрат (χ2) Пирсона либо двустороннего критерия Фишера. При сравнении переменных в независимых выборках применяли U-критерий Манна — Уитни, для зависимых выборок использовали критерий Вилкоксона. Связь количественных переменных оценивали с помощью коэффициента ранговой корреляции Спирмена (rs). Для оценки уровня корреляции использовалась шкала Чеддока. Различия считали статистически значимыми при р < α, где α – ошибка первого рода (α = 0,05).
РЕЗУЛЬТАТЫ
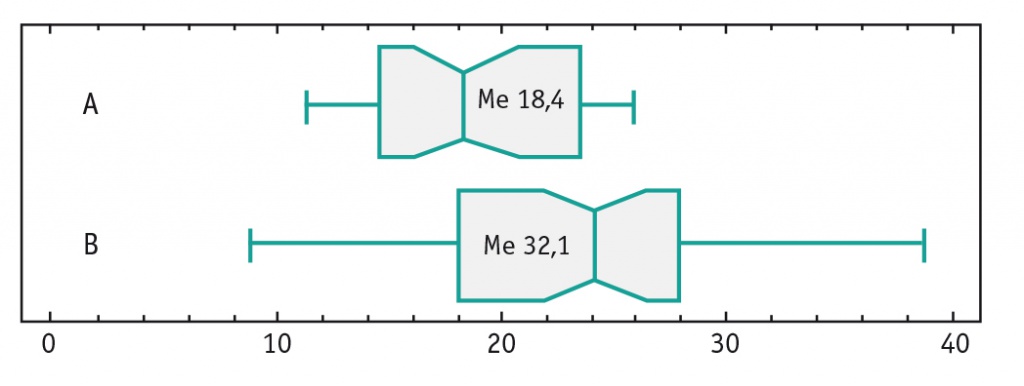
В сопоставимых по возрасту и полу группах детей с ожирением и нормальной массой тела были получены результаты, свидетельствовавшие о более низкой обеспеченности витамином D у детей с ожирением. Медианы уровня витамина D составили 18,4 и 32,1 нг/мл соответственно, различия статистически значимы (р < 0,05) (рис. 1).
Рис. 1. Уровни витамина D у детей с ожирением (А) и нормальной массой тела (B), нг/мл
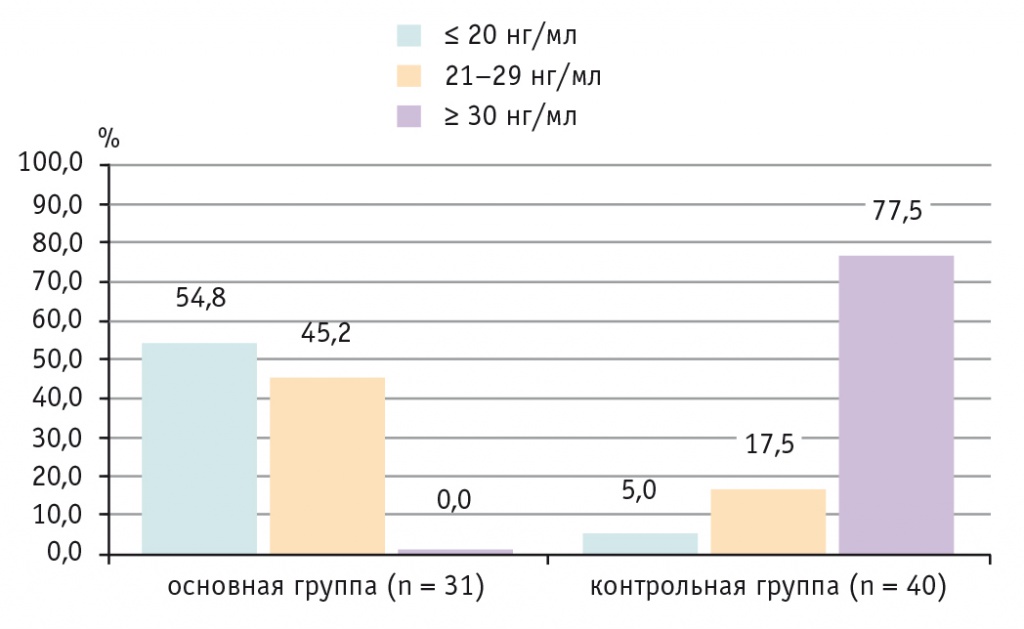
Низкая обеспеченность 25(ОН)D3 у детей с ожирением отмечалась в 100% случаев, в то время как у большинства (77,5%) детей с нормальной массой тела содержание кальцидиола соответствовало норме (рис. 2).
Рис. 2. Обеспеченность 25(ОН)D3 у детей с ожирением и нормальной массой тела, %
Сравнение обеспеченности витамином D в зависимости от тяжести ожирения и половой принадлежности статистически значимых различий не выявило (в обоих случаях р > 0,05).
Изучение влияния уровня 25(OH)D на показатели костной ультрасонометрии показало умеренную прямую корреляцию: чем ниже уровень 25(OH)D в сыворотке крови, тем ниже показатели костной ультрасонометрии (rs = 0,398; р = 0,029) (табл.).
Таблица
Показатели костной ультрасонометрии в зависимости от уровня сывороточного 25(OH)D у детей с ожирением (n = 31)
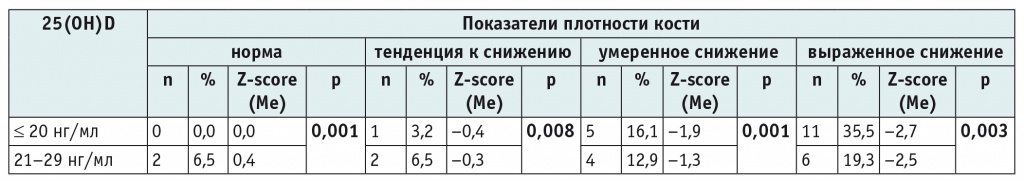
Примечание. Сравнительный анализ количественных значений выполнен с использованием критерия Манна — Уитни.
Содержание общего кальция в сыворотке крови у детей с ожирением составило 2,4 ± 0,9 ммоль/л, что соответствует референтным значениям. Статистически значимых различий по этому показателю между детьми основной (2,4 [2,2; 2,7] ммоль/л) и контрольной (2,4 [2,3; 2,5] ммоль/л) групп не выявлено (р = 0,51; р > α).
Уровень ионизированного кальция в сыворотке крови у большинства (52,6%) детей с ожирением составил 1,1 ± 0,3 ммоль/л, что также соответствует референтным значениям. В основной группе он был статистически значимо ниже, чем в группе контроля: 1,17 [1,04; 1,28] и 1,22 [1,18; 1,40] ммоль/л соответственно (р = 0,03; р < α).
Содержание фосфора в сыворотке крови в основной группе (1,7 ± 0,7 ммоль/л) находилось в пределах референтных значений. При сравнении этого показателя у детей с ожирением (1,6 [1,2; 1,9] ммоль/л) и без ожирения (1,6 [1,5; 1,7] ммоль/л) статистически значимых различий не выявлено (р = 0,55; р > α).
Концентрация ЩФ в сыворотке крови у детей с ожирением в большинстве (64,5%) случаев превышала референтные значения и в среднем составила 549 ± 106 ед/л. Активность ЩФ в основной группе была статистически значимо выше, чем в группе контроля: 457 [277; 581] и 262 [232; 453] ед/л соответственно (р = 0,012; р < α).
Установлено, что у детей с ожирением уровень остеокальцина статистически значимо ниже, чем у метаболически здоровых детей: 19,8 [14,5; 23,6] и 84,0 [68,9; 102,9] нг/мл соответственно (р < 0,001; р < α).
При оценке костного метаболизма выявлено также, что уровень β-CrossLaps в сыворотке крови у детей с ожирением статистически значимо выше, чем у метаболически здоровых детей: 2,0 [0,9; 4,2] и 0,5 [0,3; 0,5] нг/мл соответственно (р = 1,65739 × 10–8; р < α).
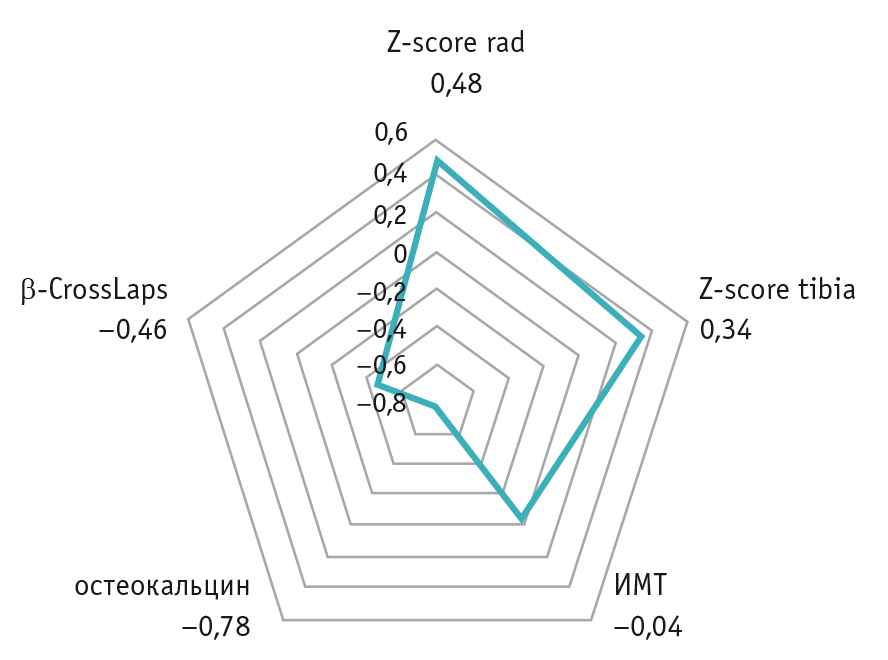
В ходе корреляционного анализа получены статистически значимые прямые связи уровня сывороточного витамина D с показателями костной плотности и обратные связи — с показателями остеокальцина и β-CrossLaps (рис. 3).
Рис. 3. Корреляционный анализ параметров костного метаболизма, скорости ультразвуковой волны и обеспеченности 25(OH)D у детей с ожирением
ОБСУЖДЕНИЕ
По результатам настоящего исследования, дети, страдающие ожирением, в 100% случаев имели низкую обеспеченность витамином D. По данным широкомасштабного многоцентрового исследования И.Н. Захаровой и соавт. (2013–2017), проблема низкой обеспеченности витамином D в детской популяции имеет глобальный характер: нормальные показатели выявляются лишь у 34% детей, 24% относятся к группе с недостаточностью витамина D, а у 42% наблюдается его дефицит2.
Известно, что ожирение может способствовать сокращению образования витамина D, его депонированию и ускоренному разрушению в жировых клетках, приводить к развитию состояний его недостаточности и дефицита[11, 12]. Ожирение сопровождается снижением биодоступности витамина D, причем по мере увеличения ИМТ у пациентов наблюдается уменьшение сывороточной концентрации 25(ОН)D[13]. Витамин D играет важную роль в регуляции костного моделирования, обмена липидов, его недостаточный уровень может являться предиктором метаболических и кардиоваскулярных расстройств, снижения прочности костной ткани[14].
С одной стороны, ожирение можно рассматривать как причинный фактор низкого уровня витамина D вследствие изменения характера питания, малоподвижного образа жизни, приводящего к уменьшению пребывания на солнце и снижению синтеза колекальциферола в коже под действием ультрафиолетовых лучей, а также образования неактивных форм витамина, увеличения депонирования и разрушения витамина D в клетках жировой ткани. С другой стороны, при дефиците витамина D активируется процесс липогенеза через подавление экспрессии гена синтетазы свободных жирных кислот и тормозится процесс липолиза за счет блокирования дифференцировки адипоцитов[11, 15].
Оценка показателей фосфорно-кальциевого метаболизма в сыворотке крови выявила средние значения кальция общего и ионизированного, фосфора, ЩФ в сыворотке крови у детей исследуемых групп. Согласно литературным данным, у лиц до 18 лет в сыворотке крови при анализе превалирует активность именно костной фракции ЩФ: она составляет 80–85%, тогда как вклад печеночной и других изоформ минимален[16]. Предполагается, что изменения фосфорно-кальциевого обмена в биохимическом анализе крови можно увидеть при более выраженных трансформациях архитектоники костной ткани, исчерпании компенсаторных возможностей организма.
Остеокальцин — неколлагеновый белок костного матрикса, связывающий кальций и гидроксиапатиты. Он синтезируется остеобластами во внеклеточное пространство кости, часть попадает в кровоток, где остеокальцин и может быть проанализирован. Концентрация остеокальцина в крови отражает метаболическую активность остеобластов костной ткани и является маркером костеобразования. При резорбции костной ткани под воздействием остеокластов остеокальцин высвобождается из костного матрикса и попадает в кровь в виде неиммунных фрагментов[17]. При разрушении костной ткани остеокластами в крови также повышается уровень β-CrossLaps[18, 19]. Повышение уровней маркеров костной резорбции при ожирении связано с гормоном лептином, усиливающим остеокластогенез путем активации экспрессии RANKL (англ. receptor activator of nuclear factor kappa B ligand — лиганд рецептора активатора фактора нуклеации каппа B)[20].
ЩФ играет важную роль в формировании и обновлении костной ткани. Активность общей ЩФ в крови при нормальной функции печени и почек может в определенной степени свидетельствовать о функции остеобластов, поскольку около 80% активности этого фермента у детей приходится на костную фракцию[21].
Более низкие показатели остеокальцина и повышение активности β-CrossLaps и ЩФ расценены нами как свидетельство снижения процесса костеобразования и увеличения костной резорбции. Преобладание процессов резорбции приводит к снижению плотности костной ткани.
Следует также обратить внимание на то, что показатели кальций-фосфорного обмена находились в пределах референтных значений. Данный феномен можно объяснить тем, что показатели кальций-фосфорного обмена наиболее стабильны и выраженные сдвиги проявляются при значительных нарушениях процесса костного ремоделирования.
ЗАКЛЮЧЕНИЕ
По данным проведенного исследования, у детей с ожирением уровень витамина D и показатели плотности костной ткани ниже, чем у детей с нормальной массой тела. У всех детей с ожирением выявлены недостаточность или дефицит витамина D. Последний ассоциировался с более низкими показателями костной плотности, снижением маркеров костеобразования и повышением маркеров костной резорбции.
Результаты исследования позволяют утверждать, что ожирение в детском возрасте — фактор риска развития дефицита витамина D, который, в свою очередь, является фактором риска остеопороза. Это подчеркивает необходимость профилактики гиповитаминоза D у детей с ожирением.
Поступила: 07.09.2021
Принята к публикации: 12.11.2021
________
1 Союз педиатров России; Российский союз нутрициологов, диетологов и специалистов пищевой индустрии; Общество фармакогенетики, фармакокинетики и персонализированной терапии. Национальная программа «Недостаточность витамина D у детей и подростков Российской Федерации: современные подходы к коррекции». М.: ПедиатрЪ; 2018. 96 с.
2 Союз педиатров России; Российский союз нутрициологов, диетологов и специалистов пищевой индустрии; Общество фармакогенетики, фармакокинетики и персонализированной терапии. Национальная программа «Недостаточность витамина D у детей и подростков Российской Федерации: современные подходы к коррекции». М.: ПедиатрЪ; 2018. 96 с.







