Последний из недавно открытых коронавирусов — SARS-CoV-2 вызывает заболевание COVID-19 — такое название для данного нового заболевания объявила 11 февраля 2020 г. Всемирная организация здравоохранения. До вспышки инфекции в китайской провинции Ухань в декабре 2019 г. о новом вирусе и заболевании ничего не было известно[1]. Коронавирусы человека в первую очередь поражают дыхательные пути, вызывая лихорадку, кашель, а в тяжелых случаях — одышку и системное воспаление, что может привести к сепсису, сердечной недостаточности и полиорганной дисфункции. Вирус, вызывающий COVID-19, более заразен, чем ранее идентифицированные бета-коронавирусы человека (тяжелый острый респираторный синдром CoV/SARS-CoV и ближневосточный респираторный синдром CoV/MERS-CoV)[2]. С начала пандемии ученые всего мира работают над изучением факторов, влияющих на течение COVID-19 у разных категорий пациентов. Как один из таких факторов, вероятно, можно рассмотреть гиперпролактинемию.
Пролактин (ПРЛ) образуется в лактотрофах аденогипофиза. Это единственный гормон, не активируемый гипоталамическим рилизинг-фактором, но находящийся под контролем дофаминергических нейронов гипоталамуса[3–6]. Метаболические действия ПРЛ затрагивают практически все ткани организма[7–9]. ПРЛ принимает участие в регуляции нейроэндокринного, кроветворного и иммунного гомеостаза и вырабатывается не только передней долей гипофиза, но и различными внегипофизарными участками. Внегипофизарный ПРЛ имеет в основном аутокринные и паракринные эффекты из-за другой биологической активности и молекулярной массы, в отличие от гипофизарного ПРЛ[10, 11]. Поскольку ПРЛ также синтезируется и секретируется лимфоцитами, он считается цитокином и передает сигналы по тем же путям, что и иммунные цитокины[12–14]. Учитывая имеющиеся данные об участии ПРЛ в иммунном ответе, актуально изучение ассоциаций гиперпролактинемии с течением COVID-19.
РЕГУЛЯЦИЯ ПРОЛАКТИНА
ПРЛ действует через специфические рецепторы ПРЛ, принадлежащие к суперсемейству цитокиновых рецепторов, которые также являются рецепторами лептина, эритропоэтина, колониестимулирующего фактора и интерлейкина-6 (ИЛ-6)[15, 16]. Рецепторы ПРЛ также могут служить функциональными рецепторами гормона роста и плацентарного лактогена. Кроме того, ПРЛ может работать как цитокин посредством активации цитокиновых рецепторов в регуляции иммунной системы[17] (рис. 1). Рецепторы ПРЛ широко экспрессируются в различных эндокринных тканях и тканях-мишенях, а также в иммунных клетках, включая лимфоциты, моноциты, макрофаги, гранулоциты, микроглию, естественные киллеры и эпителиальные клетки тимуса для контроля иммунного ответа и реакций при аутоиммунных заболеваниях[18]. Присутствие рецепторов ПРЛ почти во всех органах свидетельствует о сложных системных эффектах ПРЛ, выходящих далеко за рамки его роли в репродукции, что делает его уникальным циркулирующим гормоном с аутокринными, паракринными и эндокринными эффектами. Существуют различные изоформы рецепторов ПРЛ, которые являются большими, промежуточными и малыми в зависимости от размера внутриклеточного домена, поскольку внеклеточные домены рецепторов ПРЛ идентичны. Кроме того, идентифицирована растворимая форма рецепторов ПРЛ, но ее точная функция не выяснена[18].
Рис. 1. Эффекты пролактина
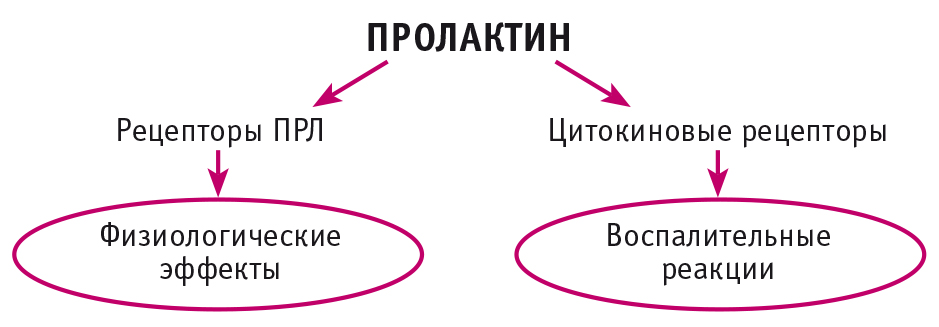
РОЛЬ ПРОЛАКТИНА В ИММУНИТЕТЕ
ПРЛ играет важную роль в адаптивном иммунитете[19] — как гуморальном (опосредованном преимущественно В-клетками и Т-хелперами), так и клеточном (опосредованном преимущественно Т-лимфоцитами) посредством эндокринных, паракринных и аутокринных механизмов[20]. В норме ПРЛ вызывает Th1 (Т-хелперный тип 1) провоспалительный ответ[21], а высокий уровень ПРЛ в крови, за исключением физиологической гиперпролактинемии во время беременности, в основном признается патологическим состоянием. Имеются данные о том, что высокий уровень ПРЛ коррелирует с тяжестью клинических проявлений таких аутоиммунных заболеваний, как системная красная волчанка, рассеянный склероз, ревматоидный артрит. Терапия агонистами дофамина, которые снижают уровень ПРЛ в крови, может уменьшать клинические проявления данных заболеваний[22–24]. ПРЛ может также оказывать иммунодепрессивное действие в относительно более высоких концентрациях и при определенных условиях[25, 26].
ПРЛ ингибируется ПРЛ-ингибирующим фактором и стимулируется ИЛ-1, ИЛ-2 и ИЛ-6 во время активной фазы хронического воспаления. ПРЛ стимулирует рецепторы ПРЛ, вызывая активацию воспалительных сигнальных путей с последующим провоспалительным или противовоспалительным эффектом. Активация рецепторов ПРЛ активирует различные сигнальные пути воспаления, включая митоген-активируемую протеинкиназу (МАП-киназу), регулируемую внеклеточным сигналом 1/2, янус-киназу-2 (JAK2), активатор транскрипции 5 (STAT5), фосфоинозитид-3-киназу и протеинкиназу B, что в свою очередь приводит к провоспалительному или противовоспалительному действию в зависимости от различных изоформ активированных рецепторов ПРЛ[27]. L.M. Williams и соавт. обнаружили, что активация ПРЛ макрофагов через STAT3 может подавлять продукцию фактора некроза опухоли-α, ИЛ-6, приводит к высвобождению противовоспалительного цитокина ИЛ-10[28]. Однако активация макрофагов через путь JAK2–STAT1 приводит к высвобождению провоспалительных цитокинов, включая фактор некроза опухоли-α, ИЛ-1β, ИЛ-12, и интерферона (ИФН)-γ. ПРЛ способствует активации Т-клеток через сигнальный путь STAT5, что приводит к экспрессии активности транскрипции T-box[29]. Молекулярные исследования показали, что ПРЛ активирует экспрессию индуцибельной синтазы оксида азота в периферических мононуклеарных клетках через сигнальный путь STAT5 и регуляторный фактор ИФН-1[30]. Другие экспериментальные исследования показали, что экспрессия внегипофизарного ПРЛ в макрофагах и моноцитах активируется адренергическими путями с последующей поляризацией макрофагов в сторону воспаления. ПРЛ повышает экспрессию ИЛ-2 на лимфоцитах и тимоцитах с созреванием CD4+- и CD8+-Т-лимфоцитов, что оказывает влияние на адаптивный и врожденный иммунный ответ[31] (рис. 2). Прямая связь между уровнем ПРЛ в сыворотке и CD4+-Т-лимфоцитов была установлена индукцией экспрессии ядерного фактора каппа B и регуляторного фактора ИФН-1. Аналогичным образом, гиперпролактинемия способствуют аутореактивности путем ингибирования клональной делеции В-клеток и порога активации альтерации, а также толерантности к В-клеткам. ПРЛ активирует дендритные клетки для презентации антигена и продукции ИФН-α. ПРЛ способствует созреванию и развитию иммунных клеток, экспрессирующих главный комплекс гистосовместимости II, CD86 и CD40[32]. Следовательно, гиперпролактинемия коррелирует с высоким уровнем аутоантител, таких как антигипофизарные и антикардиолипиновые[33]. При беременности наблюдается иммунологически толерантное состояние за счет смещения иммунного ответа с провоспалительного Th1/Th17 в сторону противоспалительного Th2[34].
Рис. 2. Иммунологическая роль пролактина (адаптировано из[32])
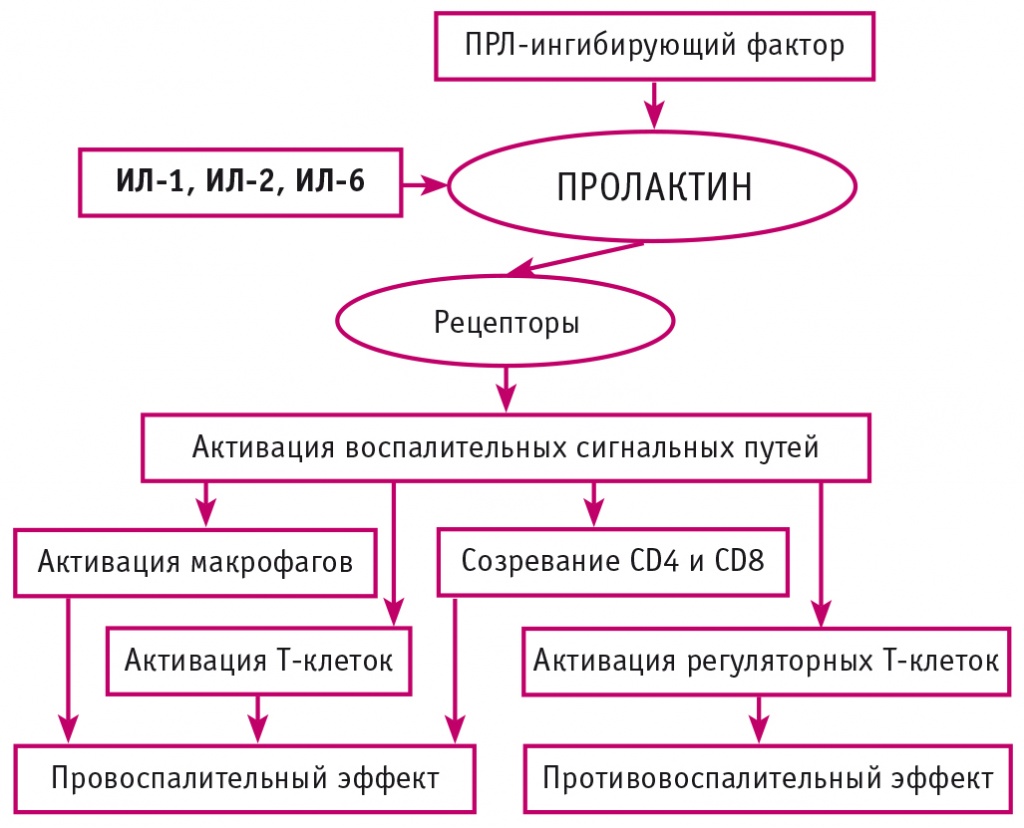
Очевидно, что контролируемое повышение уровня ПРЛ в крови (в пределах физиологических уровней, а в некоторых случаях немного выше нормы) может способствовать повышению как врожденного, так и адаптивного иммунитета.
РОЛЬ ПРОЛАКТИНА В ВОСПАЛИТЕЛЬНЫХ РЕАКЦИЯХ
ПРЛ через рецепторы ПРЛ активирует высвобождение макрофагального воспалительного белка-1α, ИФН-10, хемокинов и моноцитарного хемоаттрактантного (MХБ-1). ПРЛ стимулирует естественные клетки-киллеры к продукции ИФН-γ, ингибирует функцию регуляторных Т-клеток, изменяет функцию В-клеток и способствует аутореактивности и выработке антител с последующими воспалительными реакциями (рис. 3).
Рис. 3. Роль пролактина в воспалительных реакциях (адаптировано из[32])
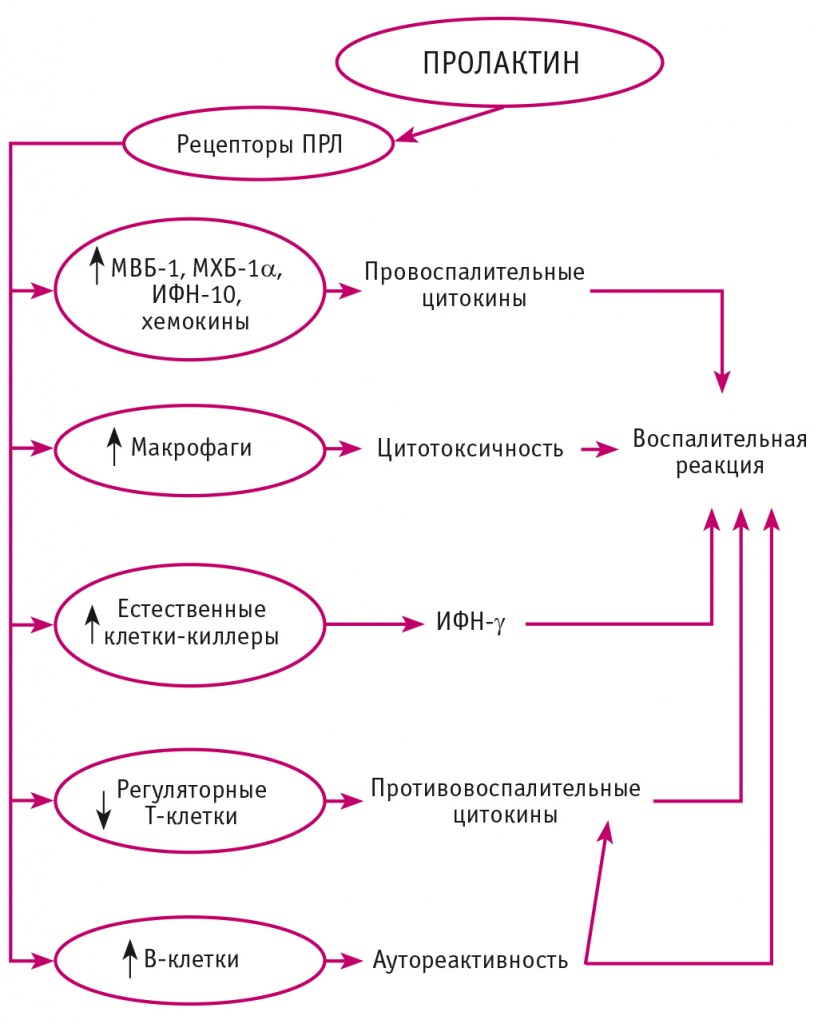
ПРЛ посредством активации Т- и В-клеток со стимуляцией моноцитарно-макрофагальной оси способствует клеточному и гуморальному иммунному ответу с индукцией воспалительных изменений. Таким образом, ПРЛ играет важную роль в воспалении, оказывая как воспалительное, так и противовоспалительное действие в зависимости от основных патофизиологических состояний, вызывая и усугубляя воспалительные заболевания[32].
СВЯЗЬ ПРОЛАКТИНА С ТЯЖЕСТЬЮ ТЕЧЕНИЯ COVID-19
SARS-CoV-2, вызывающий COVID-19, получает клеточный доступ через рецептор ангиотензинпревращающего фермента 2 (AПФ2), который связан с трансмембранным белком сериновой протеазы 2 (TMPRSS2). У людей мРНК AПФ2 экспрессируется в нескольких эндокринных железах, включая гипофиз, поджелудочную железу, щитовидную железу, яичники и яички. Важно отметить, что мРНК TMPRSS2 также экспрессируется в гипофизе, поджелудочной железе, щитовидной железе, яичниках и яичках. Таким образом, эндокринная система имеет как рецепторы AПФ2, так и белок TMPRSS2, которые необходимы для доступа вириона SARS-CoV-2 к клеткам, что делает эндокринную систему уязвимой для данной инфекции[35].
Учитывая имеющиеся данные о роли ПРЛ в иммунном гомеостазе, возникает вопрос, может ли изменение иммунного ответа путем изменения уровня ПРЛ в крови быть положительным видом вмешательства при лечении пациентов с SARS-CoV-2[32].
Ряд работ показывают половые различия в тяжести течения COVID-19. По данным J.M. Jin и соавт., мужчины из Китая (независимо от возраста) чаще имели тяжелое течение и смертельный исход заболевания, чем женщины: мужчин, умерших от COVID-19, в 2,4 раза больше, чем женщин (70,3 против 29,7%; р = 0,016)[36]. В данном анализе исключалась роль женских половых гормонов, поскольку женщины в постменопаузе демонстрировали высокую выживаемость. Авторы делают вывод о том что более высокие уровни ПРЛ у женщин могут объяснить половую разницу выживания среди лиц с COVID-19.
В городе Ухане (Китайская Народная Республика) проанализировали клинические данные и результаты компьютерно-томографического (КТ) обследования органов грудной клетки 15 беременных женщин с пневмонией, вызванной COVID-19, с января по февраль 2020 г. У 11 пациенток беременность была завершена успешными родами (10 кесаревых сечений и 1 самопроизвольные роды) в течение периода исследования, оставшиеся 4 пациентки на конец исследования находились на II и III триместрах. Случаев неонатальной асфиксии, неонатальной смерти, мертворождений или абортов не зарегистрировано. Наиболее частым признаком на КТ органов грудной клетки было затемнение по типу матового стекла. Наиболее частыми клиническими симптомами пневмонии COVID-19 у беременных были лихорадка (n = 13) и кашель (n = 9), наиболее частым лабораторным признаком — лимфоцитопения (n = 12). На КТ-снимках, полученных до и после родов, признаков утяжеления течения пневмонии после родов не выявлено. Авторы делают вывод о том, что беременность и роды не усугубляли течение пневмонии, вызванной COVID-19. Все случаи пневмонии COVID-19 у беременных в этом исследовании относились к легкой форме[37]. В заключение высказывается мнение, что более высокий уровень ПРЛ во время беременности, возможно, дал беременным женщинам преимущество в борьбе с COVID-19. Однако в других исследованиях при анализе распространенности COVID-19 сообщалось, что как беременные, так и небеременные женщины имели одинаковую восприимчивость к коронавирусной инфекции[38].
Секреция ПРЛ снижается у регулярно курящих табак людей[39]. Хроническое воздействие никотина ингибирует секрецию ПРЛ за счет активации никотиновых рецепторов дофаминовых нейронов, высвобождая дофамин как фактор-ингибитор ПРЛ. По данным Всемирной организации здравоохранения, курильщики более уязвимы к различным инфекциям. Курение может увеличить тяжесть инфекций, вызванных SARS-CoV-2, за счет изменения целостности гематоэнцефалического барьера, одновременно способствуя экспрессии АПФ2 в эндотелиальных клетках, глии и нейронах. Более того, курение повышает уровень фактора Виллебранда в кровотоке и снижает уровень тромбомодулина, что может привести к нарушению регуляции гомеостаза крови и увеличению риска тромбоза с развитием инсульта и сердечно-сосудистых заболеваний[40]. Однако, несмотря на текущие противоречия и значительные ограничения исследований, в недавнем систематическом обзоре и метаанализе результат 18 клинических и эпидемиологических исследований COVID-19 показывают, что курильщики статистически реже госпитализируются. В анализ включены данные исследований пациентов с COVID-19, проведенных в Китае, США и Италии, основанные на статусе курения. Процент госпитализированных курильщиков составил 7,7% (95% ДИ 6,9–8,4) в Китае, 2,3% (95% ДИ 1,7–2,9) в США и 7,6% (95% ДИ 4,2–11,0) в Италии. При сравнении этих данных с распространенностью табакокурения в каждой из этих стран обнаружены статистически значимые различия (р < 0,0001). У курильщиков статистически меньше вероятность госпитализации (OR = 0,18; 95% ДИ 0,14–0,23; p < 0,01). Авторы заявляют, что их наблюдения могут быть связаны с воздействием никотина [39]. J.J. Bevelacqua и соавт. предположили, что более низкое, чем ожидалось, число госпитализированных курильщиков, если оно будет подтверждено дальнейшими исследованиями, может быть связано с более высокой концентрацией депонированной энергией альфа-частиц, испускаемых радионуклидами, такими как Po-210, в сигаретном табаке. Противовоспалительные эффекты энергии излучения альфа-частиц, а также влияние низких доз радиации на снижение риска тромбоза, возможно, связаны с меньшим числом госпитализированных курильщиков, чем ожидалось. Никотин также может способствовать снижению интенсивности цитокинового шторма[40]. Таким образом, вопрос, что является благоприятным фактором меньшей вероятности госпитализации курильщиков с COVID-19 — никотин или более низкий уровень ПРЛ у курящих табак пациентов, требует дальнейшего изучения и проведения дополнительных исследований. В другом систематическом обзоре показано, что у курильщиков табака в 1,4 раза чаще проявляются тяжелые симптомы COVID-19, в 2,4 раза чаще требуется искусственная вентиляция легких по сравнению с некурящими людьми (ОР = 2,4; 95% ДИ 1,43–4,04). Авторы делают заключение о том, что курение табака связано с прогрессированием и неблагоприятными исходами у пациентов с COVID-19[41].
ГИПЕРПРОЛАКТИНЕМИЯ КАК ОДНА ИЗ ПРИЧИН ТЯЖЕЛОГО ТЕЧЕНИЯ COVID-19
Гиперпролактинемия как фактор, негативно влияющий на течение новой коронавирусной инфекции у различных групп пациентов, активно изучается. На фоне COVID-19 отмечаются заметные иммунологические и воспалительные изменения, влияющие на нейроэндокринный гомеостаз, главным образом у пожилых пациентов с сопутствующими заболеваниями. Кроме того, стрессовое состояние, вызванное COVID-19, может влиять на высвобождение ПРЛ и других гормонов, опосредованных стрессом[42, 43]. ПРЛ может оказать провоспалительный эффект, увеличивающий высвобождение провоспалительных цитокинов и развитие иммуновоспалительных нарушений. В свою очередь, высокий уровень провоспалительных цитокинов и повышенный уровень тиреотропин-рилизинг гормона, ангиотензина II и антидиуретического гормона при COVID-19 могут быть предложен как один из возможных механизмов гиперпролактинемии, вызванной COVID-19. При COVID-19 лимфопения и дисрегуляция моноцитов/макрофагов могут влиять на экспрессию и активность Дофа-декарбоксилазы (ДДК)[44]. ДДК является основным ферментом путей синтеза как дофамина, так и серотонина, поскольку она превращает L-3,4-дигидроксифенилаланин в дофамин, а L-5-гидрокситриптофан — в серотонин. Кроме того, ДДК поддерживает превращение гистидина в гистамин. Совместная работа АПФ2 с ДДК указывает на возможную функциональную связь между АПФ2-опосредованным синтезом ангиотензина 1-7 и ДДК-опосредованным синтезом дофамина и серотонина. Аргументируя существование такой связи, R. Pawlak и соавт. показали, что содержание дофамина в головном мозге увеличивается после инфузии ангиотензина 1-7 в гипоталамус крыс[45]. Ангиотензин 1-7 стимулирует почечный синтез дофамина[46]. И наоборот, взаимодействие АПФ2 с ДДК означает, что любое вызванное SARS-CoV-2 снижение экспрессии АПФ2 — процесс, ранее продемонстрированный для SARS-CoV, может сопровождаться изменениями путей синтеза как дофамина, так и серотонина. Подавление центральной и периферической ДДК может увеличить секрецию гипоталамического и внегипофизарного ПРЛ, что является еще одним путем развития гиперпролактинемии на фоне COVID-19 (рис. 4).
Рис. 4. Механизм гиперпролактинемии при COVID-19 (адаптировано из[32])
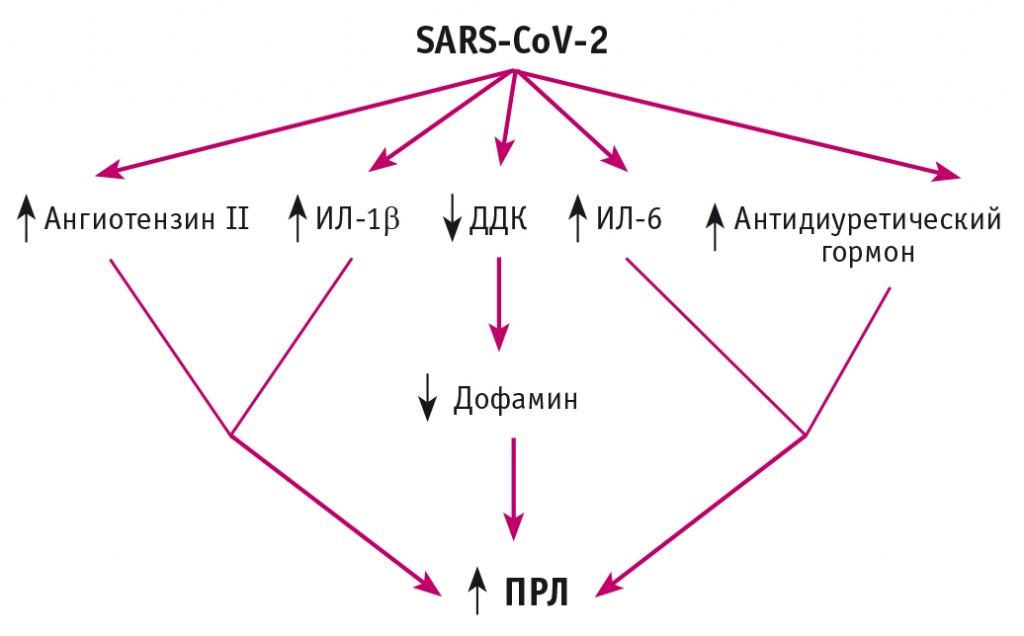
Механизмы, лежащие в основе гиперпролактинемии в сыворотке крови при COVID-19, плохо изучены, хотя потенциальными механизмами могут быть стресс, окислительная и иммунная дисрегуляция. Высокий уровень ПРЛ в сыворотке крови при COVID-19 может служить компенсаторным механизмом противодействия гипервоспалению и связанным с ним эндокринопатиям. SARS-CoV-2 индуцирует активацию провоспалительных цитокинов, Тоll-подобного рецептора 4 и МАП-киназы с ингибированием тиреотропного и адренокортикотропного гормонов, кальцитонин-ген-родственного пептида, что способствует активации высвобождения ПРЛ, который, в свою очередь, стимулирует макрофагальный воспалительный белок-1α, ИФН-10 с ингибированием регуляторных Т-клеток. Эти процессы приводят к гипервоспалению при COVID-19 и утяжелению клинических проявлений данного заболевания (рис. 5).
Рис. 5. Пролактин и тяжесть COVID-19 (адаптировано из[32])
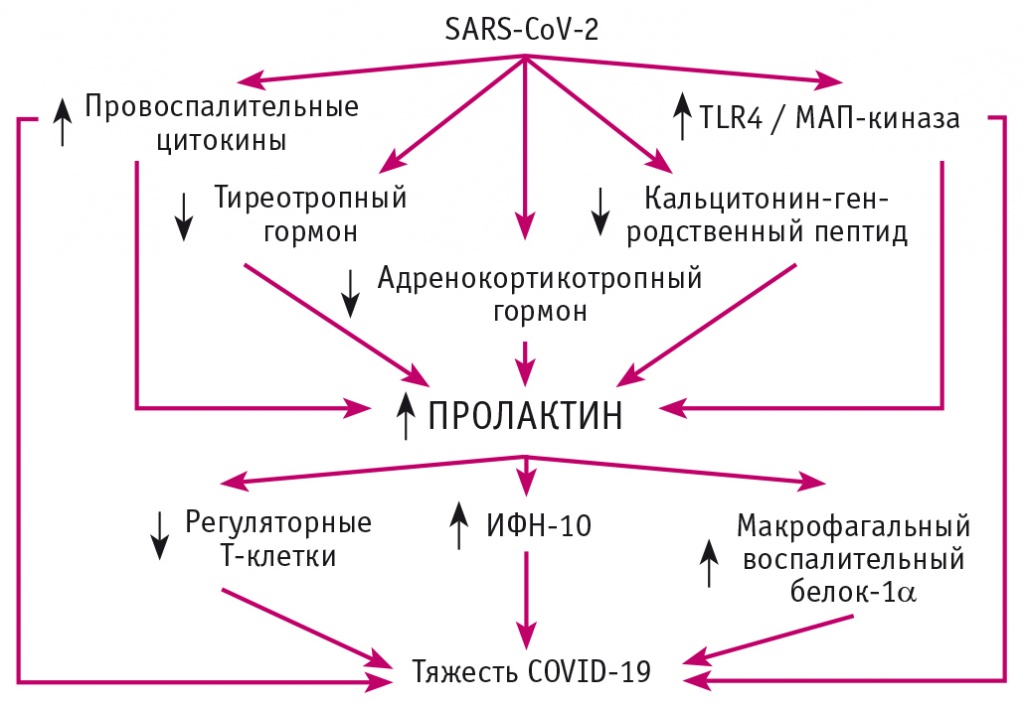
Авторы большинства исследовательских работ сообщают, что необходимы экспериментальные, клинические испытания и клинические исследования, чтобы подтвердить воспалительную и/или противовоспалительную роль ПРЛ при COVID-19[32, 42].
ЗАКЛЮЧЕНИЕ
Учитывая известные особенности вируса SARS-CoV-2 и отсутствие возможности выполнить его полную изоляцию, является актуальным как можно более детальное изучение патологических механизмов приводящих к развитию тяжелых клинических проявлений COVID-19 у всех групп пациентов. В данной обзорной статье рассмотрены вероятные механизмы развития гиперпролактинемии у пациентов с COVID-19 и представлены результаты немногочисленных исследований, изучающих возможный вклад гиперпролактинемии в развитие тяжелых форм COVID-19.
Поступила: 23.03.2023
Принята к публикации: 25.05.2023








