В настоящее время в научной литературе и клинической практике неуклонно растет интерес к такой проблеме, как дефицит тестостерона у женщин. Согласно имеющимся публикациям, лечение тестостероном сегодня все чаще рассматривается не только как патогенетическая терапия для мужчин с его дефицитом (гипогонадизмом), но и как физиологически необходимая и патогенетически целесообразная гормональная фармакотерапевтическая опция для женщин в разные периоды жизни, особенно в пре- и постменопаузе[23, 41, 48, 57]. Тем не менее следует признать, что проблема дефицита тестостерона у женщин, к сожалению, пока очень далека от своего окончательного разрешения и формирования общего научного консенсуса. Это можно объяснить целым рядом причин.
Во-первых, до настоящего времени не существует четкого и принятого большинством научно-профессиональных сообществ определения термина «андрогенный дефицит (дефицит тестостерона) у женщин», несмотря на то что об этой проблеме женского здоровья стали писать еще 10–15 лет назад[9, 14].
Во-вторых, проблема изучения данного аспекта гендерной эндокринологии связана с методологическими сложностями точного определения более низких, чем у мужчин, уровней тестостерона, характерных для женщин. Известно, что даже у мужчин точное определение уровня общего тестостерона в крови на основе наиболее распространенных в клинической практике методов радиоиммунного анализа зачастую становится сложнейшей лабораторной задачей, так как эти методы характеризуются высокими уровнями погрешности при определении концентрации стероидных гормонов. В нижних терцилях диапазона концентраций общего тестостерона, свойственного женщинам, погрешность особенно велика. Более того, плазменный уровень тестостерона как у мужчин, так и у женщин может не соответствовать его истинной концентрации в клетках органов-мишеней с учетом возможности связывания половых стероидов с белками-переносчиками плазмы крови (необратимо, например с ГСПС, или обратимо — с альбуминами плазмы) и наличия механизмов внутриклеточного синтеза из надпочечниковых и яичниковых прогормонов.
Трудность точного определения уровней фракций тестостерона у женщин в рутинной практике в настоящее время не позволяет объективно оценить взаимосвязь между концентрацией тестостерона и возможными клиническими проявлениями его дефицита в разные периоды жизни женщины. Однако, согласно мнению мировых экспертов, решение методологических проблем корректного измерения концентрации тестостерона у женщин (как и у мужчин) может быть связано с более широким внедрением в клиническую практику самого точного метода определения уровней стероидных гормонов в крови — хромато-масс-спектрометрии[32, 56].
В целом следует отметить, что проблема дефицита тестостерона у женщин по-прежнему остается источником мифов и недопонимания, причиной которых являются, в частности, неправильные представления о физиологической роли тестостерона в жизни женщины. При этом отношение к проблеме в разных странах мира также крайне противоречивое. Например, в Великобритании и Австралии лицензированы препараты натурального тестостерона для женщин старше 60 лет[41]. С другой стороны, с 2013 г. в США нет лицензированных для женщин препаратов натурального тестостерона, а все препараты тестостерона включены в классификацию лекарственных средств как «класс X — тератогены», что вызывает недоумение и разочарование у многих экспертов[23].
В данном литературном обзоре предпринята попытка взглянуть на физиологическую роль тестостерона в организме женщины в разные периоды ее жизни с точки зрения, возможно, весьма отличающейся от общепринятых представлений и потому кажущейся парадоксальной или неправильной. Однако накопленные за последние годы доказательные научные данные позволяют говорить о том, что тестостерон является половым гормоном, значение которого для женщин явно недооценено, а полноценной и всесторонней объективной оценке мешают существующие мифы и недопонимание.
ОБЩАЯ ЭНДОКРИНОЛОГИЯ ТЕСТОСТЕРОНА И ЕГО ВЗАИМОСВЯЗЬ С ДРУГИМИ ПОЛОВЫМИ СТЕРОИДНЫМИ ГОРМОНАМИ В ЖЕНСКОМ ОРГАНИЗМЕ
Синтез и метаболизм андрогенов у женщин тесно связаны с яичниками, надпочечниками и периферическими тканями, которые принимают активное участие в их биотрансформации. Андрогены у женщин, как и у мужчин, представлены дегидроэпиандростерон-сульфатом, дегидроэпиандростероном, андростендионом, тестостероном и 5α-дегидротестостероном (5α-ДГТ), однако, в отличие от мужчин, концентрация первых трех гормонов у женщин выше, чем двух последних. Секреция андрогенов в надпочечниках у женщин регулируется адренокортикотропным, а в яичниках — лютеинизирующим гормоном (ЛГ), а также некоторыми другими интрагландулярными, аутопаракринными механизмами[13].
У женщин около 25% андрогенов образуется в яичниках, 25% — в надпочечниках, остальные синтезируются в периферических тканях из одних и тех же исходных гормональных субстратов: дегидроэпиандростендиона и дегидроэпиандростендион-сульфата, — которые являются универсальными прогормонами, синтезирующимися в надпочечниках, причем в количествах, превышающих уровень секреции кортизола, а содержание дегидроэпиандростендиона в крови уступает только уровню холестерина[33, 46].
Циркулирующий в крови тестостерон у женщин функционирует как прогормон, способный к конверсии в 5α-ДГТ или 17β-эстрадиол в тканях-мишенях. Кроме того, тестостерон может синтезироваться в тканях-мишенях «по требованию». Тестостерон у женщин способен оказывать как прямое действие на органы-мишени, в которых экспрессируются рецепторы к тестостерону (в частности, он необходим для синтеза мозговых нейростероидов, обеспечивающих либидо и болевую перцепцию, а также активно участвует в метаболизме жировой и, в большей степени, мышечной ткани, в том числе детрузора и сфинктеров мочевого пузыря), так и опосредованное влияние через трансформацию в 5α-ДГТ, регулирующий метаболизм волосяных фолликулов, рост волос и синтез кожного сала.
Синергические взаимодействия тестостерона с эстрогенами крайне необходимы для обеспечения полноценных физиологических эффектов в ЦНС, костной ткани, ткани молочной железы, яичников и т. д.[21]. Поэтому любые нарушения синтеза или метаболизма тестостерона могут иметь негативные последствия как для многих составляющих женского здоровья (репродуктивной, мочеполовой, костно-мышечной системы, сексуальной сферы, ЦНС), так и для качества жизни женщины в целом[2–4, 8, 21, 42, 51].
Таким образом, тестостерон играет важную роль в физиологии женщины в течение всей ее жизни. Уровень плазменного тестостерона у женщин превышает в десятки раз уровень плазменного эстрадиола, что позволяет говорить о том, что тестостерон — один из наиболее активных половых стероидных гормонов у женщин (рис. 1)[23].
Рис. 1. Возрастная динамика уровней тестостерона и эстрадиола у женщин в течение жизни[23]
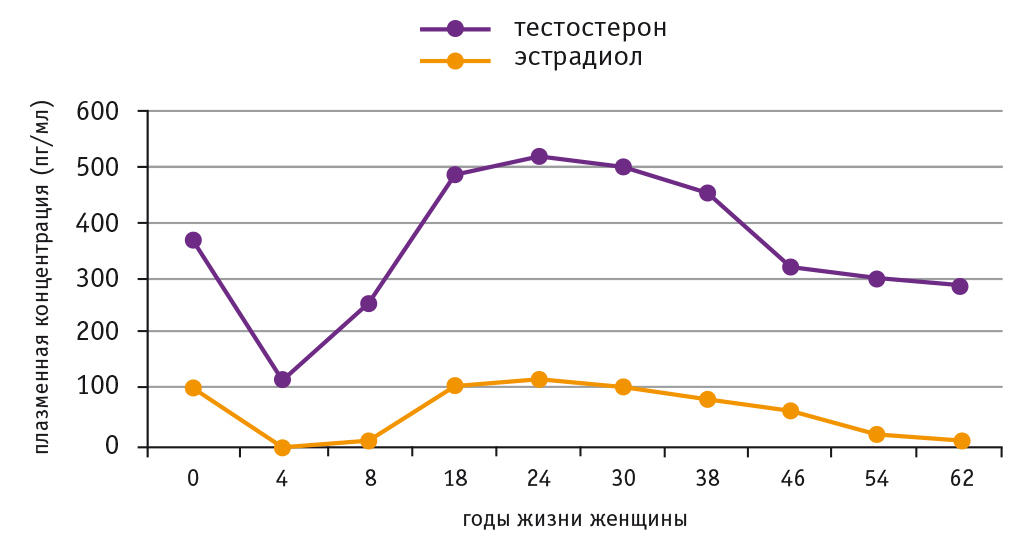
Несмотря на то что эстрогены традиционно рассматриваются как основные компоненты МГТ у женщин, еще в 1937 г. было показано положительное действие тестостерона на некоторые симптомы женской менопаузы[45].
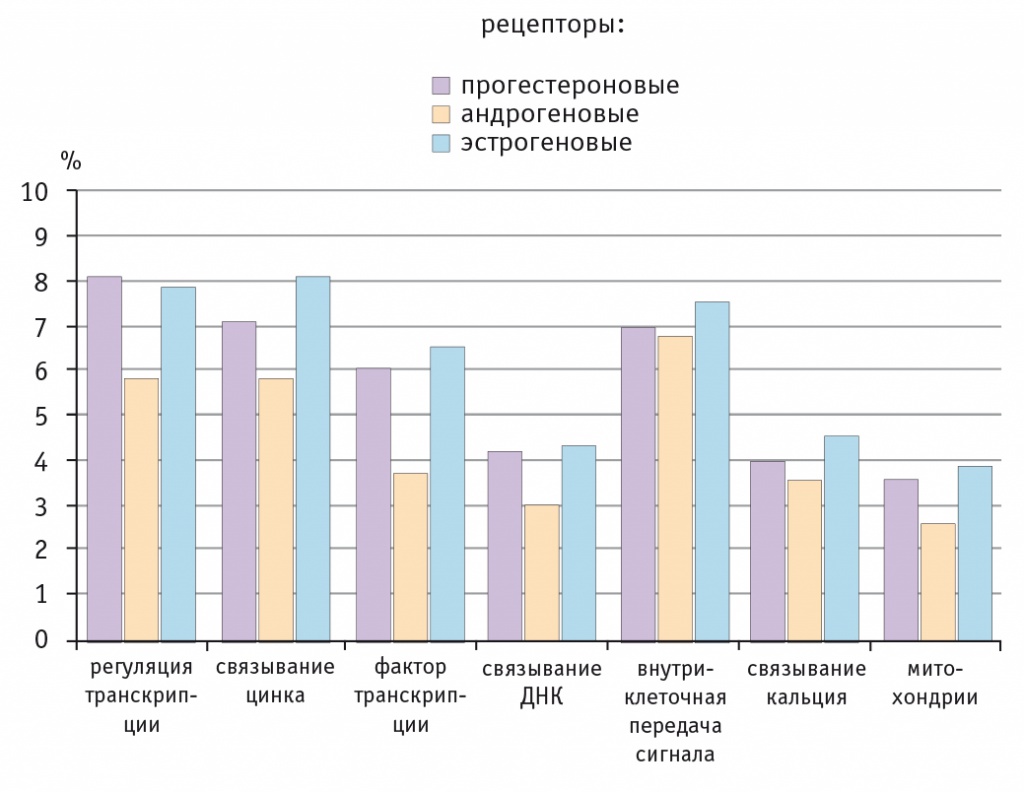
Никто сегодня не будет оспаривать известный факт, что и у мужчин, и у женщин имеются рецепторы ко всем половым стероидным гормонам: к эстрогенам (эстрогеновые рецепторы), к тестостерону (андрогеновые рецепторы) и к прогестерону. Отсюда следует вывод, что для обеспечения нормальных физиологических функций женскому организму в любом возрасте нужны эффекты всех трех половых стероидных гормонов (эстрогенов, прогестерона, андрогенов). Об этом свидетельствуют результаты современных исследований, показавших большое значение всех трех половых гормонов в регуляции различных физиологических процессов в клетке (в регуляции транскрипции и внутриклеточной передачи сигнала, связывании цинка, кальция и ДНК, в обеспечении нормальной функции митохондрий клеток, направленной не только на синтез энергии, но и на инактивацию свободных радикалов кислорода).
В этих процессах участвуют и эстрогены (активация эстрогеновых рецепторов приводит к модулированию экспрессии около 600 генов), и прогестерон (активация прогестероновых рецепторов вызывает модулирование около 1800 генов), и тестостерон (активация андрогеновых рецепторов ведет к изменениям экспрессии около 250 генов)[7] (рис. 2).
Рис. 2. Процент генов основных функциональных категорий при активации различных стероидных рецепторов[7]
ОБЩИЕ ФИЗИОЛОГИЧЕСКИЕ ЭФФЕКТЫ ТЕСТОСТЕРОНА В ЖЕНСКОМ ОРГАНИЗМЕ
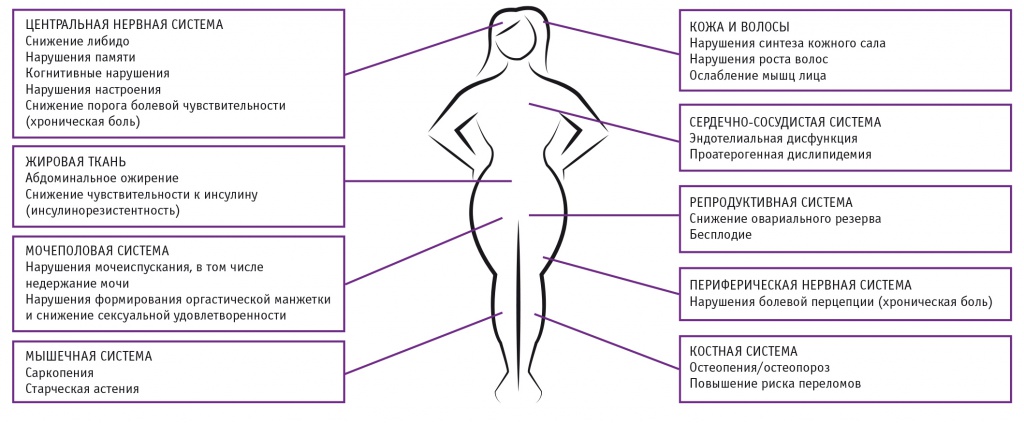
Научные данные последнего времени свидетельствуют о том, что роль тестостерона у женщин не ограничивается регуляцией сексуальной функции и либидо — это лишь небольшая часть физиологических эффектов тестостерона у женщин, отражающая общепринятое (и, с нашей точки зрения, весьма узкое) понимание физиологической роли тестостерона в женском организме, которое зафиксировано в том числе и в рекомендациях Международного общества по менопаузе [14, 18, 20, 31, 41, 57]. Следует напомнить, что андрогеновые рецепторы у женщин находятся в клетках подавляющего большинства тканей, включая молочные железы, сердце, кровеносные сосуды, ЖКТ, легкие, головной и спинной мозг, периферические нервы, мочевой пузырь, уретру, матку, яичники, влагалище, кожу, костную ткань, костный мозг, синовиальные оболочки, мышечную и жировую ткани[8, 10, 39, 40, 54]. Поэтому дефицит тестостерона у женщин может проявляться не только сексуальными нарушениями (снижением либидо, нарушением сексуальной удовлетворенности и оргазма), но и другими патологическими симптомами, включая дисфорическое настроение (тревогу, раздражительность, депрессию), плохое самочувствие, физическую усталость, потерю костной и мышечной массы (остеопороз и саркопению), ожирение, изменения познавательной и когнитивной функций (болезнь Альцгеймера), нарушения памяти, хроническую боль, нарушения мочеиспускания, в том числе недержание мочи, репродуктивные нарушения и т. д., которые в обобщенном виде представлены на рисунке 3 [5, 6, 8, 17, 19, 20, 22, 24, 29, 35, 37, 40, 42, 47, 48, 52, 57].
Рис. 3. Возможные последствия дефицита тестостерона у женщин (по данным [5, 6, 8, 17, 19, 20, 22, 24, 29, 35, 37, 40, 42, 47, 48, 52, 57])
ФИЗИОЛОГИЧЕСКАЯ РОЛЬ ТЕСТОСТЕРОНА У ЖЕНЩИН В РЕПРОДУКТИВНОМ ВОЗРАСТЕ
Тестостерон, наряду с эстрогенами и прогестероном, является активным участником регуляции менструального цикла и овуляции у женщин в репродуктивном возрасте. Об этом свидетельствует относительное повышение его плазменной концентрации в период овуляции по сравнению с другими фазами менструального цикла, что схематично изображено на рисунке 4 [12, 13, 55].
Рис. 4. Схема взаимодействия половых стероидных гормонов в регуляции менструального цикла и овуляции у женщин репродуктивного возраста (по данным [12, 13, 55])
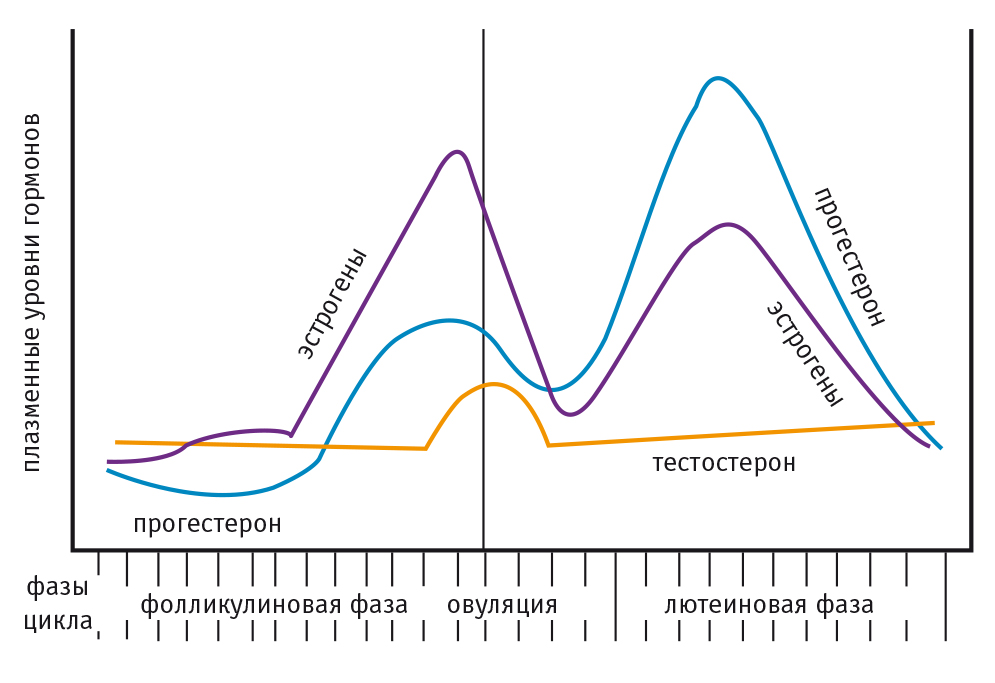
Для объяснения этого эндокринологического феномена можно обратиться к работам N. Gleicher и соавт. (2008–2014), выдвинувших новую концепцию патогенеза репродуктивных нарушений у женщин[25–27]. Согласно их теории «старения среды внутри яичников», снижение фертильности у женщин может быть обусловлено не только «старением яйцеклетки», но и нарушениями гормонального гомеостаза внутри самих яичников[25–27]. Авторы установили, что в ранней фолликулярной фазе менструального цикла существует механизм возможного взаимодействия между андрогенами и фолликулостимулирующим гормоном (ФСГ)[25–27]. Очевидно, описанный ранее подъем плазменного уровня тестостерона у женщин в периовуляторном периоде может быть отражением этой связи.
В одном из последних исследований на самках лабораторных мышей с искусственно созданной моделью мутаций андрогеновых рецепторов (нокаутированные по андрогеновым рецепторам самки) было показано статистически значимое снижение их фертильности вследствие недостаточной нейроэндокринной отрицательной обратной связи с гипофизом, что сопровождалось уменьшением концентрации ЛГ в крови до уровня, соответствовавшего таковому после овариэктомии, на основании чего был сделан вывод, что дефицит тестостерона может приводить к нарушениям созревания яйцеклеток[16].
При условии идентичности клинических характеристик и параметров стимуляции яичников в циклах ЭКО частота наступления беременности (16,18% против 40,15%, р < 0,0001) и имплантации эмбрионов (10,07% против 22,41%, р = 0,002) при значениях тестостерона крови ≤ 1,115 нмоль/л оказалась статистически значимо ниже, чем при значениях > 1,115 нмоль/л. Авторы исследования полагают, что базальный уровень общего тестостерона крови у женщин ≤ 1,115 нмоль/л может служить показателем более низкой частоты имплантации после ЭКО у женщин со сниженным фолликулярным резервом [36].
Эти положения стали теоретической основой для разработки и внедрения в практику нового направления репродуктивной медицины — андрогенного прайминга у женщин 37–42 лет со сниженным овариальным резервом, не отвечающих на стандартную стимуляцию ооцитогенеза хорионическим гонадотропином в циклах подготовки к ЭКО[25–27]. В таких случаях тестостерон используется как основа для производства эстрогенов, которые важны для нормального созревания фолликулов и подготовки эндометрия к имплантации эмбриона, ведь если тестостерона становится меньше, то снижается и количество эстрогенов.
Поэтому гипоандрогенное состояние у женщины замедляет процесс созревания яйцеклеток и снижает их качество: не только зрелость — увеличивается и количество дефектов в ядрах ооцитов. Если женщина в такой ситуации вступает в программу ЭКО, есть риск, что будет получено меньше необходимых 4–5 яйцеклеток, а также что они будут незрелыми. При этом у многих из них выявляются более низкий уровень общего тестостерона и более высокий уровень ГСПС, чем у пациенток 37–42 лет с удовлетворительным ответом на стандартную стимуляцию или у женщин более молодого возраста[38].
С учетом современной тенденции репродуктологии — резкого увеличения возраста женщин, впервые решающих зачать ребенка после 35 лет, — проблема получения достаточного количества зрелых яйцеклеток у этой категории пациенток становится все более и более актуальной. Андрогенный прайминг может стать одной из эффективных методик улучшения репродуктивных показателей у женщин, у которых в предшествующих программах ЭКО после стимуляции высокими дозами гонадотропинов удавалось получить 3 или менее качественных яйцеклетки.
Наиболее часто методика андрогенного прайминга применяется при сниженном овариальном резерве у женщин в возрасте 35–37,5 года и старше с уровнями антимюллерова гормона < 1,1 нг/мл, ФСГ > 15 мЕд/л и неудовлетворительными результатами традиционной стимуляции, подтвержденными данными УЗИ яичников экспертного класса[25].
В настоящее время существует достаточная доказательная база на уровне систематических обзоров и метаанализов для утверждения, что низкий уровень тестостерона может снижать репродуктивные способности женщин, особенно в поздней фазе репродуктивного периода[11, 28, 49]. Как ни парадоксально, но, по мнению ведущих мировых специалистов в области андрогенного прайминга, именно тестостерон может играть критическую роль в регуляции женской репродукции[25, 26, 44].
Известно, что тестостерон у женщин стимулирует овуляцию, увеличивает плодовитость и в прошлом его безопасно использовали даже для лечения тошноты на ранних сроках беременности без каких-либо побочных эффектов как у плода, так и у матери[23, 53]. Кроме того, сегодня не существует доказательств какого-либо отрицательного воздействия на плод физиологических доз тестостерона[23]. Исследования на животных показали, что вирилизация плода женского пола требует чрезвычайно высоких доз тестостерона (в 30 раз выше нормального уровня тестостерона у матери или в 50–500 раз больше дозы тестостерона для человека), которые при этом должны вводиться в течение длительного времени[30]. При физиологической беременности у женщины уровень эндогенного тестостерона повышается примерно в 2,5–4 раза, но при этом плацента является буфером для избыточной диффузии гормонов и мощным источником ароматазы, метаболизирующей материнский тестостерон[50].
ФИЗИОЛОГИЧЕСКАЯ РОЛЬ ТЕСТОСТЕРОНА У ЖЕНЩИН В ПЕРИ- И ПОСТМЕНОПАУЗЕ
До сих пор существует твердая убежденность, что у женщин в перименопаузе на фоне возрастного дефицита эстрогенов закономерно развивается гиперандрогения, с которой связаны многие негативные явления. На самом деле все происходит наоборот. Известно, что уровень прогестерона снижается у многих женщин уже в 35 лет, когда клинического дефицита эстрогенов еще может не быть. Прогестерон — основной прогормон для синтеза как эстрогенов, так и тестостерона, поэтому с возрастом у женщин происходит значительное снижение уровня не только эстрогенов, но и андрогенов[6, 19, 43].
Концентрации общего и свободного тестостерона, как и надпочечниковых андрогенов (андростендиона и дегидроэпиандростерона), уже в 40–45 лет составляют в среднем 50%, в 60 лет — около 30%, в 70 лет — 10% от таковых у 20-летних женщин, что отражено во многих клинических рекомендациях по менопаузе, в частности Международного общества по изучению менопаузы[20, 48]. Таким образом, можно ожидать, что у многих женщин еще в период менопаузального перехода, когда уровень эстрогенов остается нормальным и отсутствуют яркие клинические признаки эстрогеновой недостаточности, может иметь место дефицит тестостерона с описанными ранее его клиническими проявлениями, которые продолжают прогрессировать на фоне проявления и такого же прогрессирования клинических симптомов эстрогенной недостаточности[5, 6, 8, 17, 20, 22, 24, 29, 35, 37, 40, 42, 47, 48, 57].
Развитию дефицита тестостерона в период перименопаузы и далее в постменопаузе могут способствовать известные патофизиологические изменения в организме женщины, связанные с возрастным уменьшением плотности андрогеновых рецепторов в тканях-мишенях на фоне одновременного увеличения синтеза ГСПС — белка-ловушки для половых стероидов, — что приводит к уменьшению фракции свободного (биодоступного) тестостерона. Оба эти процесса могут стать причиной снижения андрогеночувствительности тканей различных систем и органов, в частности влагалища[10]. Становится понятным, что улучшение сексуальной функции постменопаузальных женщин, возможно, связано с нормализацией андрогенового статуса, о чем свидетельствуют данные доступных метаанализов[47].
Однако в постменопаузе происходят и иные неблагоприятные метаболические события, которые в гораздо большей степени предопределяют прогнозы и риски для здоровья женщин в условиях возрастного дефицита половых гормонов. Речь идет о менопаузальном ожирении и высоком риске развития в связи с ним инсулинорезистентности и сахарного диабета 2 типа у женщин именно в это период жизни, что связано с дефицитом не только эстрогенов, но и тестостерона и дополнительно — с дефицитом/недостаточностью витамина D[34].
Важная роль тестостерона в обеспечении нормального углеводного обмена у женщин с менопаузальным ожирением подтверждается новыми данными, согласно которым достоверные связи между степенью выраженности ожирения и плазменным уровнем половых стероидных гормонов у женщин выявляются в большей степени в отношении тестостерона и витамина D, а не эстрогенов[15].
Мы полагаем, что в постменопаузе у женщин к моменту возникновения клинических проявлений дефицита эстрогенов уже может длительно существовать формирующийся раньше дефицит тестостерона, который в большинстве случаев остается недиагностированным и некорректированным, что негативно сказывается на качестве жизни[1, 2].
ЗАКЛЮЧЕНИЕ
Литературный обзор продемонстрировал важную физиологическую роль тестостерона не только для сексуальной жизни женщины. Доступные доказательные исследования подтверждают наличие других важных метаболических эффектов тестостерона в разные периоды ее жизни, включая репродуктивный возраст и постменопаузу. Безусловно, тема дефицита тестостерона у женщин в современной науке и клинической практике остается одной из крайне неоднозначных и противоречивых, в отличие, например, от темы возрастного дефицита эстрогенов, традиционно описываемых как ключевые женские половые гормоны.
Физиология эстрогенов достаточно хорошо изучена современной наукой, достижения которой сегодня активно и успешно применяются в клинической практике в виде эстрогенозаместительной терапии, но мы не должны при этом игнорировать роль тестостерона в женском организме, который ей зачем-то все же дан природой. Если в организме женщины синтезируется тестостерон, значит это нужно, и, закрывая глаза на проблему его дефицита у женщин, мы пытаемся тем самым отменить законы природы, что сделать никому не удастся.
Выход один — не нужно отрицать проблему дефицита тестостерона у женщин, предварительно не изучив ее полноценно и всесторонне, чтобы прийти, наконец, к ее общему и логическому пониманию. Без этого целей профилактической медицины XXI века по увеличению продолжительности качественной жизни женщин, скорее всего, нам не достичь.








