Патофизиологические механизмы, объясняющие развитие эндокринной офтальмопатии (ЭОП) и ее связь с аутоиммунными заболеваниями щитовидной железы (ЩЖ), не до конца известны. Офтальмопатия считается следствием аутоиммунной реакции с вовлечением сенсибилизированных Т-лимфоцитов и аутоантител к специфическим орбитальным или общим для ЩЖ и орбиты антигенам. Тесная взаимосвязь между болезнью Грейвса (БГ), ЭОП и тиреоидной дермопатией может свидетельствовать о том, что все эти заболевания являются следствием единого аутоиммунного процесса, но с различными проявлениями в ЩЖ, глазах и коже[6]. Присутствие антител к рецептору тиреотропного гормона (рТТГ) у большинства пациентов с БГ, тиреоидной дермопатией и ЭОП, повышенная экспрессия рТТГ в орбитальных тканях и в претибиальной клетчатке позволяют предположить, что иммунореактивность против рТТГ лежит в основе всех этих состояний. Уровень антител к рТТГ коррелирует со степенью активности и тяжести ЭОП[2].
Антитела к рТТГ подразделяют на два функциональных типа: антитела первого типа, подобно ТТГ, связываются с тиреоидными клетками и стимулируют их, второго — блокируют стимуляцию ЩЖ. При БГ вырабатываются оба типа антител; считается, что их соотношение может меняться, приводя к смене функциональной активности ЩЖ.
Существуют две методики определения уровня антител к рТТГ в сыворотке крови: метод конкурентного ингибирования связывания ТТГ с рТТГ и биологический метод, основанный на определении активности циклического аденозинмонофосфата[3]. Если первый метод позволяет определить общее содержание антител к рТТГ, то биологическим методом можно измерить уровни стимулирующих и блокирующих антител. Однако биологический метод дорог, трудоемок и не применяется в клинической практике.
На сегодняшний день разработаны три генерации коммерческих лабораторных наборов для определения антител к рТТГ. В наборах 1-го поколения используется радиорецепторный анализ с растворимым свиным рТТГ. Наборы 2-го поколения определяют антитела к рТТГ с помощью радиорецепторного, хемилюминесцентного анализа или ИФА с применением свиного или рекомбинантного человеческого рТТГ, иммобилизированного на твердой фазе. В новейших наборах ИФА 3-го поколения в качестве метки используются человеческие моноклональные антитела М22, стимулирующие рТТГ. Некоторые исследования показали бо́льшую чувствительность в диагностике БГ наборов 3-го поколения (99%) по сравнению с наборами 2-го (95%) и 1-го (80%) поколений[8]. При этом значимость наборов 3-го поколения для диагностики ЭОП изучена недостаточно.
Целью нашего исследования стали оценка и сопоставление диагностической значимости двух методик определения антител к рТТГ в сыворотке крови человека — наборов 2-го и 3-го поколения.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проведено на базе кафедры эндокринологии ИПО Первого Московского государственного медицинского университета им. И. М. Сеченова (зав. кафедрой — д. м. н., профессор Н. А. Петунина). В ходе перекрестного исследования нами были обследованы 73 пациента с БГ (47 женщин и 26 мужчин) в возрасте 47,2 ± 13,4 года. Диагноз БГ устанавливали на основании данных анамнеза, клинической картины, тиреоидного статуса, УЗИ ЩЖ. Наличие положительного титра антител к рТТГ на момент манифестации синдрома тиреотоксикоза свидетельствовало о наличии БГ.
Среди обследованных у 59 человек в ходе офтальмологического осмотра была выявлена ЭОП различной степени активности и тяжести, подтвержденная результатами визуализации орбит. Уровень активности ЭОП оценивали по шкале клинической активности (Clinical Activity Score), степень тяжести — по классификации Европейской группы по изучению офтальмопатии Грейвса (European Group on Graves’ Оrbitopathy).
У всех пациентов были измерены уровни антител к рТТГ с помощью двух методик. Методика 2-го поколения: антитела к рТТГ определяли методом ИФА с использованием наборов DRG (Германия). Референсные значения антител к рТТГ: > 1,5 Ед/л — положительные, 1,1–1,5 Ед/л — серая зона, ≤ 1 Ед/л — отрицательные. Методика 3-го поколения: антитела к рТТГ определяли методом ИФА с применением наборов Medizym TRAb clone (Medipan, Германия). Референсные значения: > 0,4 МЕ/л — положительные, > 0,3–0,4 МЕ/л — серая зона, ≤ 0,3 МЕ/л — отрицательные.
Статистическую обработку данных выполняли с помощью пакета программ SPSS 21.0. Для сравнения независимых выборок использовали U-критерий Манна — Уитни. Распределение частот сравнивали с применением критерия χ2. Данные в тексте и в таблице представлены в виде М ± SD (М — среднее арифметическое, SD — среднеквадратичное отклонение). Различия считали статистически значимыми при р < 0,05.
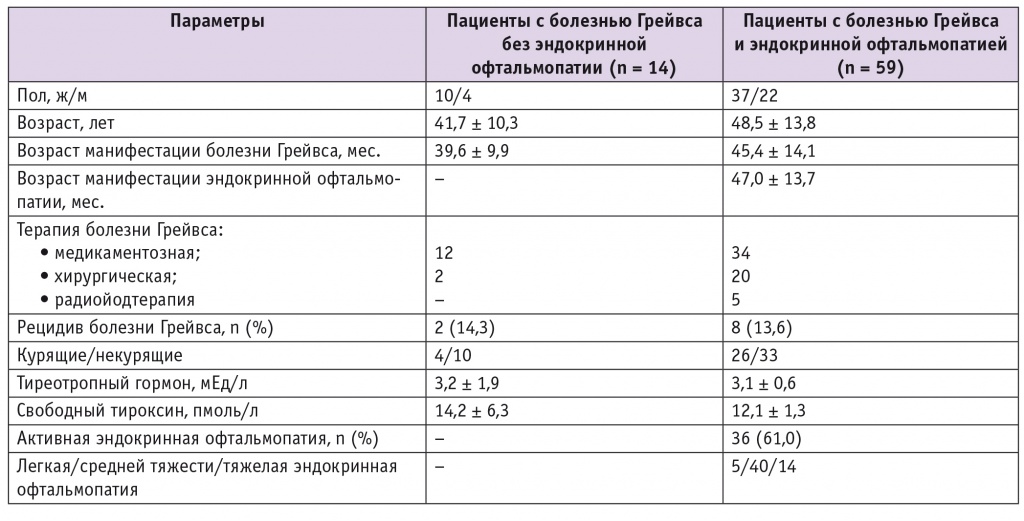
Пациенты были разделены на две группы — с БГ без клиники ЭОП (n = 14, 19,2%) и с БГ и ЭОП (n = 59, 80,8%). Группы не различались по возрасту, полу, возрасту манифестации БГ, тиреоидному статусу. Клиническая характеристика больных представлена в таблице. В группе пациентов с ЭОП 57,6% получали тиреостатическую терапию, у 33,9% в анамнезе было оперативное лечение тиреотоксикоза, у 8,5% — терапия I131. В группе пациентов без ЭОП тиреостатическое лечение получали 85,7%, 14,3% перенесли тиреоидэктомию.
Таблица
Клиническая характеристика обследованных пациентов
РЕЗУЛЬТАТЫ
У всех больных определяли уровень антител к рТТГ с помощью двух методик. При использовании методики 2-го поколения антитела к рТТГ были положительными у 65,8%, в серой зоне — у 10,9%, отрицательными — у 23,3% больных. При применении методики 3-го поколения антитела к рТТГ оказались положительными у 87,7% пациентов, в серой зоне — у 4,1%, отрицательными — у 8,2%. Таким образом, чувствительность методики 3-го поколения для диагностики БГ статистически значимо выше, чем методики 2-го поколения (87,7% с ДИ 79,5–93,2% против 65,8% с ДИ 55,1–75,3%; p < 0,01).
У пациентов с ЭОП чувствительность методики 2-го поколения составила 66,1%, а 3-го поколения — 84,7% (при сравнении с таковыми у больных БГ без ЭОП p > 0,01). Доли отрицательных и сомнительных результатов в двух группах также не имели значимых различий.
Уровень антител к рТТГ, определенных с помощью наборов как 2-го, так и 3-го поколения, положительно коррелировал со степенью активности ЭОП, и связь эта была сильнее для второй методики (r = 0,391, p = 0,002 и r = 0,458, p < 0,01 для 2-го и 3-го поколения соответственно), а также со степенью тяжести ЭОП (r = 0,3, p = 0,021 и r = 0,312, p = 0,016 для 2-го и 3-го поколения соответственно).
ОБСУЖДЕНИЕ
К настоящему времени опубликовано немного исследований, оценивающих диагностическую значимость методики 3-го поколения определения антител к рТТГ у пациентов с ЭОП и сравнивающих генерации лабораторных наборов, а сравнительные исследования методик 2-го и 3-го поколений определения антител к рТТГ дали противоречивые результаты[4, 9, 10, 13]. В работе отечественных авторов показана ассоциация антител, определенных методикой 3-го поколения, с активностью ЭОП и тяжестью ее клинических проявлений[4]. Наши результаты совпадают с данными S. Y. Jang и соавт., которые сравнили корреляцию антител к рТТГ, определенных методиками 2-го и 3-го поколений, и стимулирующих антител к рТТГ, измеренных биологическим методом. Результаты всех методик положительно коррелировали со степенью активности ЭОП и степенью проптоза[9].
Роль антител к рТТГ в патогенезе как ЭОП, так и БГ не вызывает сомнений. Если у большинства пациентов с офтальмопатией имеется БГ, то ЭОП клинически манифестирует приблизительно у 25–50% больных БГ и может проявиться до или одновременно с тиреотоксикозом[1]. На течение ЭОП влияют такие факторы риска, как курение, дисфункция ЩЖ и метод лечения тиреотоксикоза. При этом у 50% пациентов с БГ нет очевидных клинических признаков ЭОП, у многих выявляют легкое вовлечение глаз (часто склонное к спонтанной регрессии) и только в 20–30% случаев требуется специфическое лечение ЭОП[20]. С учетом тесной взаимосвязи этих заболеваний возникают два вопроса: может ли лечение БГ влиять на развитие и/или течение ЭОП и какой должна быть терапия выбора БГ у пациентов с установленным диагнозом ЭОП?
Консервативное лечение тиреостатическими препаратами (тиамазолом, пропилтиоурацилом) позволяет эффективно контролировать функцию ЩЖ и традиционно является терапией первого ряда в России, Европе и Японии. Сами по себе тиреостатики не влияют на течение ЭОП, однако на фоне тиреостатической терапии часто наблюдается улучшение ее клинической картины, что связано с компенсацией тиреотоксикоза и возможным снижением уровня антител к рТТГ.
Нестабильная функция ЩЖ, колебание от гипертиреоза к гипотиреозу и наоборот оказывают негативное влияние на течение ЭОП, поэтому Европейская группа по изучению офтальмопатии Грейвса рекомендует более частый контроль гормонов ЩЖ (каждые 4–6 недель) у таких больных[7].
Проспективное исследование пациентов с впервые выявленной БГ, получавших тиреостатическую терапию в течение 18 месяцев, показало, что риск развития у них ЭОП составляет 12,9%, а риск ухудшения уже имеющейся легкой активной ЭОП — 2,4%, при этом 58,1% пациентов, у которых легкая активная ЭОП была на момент манифестации БГ, вошли в ремиссию ЭОП при компенсации тиреотоксикоза[17].
Основное ограничение консервативной терапии — высокий риск рецидива тиреотоксикоза после ее отмены, что вследствие реактивации аутоиммунного процесса и увеличения титра антител к рТТГ способно привести к манифестации/ухудшению течения ЭОП. Это является главным аргументом в пользу перманентного контроля функции ЩЖ и радикального лечения.
Радиойодтерапия (I131) — эффективный метод лечения БГ, однако она может быть фактором риска развития или ухудшения течения ЭОП. Показано, что в 15–39% случаев после применения I131 ЭОП прогрессирует[5]. При этом наибольший риск наблюдался среди курильщиков и при несвоевременной компенсации пострадиационного гипотиреоза.
Патогенетический механизм, ответственный за развитие/ухудшение течения ЭОП после терапии I131, вероятно, обусловлен высвобождением антигенов из разрушенной ткани ЩЖ, которые могут стать триггером активации аутоиммунного процесса в орбите, а также развития гипотиреоза. Выявлена умеренная, но статистически значимая ассоциация между лечением I131 и развитием и/или ухудшением течения ЭОП по сравнению с тиреостатической терапией и тиреоидэктомией[5, 16] Частота прогрессирования ЭОП на фоне лечения тиреотоксикоза составила 33% после применения I131, 16% после тиреоидэктомии и 10% после медикаментозной терапии[5].
Факторы риска развития/прогрессирования ЭОП после использования I131[20]: недавняя манифестация БГ, курение, высокий уровень антител к рТТГ, высокий уровень ТТГ, тяжесть тиреотоксикоза до терапии I131 (уровень трийодтиронина ≥ 5 нмоль/л), уже имеющаяся ЭОП, особенно активная. Одни авторы считают, что чаще происходит ухудшение уже имеющейся до терапии I131 ЭОП и оно может быть предупреждено курсом ГКС[20]. Исследование других авторов показало, что риск развития ЭОП de novo после лечения I131 выше по сравнению с таковым после тиреостатической терапии, однако ухудшение течения уже существующей ЭОП происходит реже и с одинаковой частотой в обеих группах исследования, при этом курящие пациенты имеют дополнительный риск развития/ухудшения течения ЭОП после применения I131[18].
В исследовании P. Perros и соавт. у 72 пациентов с БГ и минимально активной ЭОП при своевременном назначении левотироксина натрия для предупреждения пострадиационного гипотиреоза терапия I131 не приводила к ухудшению течения ЭОП даже без стероидной профилактики[15]. Прием пероральных ГКС эффективен и безопасен для предупреждения развития и прогрессирования ЭОП после терапии I131[11]. Своевременное назначение левотироксина натрия после лечения I131 с целью профилактики пострадиационного гипотиреоза снижает риск развития/прогрессирования ЭОП почти в 2 раза[15, 16]. Хотя I131 и может быть фактором риска ЭОП, в перспективе радиоабляция ЩЖ приводит к ремиссии БГ и таким образом оказывает положительное влияние на течение ЭОП.
Хирургическое лечение БГ является эффективным, хотя и реже используемым методом. Выбор между тиреоидэктомией и терапией I131 зависит от таких факторов, как размер зоба, наличие подозрительных узловых образований и предпочтение пациента. Объем оперативного вмешательства до сих пор остается предметом обсуждения. Метаанализ 35 исследований показал, что субтотальная резекция ЩЖ (объем остаточной ткани — 3–4 г) ассоциируется с более низкой частотой развития гипотиреоза и высоким риском рецидива по сравнению с предельно-субтотальной резекцией и тиреоидэктомией[14]. Таким образом, последние являются предпочтительными при БГ.
Тиреоидэктомия должна проводиться квалифицированным хирургом, чтобы минимизировать риск послеоперационных осложнений. При небольшом зобе возможно использование минимально инвазивной технологии с видеоподдержкой. L. Tallstedt и соавт. показали, что частота развития или прогрессирования ЭОП после тиреоидэктомии или тиреостатического лечения не имеет статистически значимых различий и ниже, чем среди пациентов после терапии I131[16]. Проспективное исследование 48 пациентов с БГ, подвергшихся тиреоидэктомии, выявило улучшение течения ЭОП после операции в 90% случаев[19].
Тиреоидэктомия и I131 могут использоваться совместно для достижения полной абляции ЩЖ. После предельно-субтотальной резекции ЩЖ или тиреоидэктомии остаток ткани ЩЖ разрушается I131, как и при раке ЩЖ. Но сами по себе они не сопровождаются полной абляцией ткани ЩЖ, даже при достижении гипотиреоза. Считается, что полная абляция ЩЖ способна оказывать положительное действие на течение ЭОП, поскольку происходит элиминация антител, направленных к ткани ЩЖ. Однако длительное наблюдение показало, что исходы ЭОП не различаются у пациентов после тиреоидэктомии или тотальной абляции ЩЖ, но эффективность лечения ЭОП и скорость улучшения состояния глаз выше после тотальной абляции[12].
Учитывая патогенез ЭОП и БГ, радикальное лечение должно приводить к элиминации аутореактивных Т-лимфоцитов и аутоантител, что может оказывать положительное действие на течение ЭОП. С другой стороны, после запуска аутоиммунного процесса в орбите и манифестации ЭОП его течение может быть независимым от ЩЖ, и в этом случае абляция ЩЖ не приведет к улучшению течения ЭОП.
ЗАКЛЮЧЕНИЕ
По результатам нашего исследования, методика определения антител к рецепторам тиреотропного гормона (рТТГ) 3-го поколения с использованием стимулирующих человеческих моноклональных антител М22 имеет бо́льшую чувствительность в диагностике болезни Грейвса и эндокринной офтальмопатии (ЭОП), чем методика 2-го поколения. Уровни антител к рТТГ положительно коррелировали со степенью активности и тяжести ЭОП.








