Самыми распространенными и хорошо изученными типами сахарного диабета (СД) являются первый и второй. Тем не менее следует помнить, что СД также может развиться как прямое следствие других болезней, включая заболевания экзокринной части поджелудочной железы (ПЖ). Ранее СД в исходе заболеваний экзокринной части ПЖ называли панкреатогенным, или СД 3с типа. Сейчас используется термин «сахарный Диабет в исходе заболеваний Экзокринной части Поджелудочной железы» (ДЭП). Важно отметить, что ДЭП — крайне гетерогенное заболевание; он возникает при различных болезнях ПЖ, при которых реализуются различные механизмы гипергликемии. Наиболее частыми причинами ДЭП становятся хронический панкреатит, аденокарцинома протоков ПЖ, гемохроматоз, муковисцидоз и перенесенные операции на ПЖ[1].
Хирургия ПЖ является одним из самых технически сложных разделов абдоминальной хирургии и требует высокой квалификации и специальной подготовки хирурга. Тем не менее даже после удачно проведенной операции и благополучного послеоперационного периода у такого пациента высока вероятность развития долгосрочных осложнений: экзо- и эндокринной недостаточности ПЖ. В этом отношении особый интерес представляют исходы панкреатэктомий.
Панкреатэктомия подразделяется на два основных типа: тотальная панкреатэктомия и частичная, или резекция ПЖ. Тотальная панкреатэктомия приводит к абсолютному выпадению эндокринной и экзокринной функций ПЖ, что вызывает трудности в достижении контроля гликемии и витаминно-минерально-белковый дефицит[2]. Напротив, частичная панкреатэктомия позволяет сохранить эндокринную и экзокринную функции ПЖ и легче контролировать уровень глюкозы в крови, чем полная панкреатэктомия. Именно поэтому существует общая тенденция к выбору частичной, а не тотальной панкреатэктомии при наличии возможности[3].
Усовершенствования в диагностике позволили на ранней стадии выявлять опухоли ПЖ, что привело к увеличению числа частичных панкреатэктомий с хорошим прогнозом. Понимание изменений в эндокринной и экзокринной функциях ПЖ после частичной панкреатэктомии важно для подбора терапии и рациона пациента.
Частичная панкреатэктомия имеет два основных подтипа: резекция правой половины ПЖ — панкреатодуоденальная резекция (ПДР) и резекция левой половины ПЖ — дистальная резекция (ДР).
Первая ПДР выполнена итальянским хирургом Alessandro Codivilla в 1898 году, модифицирована хирургом Walter Kausch в 1912 году. Исходно операция выполнялась в два этапа, и Allen Whipple в 1940 году усовершенствовал ее до одноэтапной, которая получила название операции Уиппла, или классической ПДР (кПДР). Позже оказалось, что эта операция связана с высоким уровнем летальности, однако с улучшением хирургических методик смертность значительно снизилась[4].
В последние годы в специализированных клиниках летальность составляет не более 5%, но частота осложнений остается высокой и может достигать 50%[5].
Существуют два типа ПДР: кПДР и ПДР с сохранением привратника (ППДР). При кПДР удаляют головку ПЖ, двенадцатиперстную кишку, большую часть желудка, желчный пузырь и часть желчного протока, в то время как при ППДР значительная часть желудка сохраняется[4].
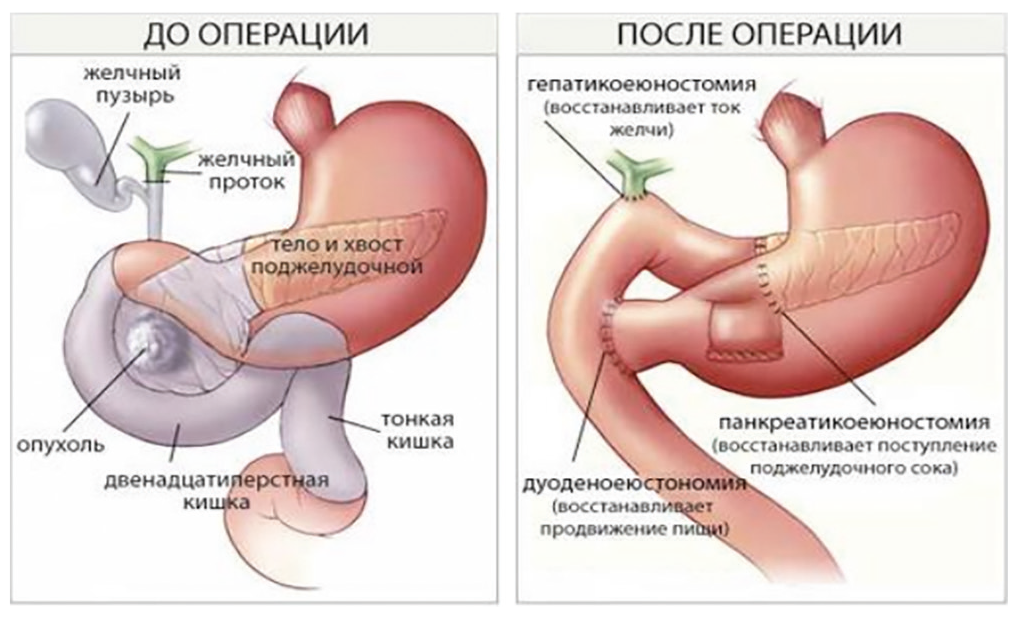
Со времени впервые выполненной А. Whipple в 1936 году ПДР не умолкают споры среди хирургов о выборе варианта реконструктивного этапа операции, в первую очередь о способе формирования панкреатодигестивного соустья. В итоге из всех видов панкреатодигестивных анастомозов остались лишь два основополагающих — анастомоз культи ПЖ с тощей кишкой (рис. 1) либо с желудком[6].
Рис. 1. Панкреатодуоденальная резекция, вариант панкреатикоеюностомии, вид до и после операции[7]
Первое упоминание об операции ДР ПЖ связано с именем F. Trendelenburg, выполнившего ее у больного саркомой в 1882 году. С тех пор апробированы различные методики ее выполнения от наиболее простых (гильотинная с перевязкой культи ПЖ лигатурой, резекция с использованием сшивающего аппарата типа YO) до сложных — с прецизионной техникой и наложением панкреатодигестивного анастомоза.
С современных позиций о сегментарном строении ПЖ, понятию «дистальная резекция поджелудочной железы» соответствует левосторонняя резекция хвоста и тела железы различного объема. В эту группу следует включить и левостороннюю субтотальную резекцию ПЖ, которая по технике выполнения отличается незначительно. Таким образом, различают: 1) удаление хвоста (объем операции — 30%); 2) гемипанкреатэктомию (резекция хвоста и тела слева от верхней брыжеечной вены) (50%); 3) резекцию хвоста, тела, перешейка справа от верхней брыжеечной вены (50–70%); 4) субтотальную резекцию с удалением хвоста, тела, головки по левому краю верхней передней панкреатодуоденальной артерии (70–95%).
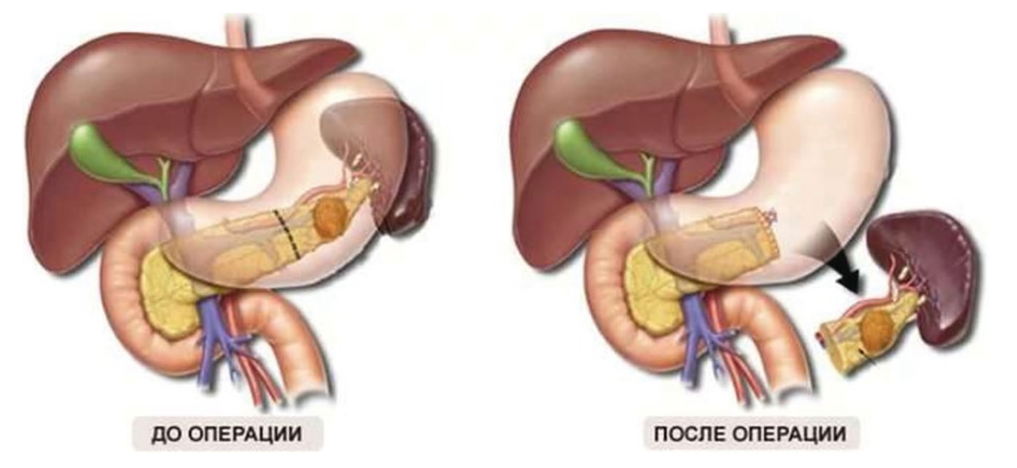
При этих вмешательствах, как правило, удаляется селезенка (схема представлена на рисунке 2), однако при благоприятных анатомических условиях возможно ее сохранение (органосберегающая левосторонняя резекция ПЖ)[8].
Рис. 2. Дистальная резекция поджелудочной железы с удалением селезенки[8]
Несмотря на то что при ПДР и ДР объемы резекции железы примерно одинаковы, анатомия желудка, кишечника и самой железы в результате операции различна, что отражается в исходах, связанных с метаболизмом глюкозы, а также в экзокринной функции после ПДР и ДР. Исследования, в которых сравнивались бы исходы после этих двух вариантов резекции, немногочисленны, в значительной степени из-за того, что ДР производят относительно реже, чем ПДР[9–11].
Еще в самых ранних публикациях показано, что любая резекция ПЖ связана с ухудшением секреции инсулина и толерантности к глюкозе[12, 13].
Изначально предполагалось, что проблема заключается только в уменьшении объема паренхимы железы. Объем резекции при ПДР (приблизительно 50%)[14, 15] аналогичен или даже больше, чем при ДР (~30–40%)[16, 17].
Еще в конце прошлого века I. Kobayashi и соавт. выявили, что ППДР приводит к задержке опорожнения желудка[18]. Исследования, в которых сравнивались кПДР и ППДР, свидетельствуют, что задержка опорожнения желудка реже происходит при кПДР[19–21]. Вероятно, именно поэтому при кПДР отмечаются более высокий уровень глюкагоноподобного пептида 1 (ГПП-1) и лучшая толерантность к глюкозе во время орального глюкозотолерантного теста (ОГТТ)[22].
Подобное повышение уровня ГПП-1 неоднократно описано как следствие хирургического удаления двенадцатиперстной кишки при ПДР[22–24], а также после бариатрической операции шунтирования желудка по Ру[25–27]. Улучшение толерантности к глюкозе и чувствительности к инсулину у пациентов после бариатрического шунтирования желудка по Ру происходит гораздо раньше, чем снижение массы тела, что может быть объяснено, по крайней мере частично, изменениями концентраций кишечных гормонов, особенно ГПП-1.
Существует много исследований по оценке углеводного обмена и риска развития СД после резекционных операций, и их результаты довольно противоречивы[9, 11, 28–34].
В недавнем систематическом обзоре и метаанализе 37 исследований, посвященных СД после резекции ПЖ, частота впервые возникшего диабета составила 16% (95% доверительный интервал (ДИ): 14–17%) при ПДР и 21% (95% ДИ: 16–25%) при ДР[11]. Большинство исследований, однако, были сосредоточены на пациентах только с ПДР, только с ДР или объединяли их в общую группу. Ухудшение углеводного обмена и развитие диабета наблюдались преимущественно в исследованиях, посвященных резекциям в целом или только ДР.
R.A. Burkhart и соавт.[28] сообщили, что ДР связана с бо’льшим риском развития диабета, чем ПДР, при этом B.W. Lee и соавт. показали, что у больных после ДР уровень секреции инсулина был ниже, чем у участников контрольной группы с нормальной толерантностью к глюкозе[31].
Исходы ПДР более противоречивы, сообщалось как об ухудшении, так и об улучшении углеводного обмена у пациентов[35]. Предполагалось, что течение СД, возникшего в частности на фоне рака ПЖ, можно улучшить путем удаления пораженной ткани ПЖ, и/или изменения массы тела, и/или чувствительности к инсулину после резекции. Для выяснения метаболических и эндокринных изменений, которые происходят после резекции, были необходимы исследования, проведенные среди людей без диабета до операции, и такие работы появились в последние годы.
Среди многих проведенных исследований стоит подробно описать опубликованную в 2021 году работу F. Niwano и соавт.[36], в которой оценены метаболические исходы у пациентов после ПДР и ДР, не имевших исходно нарушений углеводного обмена. От многих аналогичных работ она отличается тем, что в ней оцениваются как эндо-, так и экзокринная функции ПЖ.
Обследованы 109 человек, из них 73 проведена ПДР и 36 ДР. Проспективно исследовали изменения в метаболизме глюкозы, эндокринную и экзокринную функции ПЖ, а также нутритивный статус до и после операции. Метаболизм глюкозы и эндокринную функцию оценивали с помощью ОГТТ и теста с глюкагоном соответственно, а экзокринную функцию — с помощью теста N-бензоил-L-тирозил-п-аминобензойной кислоты (BT-ПАБК).
BT-ПАБК принимали перорально, он расщеплялся панкреатическим ферментом хемотрипсином до пара-аминобензойной кислоты (ПАБК), и скорость выведения ПАБК с мочой определяли через 6 часов после его введения. Влияние сопутствующих заболеваний на толерантность к глюкозе оценивали с использованием коэффициента коморбидности Charlson[37].
При измерении антропометрических параметров оказалось, что масса тела и индекс массы тела (ИМТ) пациентов значительно понизились после резекции в группе ПДР (53,2 ± 1,3 против 58,9 ± 1,5 кг, p < 0,01 и 20,5 ± 0,37 против 22,7 ± 0,43 кг/м2; p < 0,001); тенденция к снижению наблюдалась в группе ДР (50,2 ± 1,7 против 54,6 ± 2,0 кг; 21,6 ± 0,66 против 19,9 ± 0,57 кг/м2).
Уровень гликированного гемоглобина (HbA1c) существенно уменьшился в группе ПДР (38,3 ± 0,50 ммоль/моль [5,66 ± 0,05%] против 40,1 ± 0,60 ммоль/моль [5,82 ± 0,05%]; p < 0,05), но не в группе ДР (40,6 ± 0,63 ммоль/моль [5,87 ± 0,06%] против 40,8 ± 0,69 [5,88 ± 0,06%]; NS).
Чувствительность к инсулину оценивалась при помощи индекса Homeostasis Model Assessment of Insulin Resistance (НОМА-IR), при этом отсутствовала значимая разница между значениями HOMA-IR до и после операции в группах ПДР (1,18 ± 0,10 против 1,44 ± 0,10, NS) и ДР (1,12 ± 0,13 против 1,34 ± 0,13, NS).
Для оценки экзокринной функции тест БТ-ПАБК проведен у 89 пациентов (60 с ПДР и 29 с ДР). Количество ПАБК, экскретируемой с мочой, значительно снизилось после панкреатэктомии и в группе ПДР (38,9 ± 2,3% против 57,2 ± 1,5%, p < 0,001), и в группе ДР (53,9 ± 2,9% против 61,2 ± 2,0%, p < 0,05).
Снижение значения теста БТ-ПАБК было более выраженным в группе ПДР, чем в группе ДР (–32,0% против –11,9%, p < 0,01), это свидетельствует, что ПДР оказывает более сильное влияние на экзокринную систему ПЖ, чем ДР.
ТОЛЕРАНТНОСТЬ К ГЛЮКОЗЕ И СЕКРЕЦИЯ ИНСУЛИНА
Панкреатодуоденальная резекция
Авторы работы[36] сравнили результаты ОГТТ (значения 0, 30, 60, 90, 120, 150 и 180 минут) и площадь под кривой для уровней глюкозы, инсулина и С-пептида до и после ПДР. Уровни глюкозы в крови после операции были значительно ниже, чем до нее через 30, 60, 90, 120 и 150 минут, но выше в исходной точке. Уровни инсулина и С-пептида после ПДР также были значительно ниже, чем до нее во всех точках в ходе ОГТТ. Полученные результаты представлены на рисунке 3.
Рис. 3. Результаты 75-граммового перорального теста на толерантность к глюкозе (ОГТТ), полученные до и после частичной панкреатэктомии. Данные выражены в виде среднего ± SEM[36].
Примечание. Отличия от дооперационного периода статистически значимы: (*) — р < 0,05; (**) — р < 0,01; (***) — р< 0,001
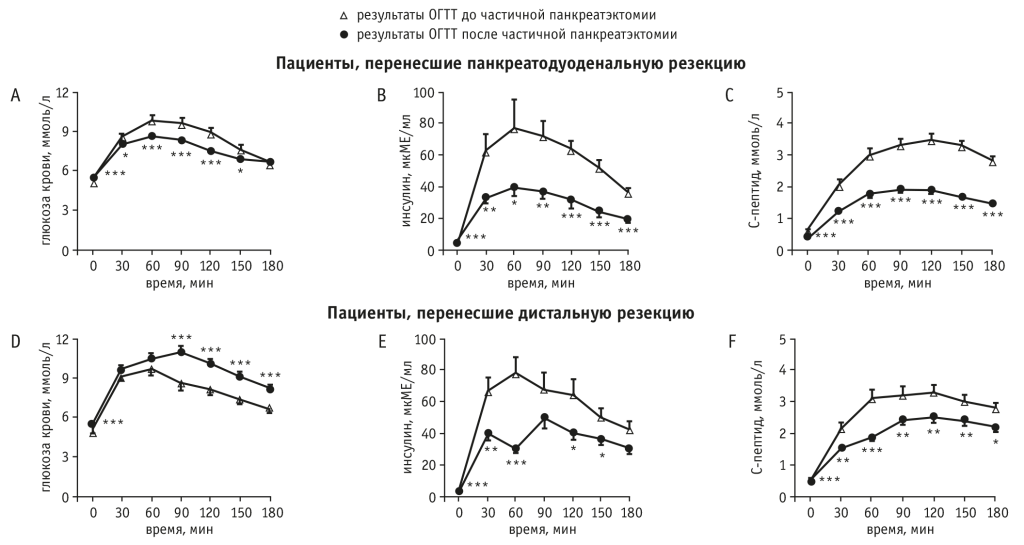
Площадь под кривой для концентраций глюкозы, инсулина и С-пептида существенно уменьшилась после ПДР. Ранний инсулиновый ответ на глюкозу, оцениваемый по индексу инсулиногенности, значимо снизился после ПДР (10,0 ± 1,4 против 16,0 ± 2,4, р < 0,05).
Чтобы лучше понять механизм секреции инсулина, оценили ее скорость с помощью теста на стимуляцию глюкагоном, который отличается от ОГТТ как используемым секретирующим средством (глюкагон, а не глюкоза), так и способом введения (внутривенно, а не перорально). Концентрации С-пептида через 0 и 5 минут, а также скорость прироста уровня C-пептида (ΔC-пептида) (от 1,15 до 0,59 нмоль/л) значительно понизились после ПДР.
Дистальная резекция
Уровни глюкозы в крови после ДР были значимо выше, чем до ДР, через 0, 90, 120, 150 и 180 минут после ОГТТ. Следовательно, площадь под кривой для глюкозы тоже увеличилась после ДР, тогда как после ПДР она уменьшилась. Уровни инсулина через 0, 30, 60, 120 и 150 минут и уровни С-пептида во все моменты времени после ОГТТ оказались существенно меньше после ДР, чем исходно. Площадь под кривой для инсулина и С-пептида значимо снизилась после ДР.
Сила раннего инсулинового ответа на глюкозу, определенная по индексу инсулиногенности (9,0 ± 1,1 против 15,9 ± 2,3, р < 0,05), скорость секреции инсулина, оцененная с помощью теста на стимуляцию глюкагоном, ΔC-пептида (от 1,19 до 0,68 нмоль/л) также значительно уменьшились после операции. Концентрации С-пептида через 0 и 5 минут были значимо ниже после ДР, чем до нее.
Сравнение групп пациентов после панкреатодуоденальной и дистальной резекции
Изменения в метаболической, эндокринной и экзокринной функциях после различных вариантов резекции кратко представлены на рисунке 4.
Рис. 4. Изменения в метаболической, эндокринной и экзокринной функциях после панкреатодуоденальной (ПДР) и дистальной (ДР) резекции поджелудочной железы[36]
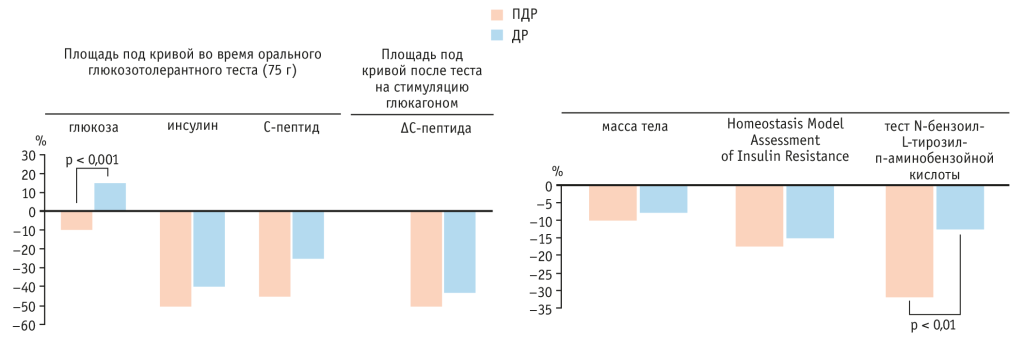
Уровни глюкозы в крови понизились в группе ПДР и увеличились в группе ДР (площадь под кривой во время ОГТТ была –9,3% против +16,8%, p < 0,001). Скорость секреции инсулина, оцениваемая по приросту концентраций инсулина и С-пептида во время ОГТТ и уровня С-пептида после теста со стимуляцией глюкагоном, одинаково снижалась в обеих группах; масса тела и резистентность к инсулину, определенная по HOMA-IR, также уменьшились сходным образом в группах.
Экзокринная функция, оцененная с помощью теста BT-PABA, ухудшилась в обеих группах, но более выраженно в группе ПДР, чем в группе ДР (–32% против –12%, p < 0,01).
Изменения площади под кривой для содержания глюкозы в крови в ходе ОГТТ после операции были классифицированы как: 1) заметное ухудшение (увеличение на ≥ 10%), 2) умеренное ухудшение (увеличение на < 10%), 3) умеренное улучшение (снижение на < 10%) и 4) заметное улучшение (снижение на ≥ 10%).
В общей сложности у 43,8% (32/73) пациентов имело место заметное улучшение после ПДР против 8,3% (3/36) наблюдавшихся после ДР (рис. 5). Однако у 50% (18/36) пациентов произошло заметное ухудшение после ДР против 15,1% (11/73) больных после ПДР (см. рис. 5). Это показывает, что у большинства пациентов после ПДР улучшилось состояние углеводного обмена, тогда как после ДР, как правило, наблюдалось ухудшение гликемического контроля (р < 0,001, критерий χ2).
Рис. 5. Динамика углеводного обмена у пациентов после панкреатодуоденальной (ПДР) и дистальной резекции (ДР) поджелудочной железы[36]
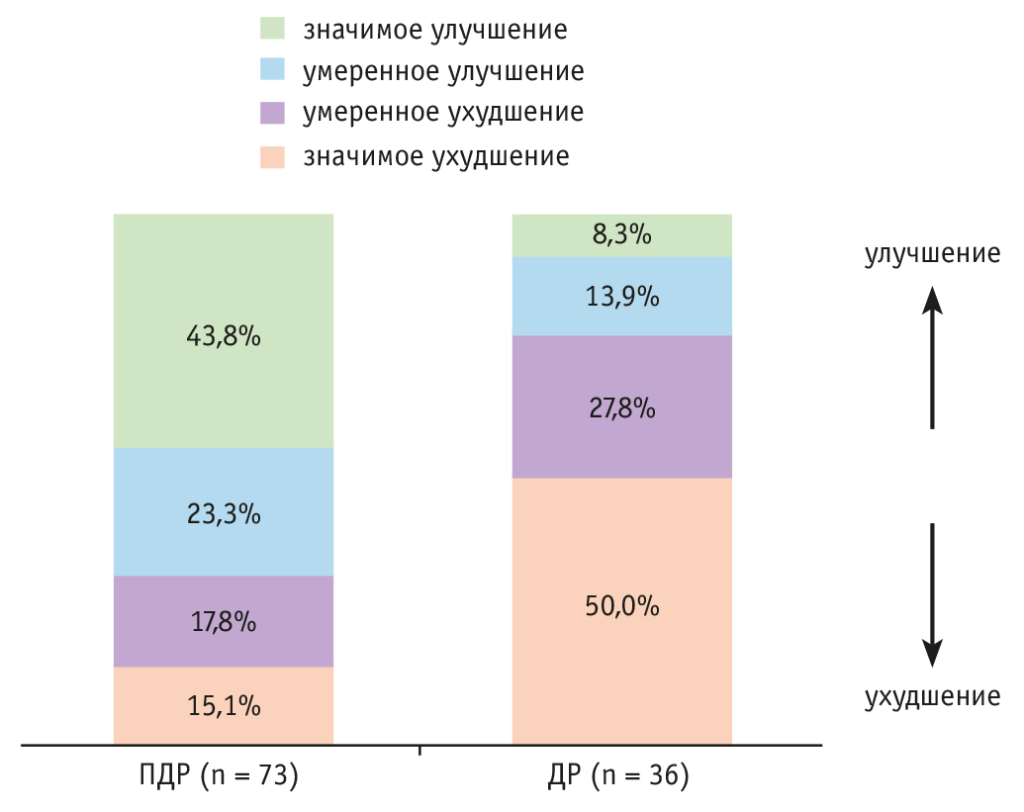
Данное исследование демонстрирует, что изменения, связанные с метаболизмом глюкозы, наблюдаемые после резекции ПЖ, заметно различаются в группах ПДР и ДР, при этом после ПДР зачастую улучшается толерантность к глюкозе.
Уменьшение скорости секреции инсулина в ответ как на пероральное введение глюкозы, так и на внутривенное введение глюкагона было аналогичным в группах ПДР и ДР. Степень чувствительности к инсулину, оцененная по HOMA-IR, также оказалась сходной, и это позволяет предположить, что наблюдаемые различия в скорости метаболизма глюкозы между группами ПДР и ДР обусловлены факторами, отличными от секреции инсулина и чувствительности к нему.
Одним из возможных механизмов является связь между экзокринной функцией ПЖ и нутритивным статусом. Экзокринная функция ПЖ пациентов, определенная с помощью теста BT-ПАБА, различалась в группах ПДР и ДР, причем после ПДР она снизилась значительно сильнее, чем после ДР, что согласуется с литературными данными[38].
Необходимо еще раз подчеркнуть, что при ПДР проводится реконструкция анатомии, при которой осуществляется либо панкреатогастростомия, либо панкреатоеюностомия. Все пациенты в описанном исследовании[36] перенесли панкреатогастростомию; следовательно, кислая среда в желудке, возможно, денатурировала секретируемые ферменты ПЖ, что привело к более выраженной экзокринной недостаточности в группе ПДР, чем после ДР.
Е.А. Bock и соавт. еще в 2012 году[29] сообщили, что у 52,8% пациентов, перенесших ПДР с панкреатогастростомией, развилась экзокринная недостаточность с симптоматической стеатореей, и, следовательно, потребовалась ферментная терапия.
В исследовании[36] 18 (24,7%) пациентам после ПДР и 8 (22,2%) после ДР потребовалась заместительная ферментная терапия. Тест BT-PABA оценивает активность химотрипсина, отражающую эффективность экзокринной функции в отношении переваривания белков[39], однако его результаты могут показывать и экзокринную недостаточность в целом, включая углеводы.
Масса тела и ИМТ в работе[36] были сопоставимыми у больных обеих групп, и это позволяет предположить, что нутритивный статус может не вносить существенный вклад в различия, связанные с толерантностью к глюкозе. Различия в экзокринной функции, однако, могут влиять на состав тела, особенно на долю мышечной и жировой ткани, что приводит к различиям в показателях резистентности к инсулину и толерантности к глюкозе. Хотя сходство значений HOMA-IR, вероятно, свидетельствует, что участники групп ПДР и ДР имели схожую чувствительность всего организма к инсулину, необходимы дальнейшие исследования для оценки изменений в составе тела пациентов после резекционных операций.
Поскольку все пациенты группы ПДР в исследовании[36] перенесли субтотальную кПДР, повышение секреции ГПП-1 в сочетании с измененным опорожнением желудка может быть одной из причин улучшения толерантности к глюкозе, наблюдаемого после ПДР[24].
У этой работы, тем не менее, есть очень существенное ограничение: в нее включены пациенты, оперированные незадолго (менее месяца) до включения в исследование[36].
В более раннем исследовании R.A. Burkhart и соавт. оценены исходы у 190 пациентов, не имевших до операции СД: 135 пациентам проведена ПДР, а 55 — ДР. Уровень HbA1c до операции не различался у пациентов обеих групп и составил 5,7% в первой и 5,8% во второй (р = 0,372). Около 10% участников каждой группы имели семейный анамнез СД у родственников первой степени родства. После операции СД возникал чаще в группе ДР (31%), чем в группе ПДР (18%), хотя различие не достигло статистической значимости (p = 0,053).
СД после ДР развивался раньше (медиана — 6 мес., 0–60 мес.), чем после ПДР (медиана — 9 мес., 0–64 мес.).
При анализе долгосрочных исходов впервые выявленный диабет через 3 года после ДР диагностировали у 35% пациентов, а через 5 лет — у 43%, у больных после ПДР — 16% через 3 года и 18% через 5 лет (p = 0,04).
При анализе лекарственной терапии выяснилось, что только 7% участников группы ПДР и 4% в группе ДР нуждались в инсулинотерапии, диетотерапия применялась у 4% и 7% человек соответственно, остальные принимали пероральные сахароснижающие препараты, преимущественно метформин[28].
В крупном метаанализе 2018 года[40] оценивались исходы ПДР в про- и ретроспективых исследованиях. Из 1523 исследований, отобранных исходно, только 22 соответствовали критериям включения: выборка — более 10 человек, период наблюдения — более 3 месяцев, количество пациентов с хроническим панкреатитом — менее 10%, наличие данных об углеводном обмене и количестве пациентов, исходно имевших СД, полнотекстовые статьи (рис. 6). Обращает на себя внимание, что при, казалось бы, огромном количестве доступной для анализа литературы по теме качество ее не позволяет рассматривать имеющиеся результаты как достоверные.
Рис. 6. Метод формирования выборки в метаанализе[40]
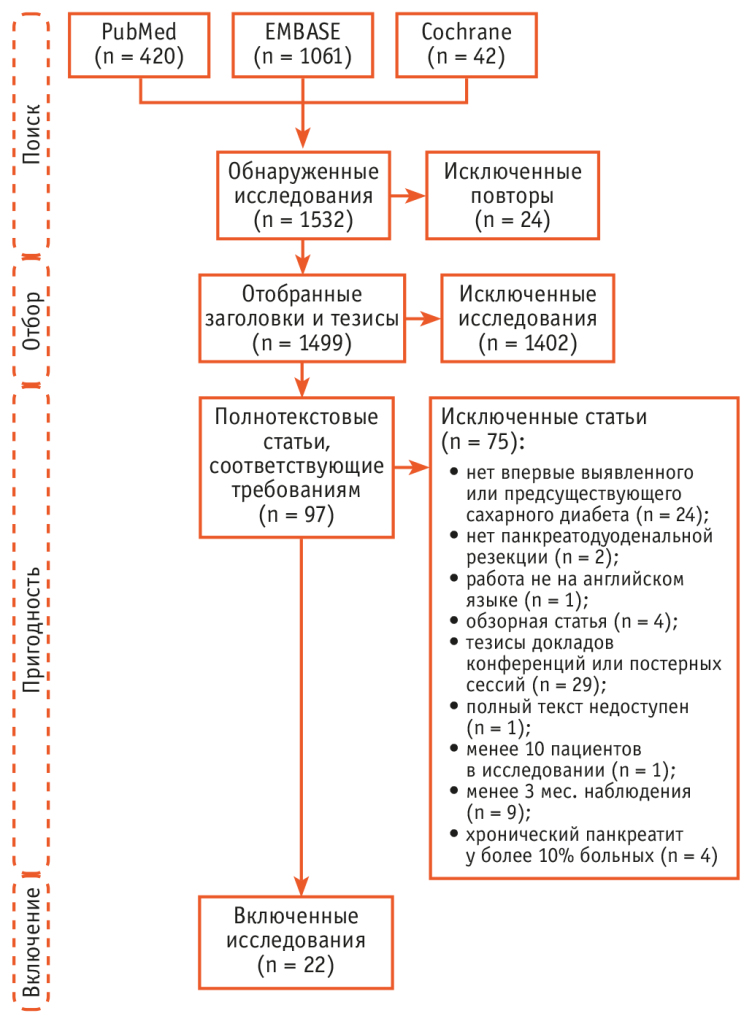
Пациенты с СД, выявленным до операции, были исключены из исследования, данные о пациентах с пре- и послеоперационным СД извлечены из каждого исследования, объединены и проанализированы.
ОПРЕДЕЛЕНИЕ САХАРНОГО ДИАБЕТА
Дефиниции СД варьировали в разных работах. Применение инсулина и пероральных препаратов использовалось в качестве определения в пяти исследованиях; в трех — оно же, но в сочетании с уровнями глюкозы в крови натощак и/или HbA1c. В одном исследовании сообщалось о пероральном тесте на толерантность к глюкозе; в пяти статьях этот критерий сочетался с определением концентрации глюкозы в крови натощак, тогда как в двух исследованиях использовались только концентрации глюкозы в крови натощак, в четырех работах — уровни HbA1c, в двух — все эти критерии диагностики СД.
Средневзвешенный период наблюдения после ПДР (12 исследований) составил 3,8 ± 1,8 года. Относительный риск (ОР) во всех 22 исследованиях (n = 947) впервые возникшего СД после ПДР по любым показаниям — 16% (95% ДИ: 12–20%).
Вероятность потребности в инсулинотерапии была 6% (95% ДИ: 4–10%, 9 исследований, n = 410). ОР впервые диагностированного СД после ПДР по поводу злокачественного заболевания (11 исследований, n = 246) составил 22% (95% ДИ: 14–32%), при доброкачественных заболеваниях (6 исследований, n = 101) — 19% (95% ДИ: 17–43%). Риск развития СД статистически значимо не различался при злокачественных и доброкачественных заболеваниях (22% против 19%; р = 0,71).
Время дебюта СД зарегистрировано в 8 исследованиях и варьировало от менее 1 года до 10 лет после ПДР.
О типе ПДР (ППДР или кПДР) имелись данные в 18 исследованиях. Девять из них включали пациентов, перенесших либо ППДР, либо кПДР; в двух из этих статей сообщалось о риске впервые выявленного СД 13% против 11% и 16% против 25% при ППДР и кПДР соответственно (разница статистически незначима).
Интересно, что о применении заместительной ферментной терапии говорится в 10 исследованиях, при этом в 9 работах больным назначали заместительную ферментную терапию на основании симптомов, тогда как в одном исследовании она была начата рутинно. Обращает на себя внимание, что в обзоре нет акцента на дозах полиферментных препаратов. Нельзя исключить, что недостаточная доза ферментов или их отсутствие могли повлиять на полученные результаты.
ВОЗРАСТ
В исследовательском линейном анализе связь среднего/медианного возраста пациента с риском развития СД отсутствовала (р = 0,66). Таким образом, возраст не является определяющим фактором риска развития СД в исходе оперативных вмешательств на ПЖ.
РАСЧЕТНАЯ ОЦЕНКА РИСКА ВПЕРВЫЕ ВЫЯВЛЕННОГО САХАРНОГО ДИАБЕТА У ПАЦИЕНТОВ ПОСЛЕ ПАНКРЕАТОДУОДЕНАЛЬНОЙ РЕЗЕКЦИИ
При исключении 6 исследований (n = 267), в которых участвовали пациенты с хроническим панкреатитом, совокупный риск впервые выявленного СД составил 13% (95% ДИ: 9–18%).
При вторичном анализе чувствительности, включившем исследования, в которых использован ОГТТ в качестве критерия диагностики, риск впервые обнаруженного СД — 12% (95% ДИ: 6–25%), что немного меньше, чем в основном анализе. В третьем анализе, исключавшем ретроспективные исследования, риск впервые выявленного СД составил 14% (95% ДИ: 11–18%). В четвертом анализе, из которого исключили работы продолжительностью менее года, риск впервые выявленного СД — 16% (95% ДИ: 12–21%). Поскольку ДИ были перекрывающимися, эти результаты сопоставимы с данными основного анализа.
Риск впервые возникшего СД не различался у больных после ПДР, выполненной по поводу злокачественного и незлокачественного заболевания, после исключения лиц с хроническим панкреатитом. В предыдущих исследованиях сообщалось о нескольких факторах риска развития впервые выявленного СД после ПДР. К ним относятся предоперационные аномальные уровни HbA1c[41]; ПДР, выполненная в более молодом возрасте[42]; предоперационный повышенный уровень глюкозы натощак; реконструкция с панкреатогастростомией[43] и атрофия остаточной ПЖ толщиной менее 50% от предоперационного значения[44]. Установлено также, что хронический панкреатит сам по себе является фактором риска СД (отношение шансов = 1,4)[45].
В обзоре[40] общий риск впервые выявленного СД довольно схож после ПДР и ДР. Риск потребности в инсулинотерапии, однако, значительно выше после ДР, чем ПДР (11% против 6%, р = 0,02). Впервые диагностированный СД ассоциируется со снижением качества жизни после резекционных операций. Высказано предположение, что оно вернется к дооперационному уровню в течение 1 года после операции, что связано с психологическими механизмами преодоления[40].
В проспективном одноцентровом обсервационном исследовании 2021 года J. Ishida и соавт.[46] проанализировали результаты обследования 40 пациентов, перенесших ПДР, и 29 больных, перенесших ДР. Толерантность к глюкозе, включая секрецию инсулина (уровень иммунореактивного C-пептида и его динамику) и резистентность к инсулину (оцененная на модели гомеостаза HOMA-IR), определяли до и через 1 месяц после операции с использованием ОГТТ и теста на стимуляцию глюкагоном. Оценивали также долгосрочные уровни HbA1c у пациентов со сроком наблюдения 3 года. Полученные результаты представлены на рисунках 7 и 8.
Рис. 7. Количество пациентов с нормальными, пограничными результатами перорального теста на толерантность к глюкозе и отклонением от нормы до и через месяц после панкреатодуоденальной (ПДР) и дистальной резекции (ДР) поджелудочной железы[46]
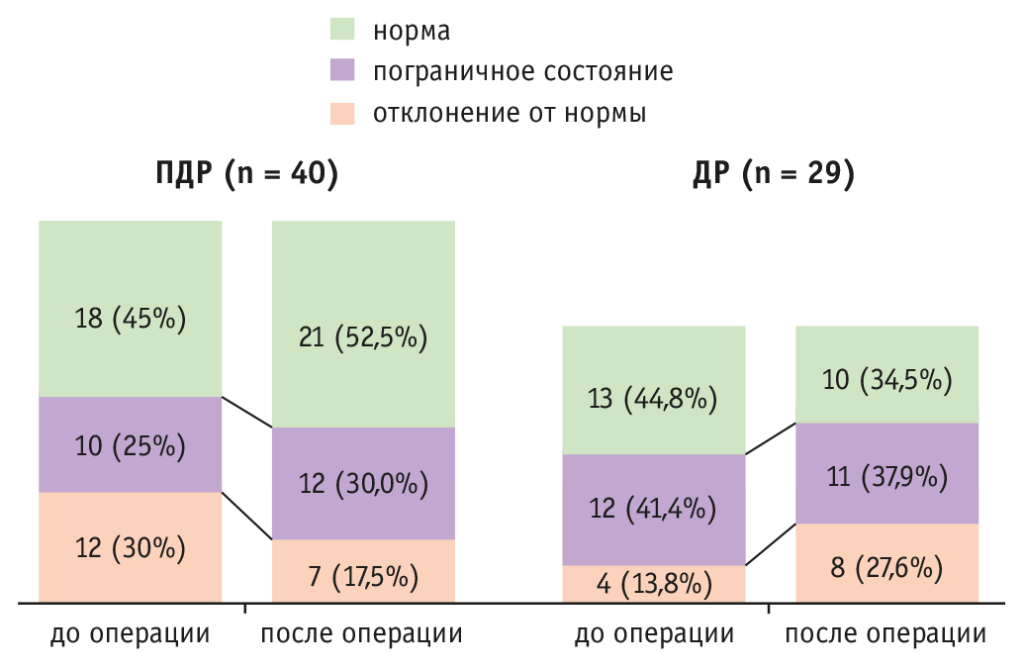
Рис. 8. Результаты обследования пациентов через месяц после панкреатодуоденальной (ПДР) и дистальной резекции (ДР) поджелудочной железы[46]

На рисунке 8 приведены данные обследования пациентов через месяц после операции. Толерантность к глюкозе улучшилась после ПДР, тогда как после ДР она ухудшилась. Секреция инсулина снижалась как после ПДР, так и после ДР. Резистентность к инсулину улучшилась после ПДР, но не изменилась после ДР.
Количество пациентов с аномальным результатом ОГТТ снизилось после ПДР (с 12 (30%) до 7 (17,5%) из 40, р = 0,096); однако после ДР таких больных стало больше (с 4 (13,8%) до 8 (27,6%) из 29, р = 0,103), хотя изменения не были статистически значимыми. ΔC-пептида уменьшилась как после ПДР (с 3,2 до 1,0 нг/мл, р < 0,001), так и после ДР (с 3,3 до 1,8 нг/мл, р < 0,001). HOMA-IR понизился после ПДР (с 1,10 до 0,68, р < 0,001), но не изменился после ДР (1,10 и 1,07, р = 0,42).
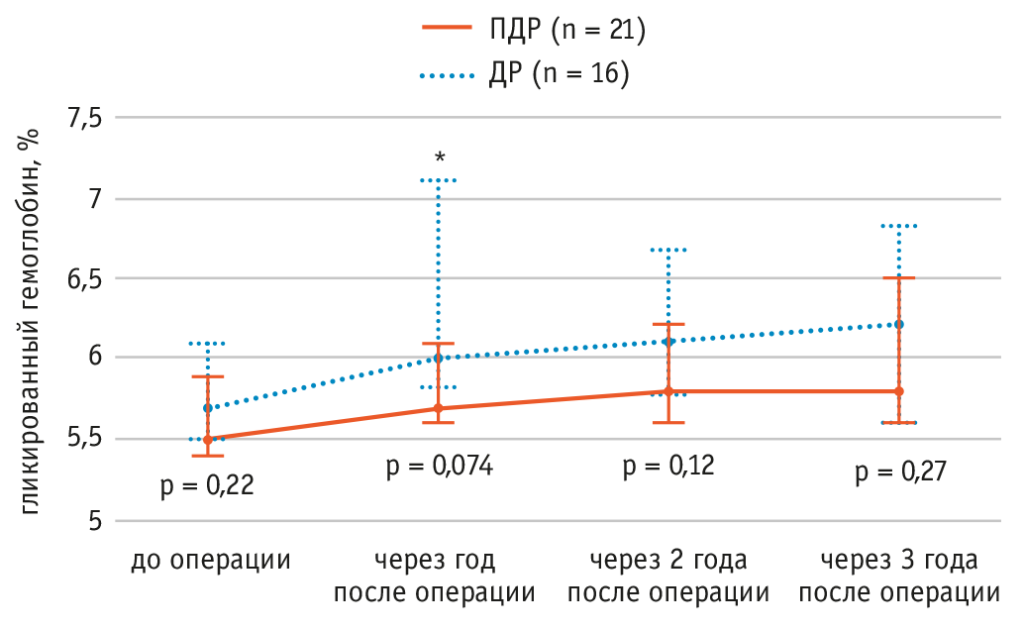
При 3-летнем наблюдении за пациентами и оценке показателей HbA1c в динамике выявлено (рис. 9), что медианный уровень HbA1c был выше после ДР, чем после ПДР, но различия не были статистически значимыми[46].
Рис. 9. Изменения уровня гликированного гемоглобина у пациентов после панкреатодуоденэктомии (ПДР) и дистальной резекции (ДР) поджелудочной железы при 3-летнем наблюдением (медианы). Столбики ошибок указывают межквартильные диапазоны в каждой точке.
Примечание. * Данные отсутствовали у одного пациента из группы ДР
ЗАКЛЮЧЕНИЕ
При анализе литературы отчетливо видно, что проблема метаболических исходов ПДР и ДР активно изучается и представляет большой интерес. Большинство исследований сосредоточены на частоте и сроках дебюта СД, а также механизмах нарушений углеводного обмена. Хотя между исследованиями есть некоторые различия, связанные с их дизайном, очевидно, что, несмотря на примерно равный объем резецированной ткани, при ДР чаще и раньше возникает СД, при ПДР же возможна ремиссия ранее существовавшего диабета у значительного числа больных. Основной причиной считают улучшение секреции ГПП-1 при кПДР, хотя механизмы, связанные с экзокринной недостаточностью, также рассматриваются.
Худшие исходы при ДР могут быть связаны и с неравномерным распределением панкреатических островков в ткани железы. Площадь, занимаемая островками в хвосте, примерно в 2 раза больше, чем в головке, соответственно, количество островков и β-клеток тоже больше. Такое неравномерное распределение, возможно, объясняется различным эмбриональным происхождением: островки дистальной части ПЖ происходят из дорсального зачатка, головки — из вентрального. Островки, происходящие из дорсального зачатка, относительно больше по размеру с характерным смешанным расположением α- и β-клеток и обладают более высокой способностью секретировать инсулин, чем островки, происходящие из вентрального зачатка. В экспериментах на животных показано, что способность островков из дорсального зачатка к секреции инсулина значительно выше даже при более низкой концентрации глюкозы благодаря паракринному эффекту[47]. Таким образом, описано не менее двух причин лучшего углеводного обмена у пациентов после кПДР — сохранение большей части эффективных островков и улучшение секреции ГПП-1.
В отношении экзокринной функции ситуация обратная — после ПДР вероятность развития экзокринной недостаточности ПЖ выше, чем после ДР.
Тем не менее обращает на себя внимание, что параллельная оценка экзо- и эндокринной функций у таких пациентов проводится редко, большинство авторов изучают эндокринную функцию. Но функции эти тесно взаимосвязаны и должны оцениваться и корректироваться параллельно.
Нельзя не заметить, что вопросы сахароснижающей и заместительной ферментной терапии вообще не затронуты в исследованиях, и связано это с тем, что бо’льшая часть работ выполнена хирургами.
Итак, очевидно, что существует насущная необходимость в разработке подходов к раннему назначению комбинированной терапии данной категории больных с акцентом на одновременную коррекцию экзо- и эндокринной функций ПЖ.
Поступила: 23.01.2024
Принята к публикации: 19.02.2024








