По данным Федерального регистра сахарного диабета, в нашей стране 4,8 млн больных СД 2 типа, и только около двух третей из них принимают рекомендованную им сахароснижающую терапию1. На сегодняшний день более 90% врачей, по данным российского Федерального регистра сахарного диабета, при назначении двухкомпонентной сахароснижающей терапии предпочтение отдают комбинации метформина и препаратов сульфонилмочевины (ПСМ). Данный выбор обусловлен длительным опытом их использования, высокой эффективностью и низкой стоимостью.
В классе ПСМ существует несколько поколений препаратов. К первому относятся толбутамид, карбутамид и др., которые не применяются с 1998 года, ко второму поколению — глибенкламид, глипизид, гликлазид, гликвидон, к третьему — глимепирид. Действие препаратов заключается в основном в стимуляции β-клеток поджелудочной железы, что сопровождается усилением синтеза и выброса инсулина. Для проявления эффекта ПСМ необходимо наличие достаточного количества функционирующих β-клеток. Помимо непосредственно сахароснижающего, некоторые ПСМ оказывают и внепанкреатическое действие (усиление чувствительности тканей к инсулину, снижение синтеза глюкозы печенью). Подобные эффекты наиболее выражены у третьей генерации ПСМ и обусловлены увеличением количества инсулин-чувствительных рецепторов в клетках-мишенях.
ПСМ имеют различные выраженность сахароснижающего эффекта и длительность действия. Они различаются между собой как фармакокинетикой, так и фармакодинамикой, что объясняет внутригрупповую неоднородность препаратов. Так, например, выраженность сахароснижающего эффекта глимепирида дозозависима.
В НИИ фармакологии и регенеративной медицины им. Е.Д. Гольдберга в 2016 году было проведено открытое рандомизированное перекрестное исследование сравнительной фармакокинетики и биоэквивалентности препаратов Глимепирид Канон 4 мг и Амарил 4 мг (рис. 1, 2), по результатам которого получены нижеследующие данные[1].
- Максимальная концентрация активного вещества глимепирида при пероральном применении обоих препаратов достигается через 2–2,5 часа после приема.
- Последующее снижение концентрации имеет экспоненциальный характер со временем половинного убывания порядка 8,7 часа.
- Сравнение фармакокинетики отечественного и зарубежного препаратов показало, что их фармакокинетические показатели существенно не различаются. По критериям, оговоренным в методических рекомендациях по проведению сравнительных исследований биоэквивалентности лекарственных средств, препараты являются биоэквивалентными.
Рис. 1. Усредненная динамика концентрации глимепирида в плазме крови после приема препаратов Глимепирид Канон и Амарил в линейных координатах
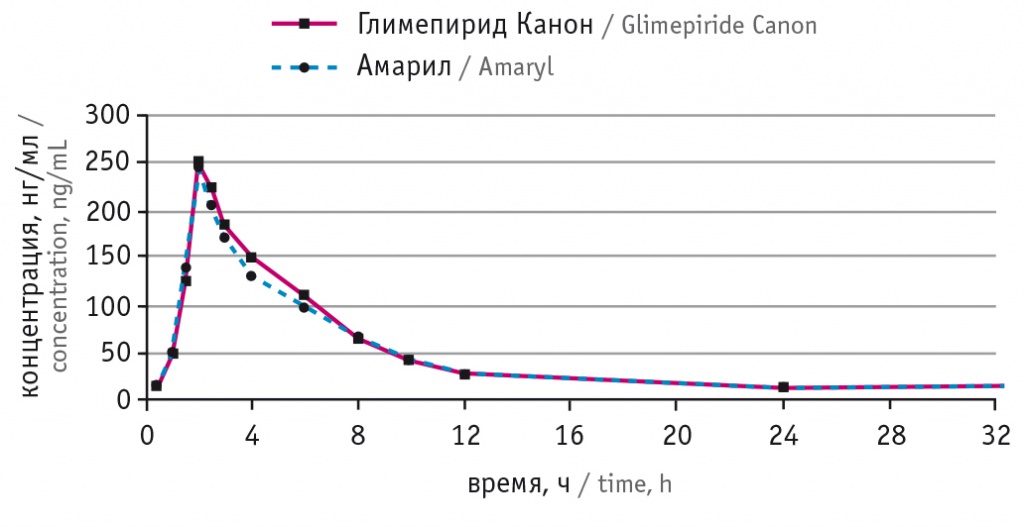
Рис. 2. Усредненная динамика концентрации глимепирида в плазме крови после приема препаратов Глимепирид Канон и Амарил в полулогарифмических координатах
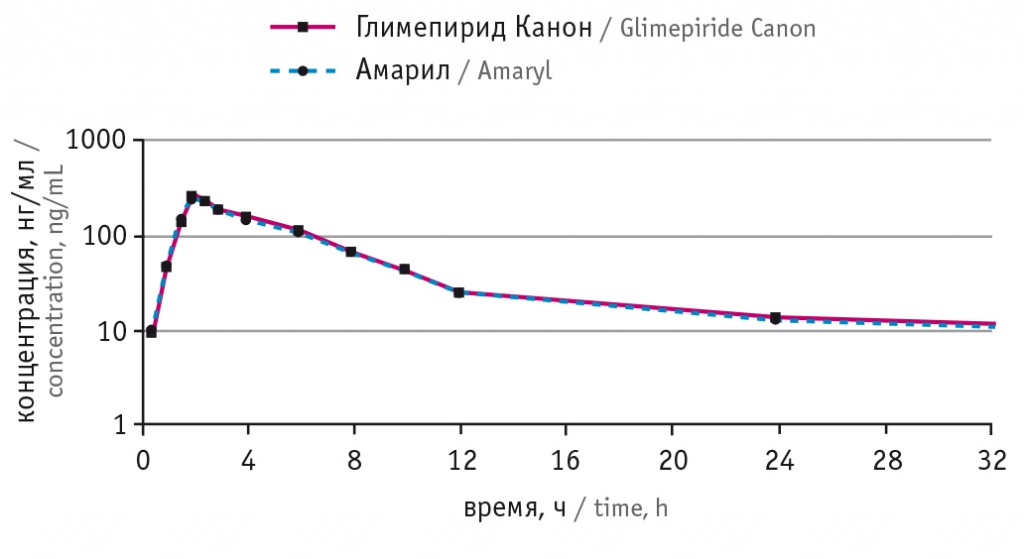
Их биоэквивалентность при высокой сахароснижающией активности и низком риске гипогликемий позволяет широко использовать оба препарата в реальной клинической практике.
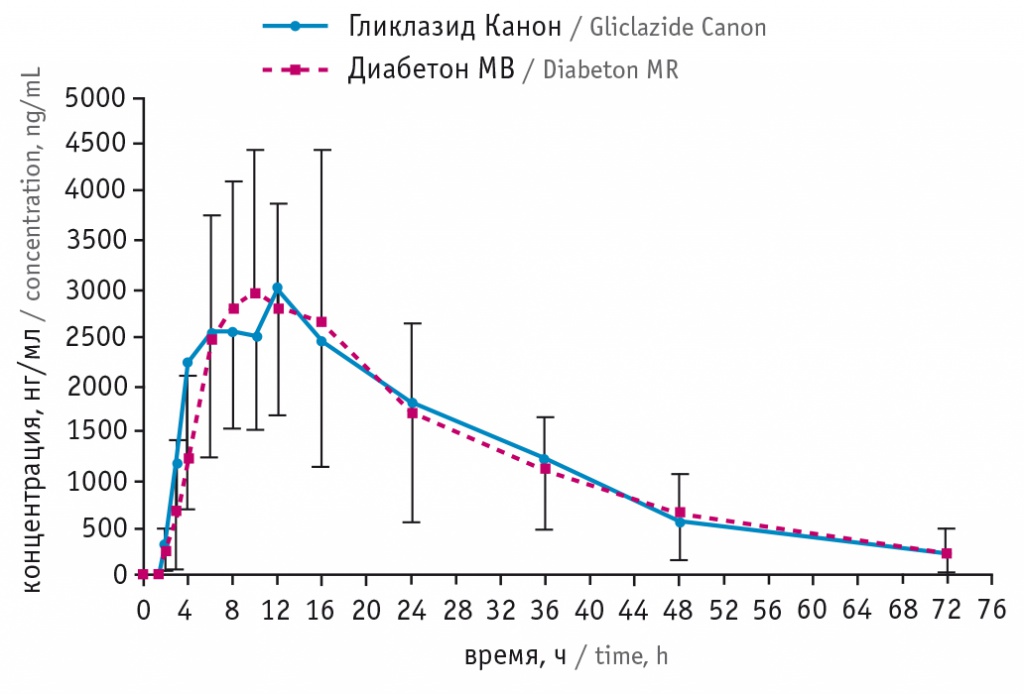
Кроме того, в НИИ фармакологии и регенеративной медицины им. Е.Д. Гольдберга проводились исследования фармакологической биоэквивалентности Гликлазида Канон и Диабетона МВ (препараты гликлазида — представителя второго поколения) (рис. 3). Они показали достаточную сопоставимость сравниваемых кривых.
Рис. 3. Средние значения концентрации гликлазида во времени в нелинейных координатах после однократного приема Гликлазида Канон и Диабетона МВ
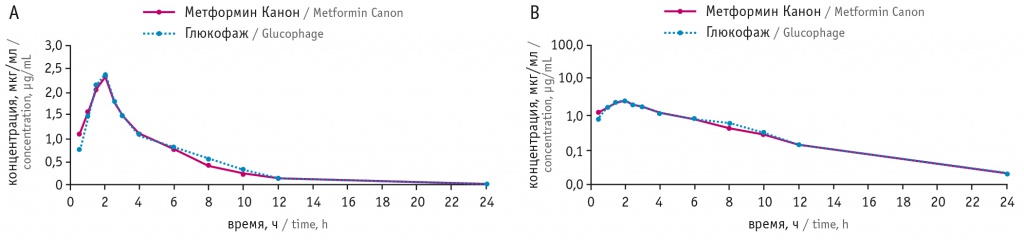
Следующей парой стали Метформин Канон 1000 мг в лекарственной форме таблеток, покрытых пленочной оболочкой, и препарат сравнения Глюкофаж 1000 мг (рис. 4). На рисунке 4 продемонстрированы сопоставимые результаты по динамике концентрации метформина в плазме крови после приема сравниваемых препаратов.
Рис. 4. Усредненная динамика концентрации метформина в плазме крови после приема препаратов Метформин Канон и Глюкофаж: А — в линейных координатах, В — в полулогарифмических координатах
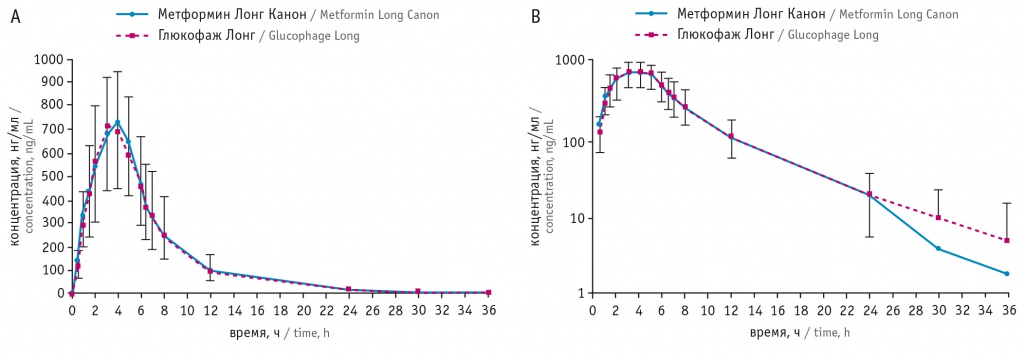
На рисунке 5 представлены данные сравнительного исследования биоэквивалентности Метформина Лонг Канон и Глюкофажа Лонг в дозировке 750 мг. Из них можно сделать вывод о сходной динамике концентрации препаратов.
Рис. 5. Усредненная динамика концентрации метформина с пролонгированным действием, немодифицированным высвобождением в плазме крови после приема препаратов Метформин Лонг Канон и Глюкофаж Лонг: А — в линейных координатах, В — в полулогарифмических координатах
Известно, что наиболее частая комбинация сахароснижающих лекарственных средств — сочетание ПСМ и метформина.
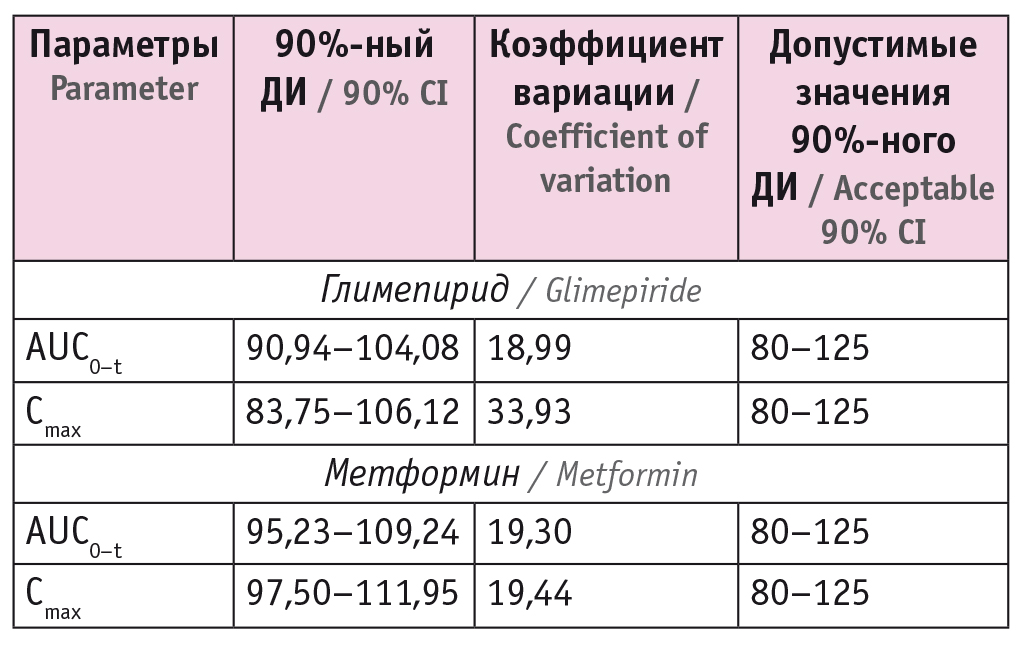
При проведении проспективного открытого рандомизированного сравнительного исследования фармакокинетики и биоэквивалентности лекарственных препаратов Глидика М и Амарил М (глимепирид 2 мг + метформин 500 мг) у здоровых добровольцев с однократным приемом натощак получены данные, свидетельствующие о благоприятном профиле безопасности обоих препаратов и их биоэквивалентности (табл.).
Таблица
Результаты оценки биоэквивалентности, 90%-ные доверительные интервалы (ДИ) для отношений средних геометрических значений параметров AUC0–t и Сmax Глидика М/Амарил М, %
Таким образом, НИИ фармакологии и регенеративной медицины им. Е.Д. Гольдберга представил нам несколько исследований, оценивающих биоэквивалентность оригинальных препаратов и их дженериков, по результатам которых мы можем предполагать их сопоставимую эффективность.
Благодаря низкой стоимости и высокой эффективности ПСМ очень часто назначаются диабетологами всего мира. Но на сегодняшний день на первый план выходит безопасность проводимой терапии, и ниже мы приводим данные метаанализа, полученные профессором Скоттом Симпсоном и его коллегами, опубликованные в журнале The Lancet: Diabetes and Endocrinology в 2015 году[2]. Они свидетельствует о крайней разнородности влияния препаратов из группы ПСМ на смертность от любых причин (рис. 6).
Рис. 6. Сравнение всех случаев смерти, связанных с приемом различных препаратов сульфонилмочевины, с использованием прямых и косвенных доказательств
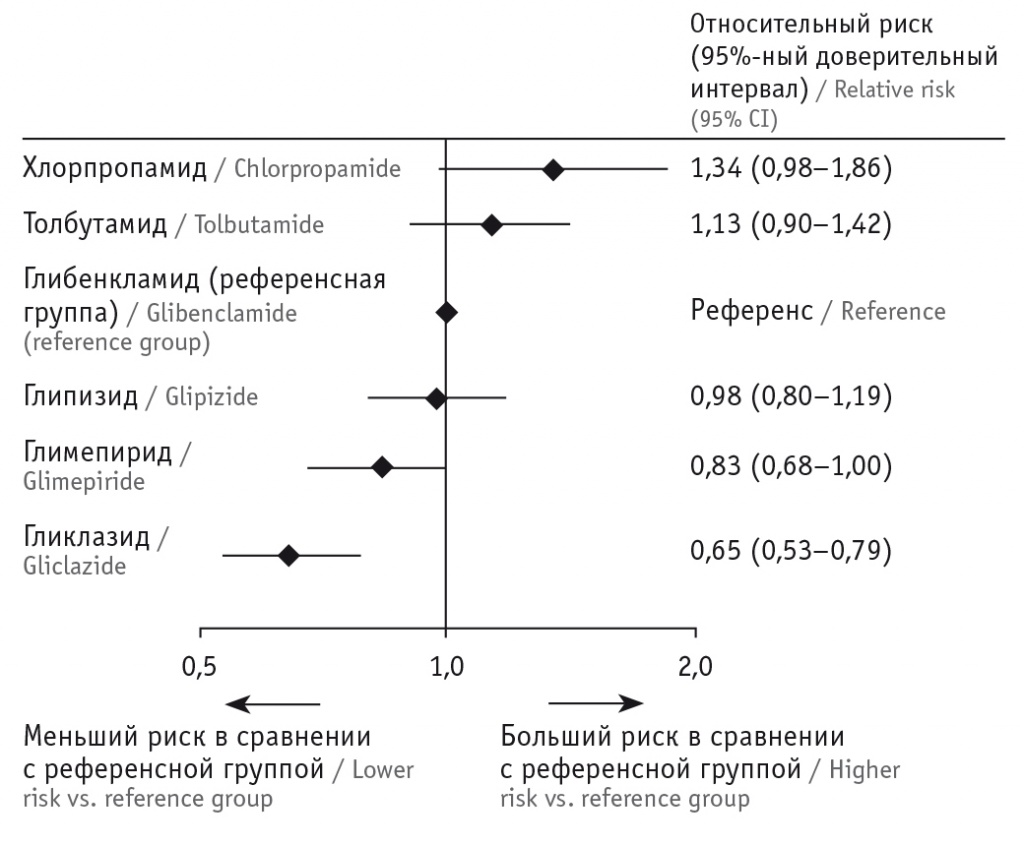
В метаанализ включены 18 исследований: 167 327 пациентов, принимавших ПСМ[2]. Из них 9% (14 970 человек) умерли по каким-либо причинам, и проводился анализ влияния принимаемых ими препаратов на исход. Использование гликлазида, глимепирида было связано со значимо более низким риском смерти по сравнению с таковым в референсной группе глибенкламида, в то время как прием глипизида сопровождался аналогичным риском.
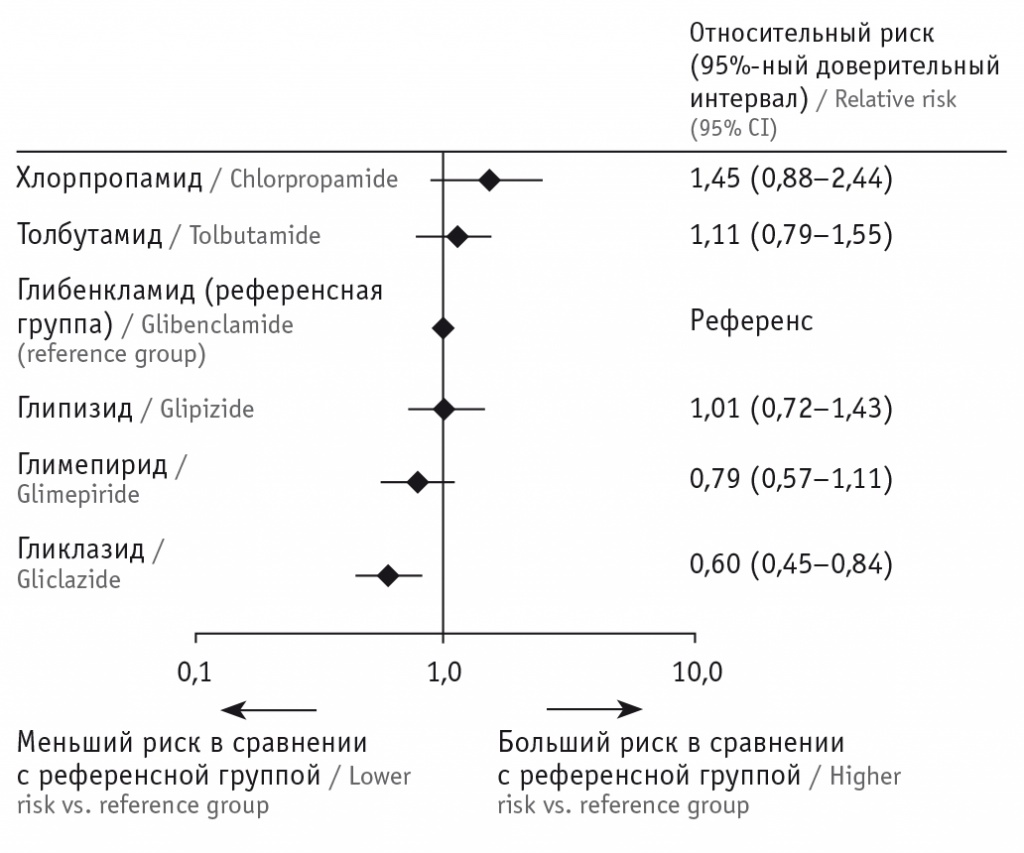
В этом же метаанализе изучали зависимость риска смерти от сердечно-сосудистых причин от вида ПСМ, которые принимали пациенты. Однако в эту часть исследования вошли только 13 работ: 5% смертей среди 145 916 больных, применявших ПСМ. И здесь получены схожие с результаты (рис. 7).
Рис. 7. Сравнение риска смерти от сердечно-сосудистых причин у пациентов, принимавших различные препараты сульфонилмочевины
Активация митохондриальных КАТФ-каналов играет решающую роль в механической защите сердца, которая является результатом ишемического прекондиционирования. И если ПСМ первого поколения, взаимодействуя с митохондриальными КАТФ-каналами, не осуществляют кардиопротекцию при ишемии, то второе и третье поколение ПСМ эту кардиопротекцию реализуют[3].
При исследовании смертности от всех причин у пациентов с наличием как сердечно-сосудистых заболеваний, так и заболеваний печени (неалкогольного цирроза) получены данные, свидетельствующие о меньших рисках неблагоприятных исходов у больных, принимающих ПСМ (рис. 8). Использование глимепирида и гликлазида ассоциировано с более низкими рисками смерти и сердечно-сосудистых событий, чем прием глибекламида и глипизида (см. рис. 6, 7)[4].
Рис. 8. А — кумулятивные кривые, ассоциированные со смертностью от всех причин; В — кумулятивные кривые заболеваемости со смертностью от МАСЕ
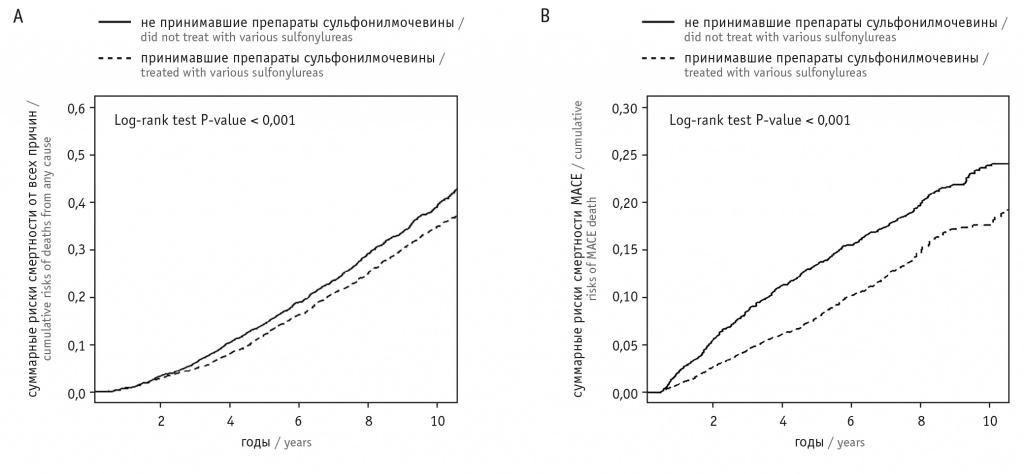
Исследование F.-S. Yen и соавт. показало, что использование ПСМ у пациентов с циррозом печени и СД 2 типа связано с более низким риском всевозможной смертности, чем их неиспользование. Авторы выявили, что прием ПСМ сопровождается меньшим риском развития сердечно-сосудистых заболеваний, потенциально уменьшается и риск цирротической декомпенсации.
Однако следует помнить, что метаболизм большинства ПСМ осуществляется печенью, поэтому если при компенсированном циррозе печени их применение возможно, то при декомпенсации и выраженном нарушении функции печени ПСМ не рекомендованы.
Влияние на почечную функцию имеет свои особенности у каждого препарата данной группы.
Впервые около 50 лет назад было показано, что у пациентов с СД 2 типа происходит увеличение экскреции альбумина. При дальнейших исследованиях выяснилось, что альбуминурия является предиктором развития как диабетической, так и недиабетической болезни почек. В настоящее время известно, что низкий уровень альбуминурии, соотношение альбумина и креатинина менее 3 мг/ммоль ассоциированы с меньшим риском гипертонии и смерти от сердечно-сосудистых заболеваний[2]. Прием ПСМ предотвращает развитие и снижение альбуминурии за счет протективного влияния непосредственно на сам клубочек почки[5].
При этом стоит помнить, что использование глибенкламида не рекомендовано при скорости клубочковой фильтрации (СКФ) менее 60 мл/мин/1,73 м2. Это отличает его от остальных представителей ПСМ, применение которых возможно при хронической болезни почек (ХБП) вплоть до стадии 3б, когда СКФ уменьшается до 30 мл/мин/1,73 м2. С прогрессированием ХБП снижается клиренс сахароснижающих препаратов, поэтому в таких ситуациях может потребоваться коррекция дозы ПСМ, чтобы избежать возможной гипогликемии.
ЗАКЛЮЧЕНИЕ
Большой выбор доступных в настоящее время препаратов позволяет врачу подобрать оптимальные сахароснижающие схемы с учетом индивидуальных особенностей пациента. Современные комбинированные препараты являются терапией выбора для большинства больных СД. Стоимость также оказывает влияние на выбор сахароснижающих средств. Главное, чтобы используемые препараты были хорошо изучены, эффективны и безопасны.
Поступила: 16.04.2021
Принята к публикации: 27.04.2021
________
1 Федеральный регистр больных сахарным диабетом. URL: http://sd.diaregistry.ru/ (дата обращения — 15.02.2021).








