Распространенность СД во всем мире постоянно растет. По данным Международной диабетической федерации, численность больных СД в мире за последние 10 лет увеличилась более чем в 2 раза и к концу 2019 года достигла 463 млн. По прогнозам экспертов, к 2045 году СД будет у более 700 млн человек1.
По данным Федерального регистра СД, в РФ на 01.01.2020 г. на диспансерном учете состояли 5,1 млн больных (3,1% населения), из них 4,7 млн (92%) — с СД 2 типа[1].
При СД 2 типа нарушения углеводного обмена вызываются преимущественно инсулинорезистентностью с относительной инсулиновой недостаточностью либо преимущественно нарушением секреции инсулина с инсулинорезистентностью или без нее. Именно эти нарушения являются основными в патогенезе СД 2 типа.
В последние годы выявлены новые механизмы прогрессирования гипергликемии, такие как нарушение продукции инкретинов в ЖКТ, увеличение секреции глюкагона α-клетками поджелудочной железы, дисфункция нейротрансмиттеров, повышение реабсорбции глюкозы в проксимальных почечных канальцах[2–4].
С учетом патогенетических механизмов, лежащих в основе развития заболевания, и его высокой распространенности следует уделять особое внимание вопросам эффективности терапии пациентов с СД 2 типа.
Цели лечения СД 2 типа: достижение хорошего метаболического контроля по показателям углеводного обмена, липидного спектра крови и АД, предупреждение острых осложнений, таких как гипогликемия, гипергликемия; предупреждение или замедление развития поздних сердечно-сосудистых осложнений[5].
В исследовании United Kingdom Prospective Diabetes Study (UKPDS) показано, что снижение уровня гликированного гемоглобина (НbА1с) на 0,9% (с 7,9 до 7%) приводило к уменьшению частоты сосудистых осложнений. Дополнительный анализ результатов UKPDS выявил, что снижение содержания НbА1с на 1% приводит к уменьшению риска фатального и нефатального инфаркта миокарда на 14%, а фатального и нефатального инсульта — на 12%[6, 7].
Уровень НbА1с применяется во всем мире в качестве критерия оценки адекватности сахароснижающей терапии. На основании данных многоцентровых рандомизированных клинических исследований, таких как ACCORD, ADVANCE, VADT, для большинства пациентов с СД 2 типа рекомендовано достижение целевого уровня НbА1с < 7%[8, 9].
В настоящее время выработана общая стратегия лечения СД 2 типа[10] (рис. 1).
Рис. 1. Стратификация лечебной тактики в зависимости от уровня гликированного гемоглобина (НbА1с) в дебюте сахарного диабета (СД) 2 типа[10]
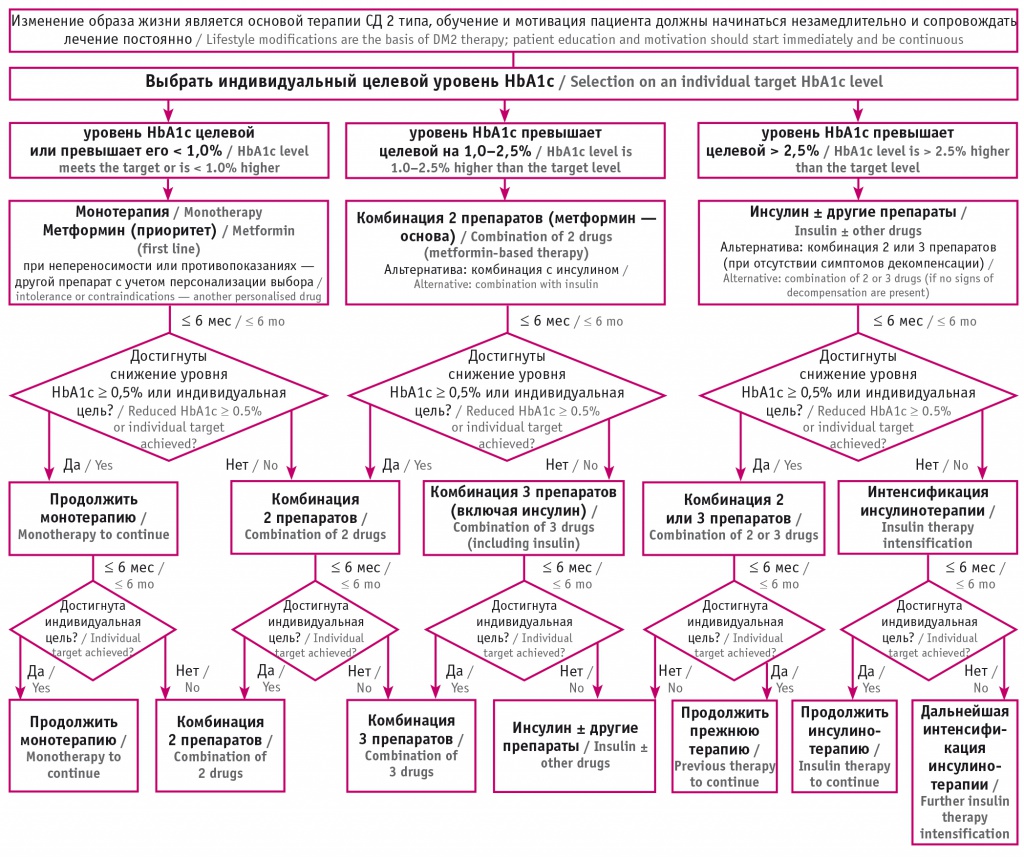
Если исходный показатель HbA1c находится в целевом диапазоне или превышает индивидуальный целевой уровень менее чем на 1,0%, то лечение можно начинать с монотерапии (препаратом первой линии является метформин при отсутствии противопоказаний). При непереносимости метформина или наличии противопоказаний к его приему могут быть назначены другие препараты с учетом рекомендаций по персонализации выбора сахароснижающих средств. На данном этапе предпочтительны препараты с низким риском гипогликемий. При непереносимости или противопоказаниях к ним возможно начало терапии с альтернативных классов сахароснижающих препаратов, таких как производные сульфонилмочевины (ПСМ) или глиниды. Эффективным считается темп снижения уровня НbA1c ≥ 0,5% за 6 месяцев наблюдения.
Если исходный показатель HbA1c превышает индивидуальный целевой уровень на 1,0–2,5%, то следует рассмотреть в качестве стартовой комбинацию двух сахароснижающих препаратов, воздействующих на разные механизмы развития гипергликемии. При использовании комбинированной терапии следует принимать во внимание ее рациональность, а также рекомендации по персонализации выбора сахароснижающих препаратов. Предпочтение следует отдавать средствам с низким риском гипогликемий. Эффективным признан темп снижения содержания НbA1c ≥ 1,0% за 6 месяцев наблюдения.
Если исходный показатель HbA1c превышает индивидуальный целевой уровень более чем на 2,5%, для уменьшения выраженной глюкозотоксичности необходимо начинать инсулинотерапию. Можно назначить комбинацию инсулина с пероральными сахароснижающими препаратами (ПССП) или монотерапию инсулином. В дальнейшем возможна отмена инсулинотерапии.
Если в дебюте заболевания исходный уровень HbA1c превышает индивидуальное значение более чем на 2,5%, но при этом отсутствуют выраженные клинические симптомы метаболической декомпенсации (прогрессирующая потеря массы тела, жажда, полиурия и др.), можно начать лечение с альтернативного варианта: комбинации 2 или 3 сахароснижающих препаратов, воздействующих на различные механизмы развития гипергликемии. При использовании комбинированной терапии следует принимать во внимание ее рациональность, а также рекомендации по персонализации выбора сахароснижающих препаратов.
ПСМ могут обеспечить быстрый сахароснижающий эффект. Ингибиторы натрий-глюкозного котранспортера 2 типа (иНГЛТ-2) уменьшают концентрацию глюкозы независимо от наличия инсулина в крови, однако не должны использоваться при состояниях с выраженной инсулиновой недостаточностью. Эффективным считается темп снижения уровня HbA1с ≥ 1,5% за 6 месяцев наблюдения[10].
В январе 2021 года опубликован обновленный Консенсус Американской диабетической ассоциации (American Diabetes Association) и Европейской ассоциации по изучению сахарного диабета (European Association for the Study of Diabetes) по ведению больных СД 2 типа, в котором уточнены позиции в отношении назначения иНГЛТ-2 и агонистов рецепторов глюкагоноподобного пептида 1 типа (арГПП-1) (рис. 2–4).
Рис. 2. Обновленный Консенсус American Diabetes Association и European Association for the Study of Diabetes 2021 по ведению пациентов с сахарным диабетом 2 типа (СД2)[11].
Примечание. Здесь и в рис. 3: арГПП-1 — агонисты рецепторов глюкагоноподобного пептида 1 типа, АССЗ — атеросклеротические сердечно-сосудистые заболевания, ГЛЖ — гипертрофия левого желудочка; иДПП-4 — ингибиторы дипептидилпептидазы 4 типа, иНГЛТ2 — ингибиторы натрий-глюкозного котранспортера 2 типа, СКФ — скорость клубочковой фильтрации, СМ — сульфонилмочевина, СН — сердечная недостаточность, СНнФВ — сердечная недостаточность со сниженной фракцией выброса, СС — сердечно-сосудистый, ТЗД — тиазолидиндионы, ФВЛЖ — фракция выброса левого желудочка, ХБП — хроническая болезнь почек, CVOT — Cardiovascular Outcome Trial (клинические исследования по оценке СС безопасности), HbA1c — гликированный гемоглобин
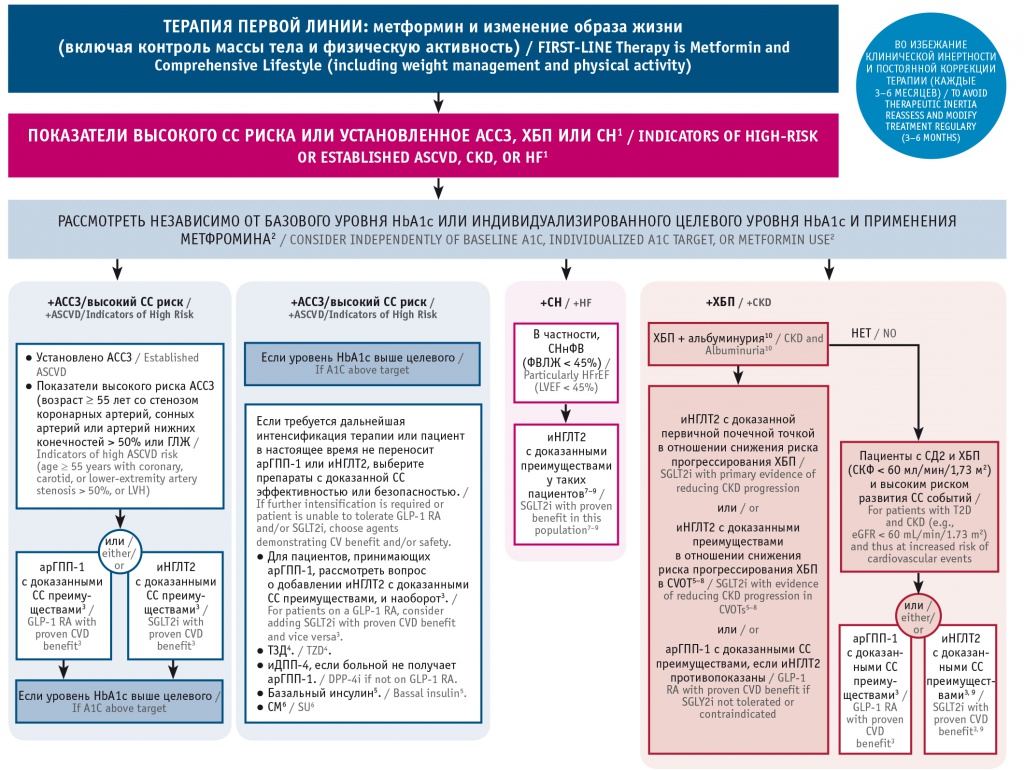

Рис. 3. Обновленный Консенсус American Diabetes Association и European Association for the Study of Diabetes 2021 по ведению пациентов с сахарным диабетом 2 типа (СД2)[11]
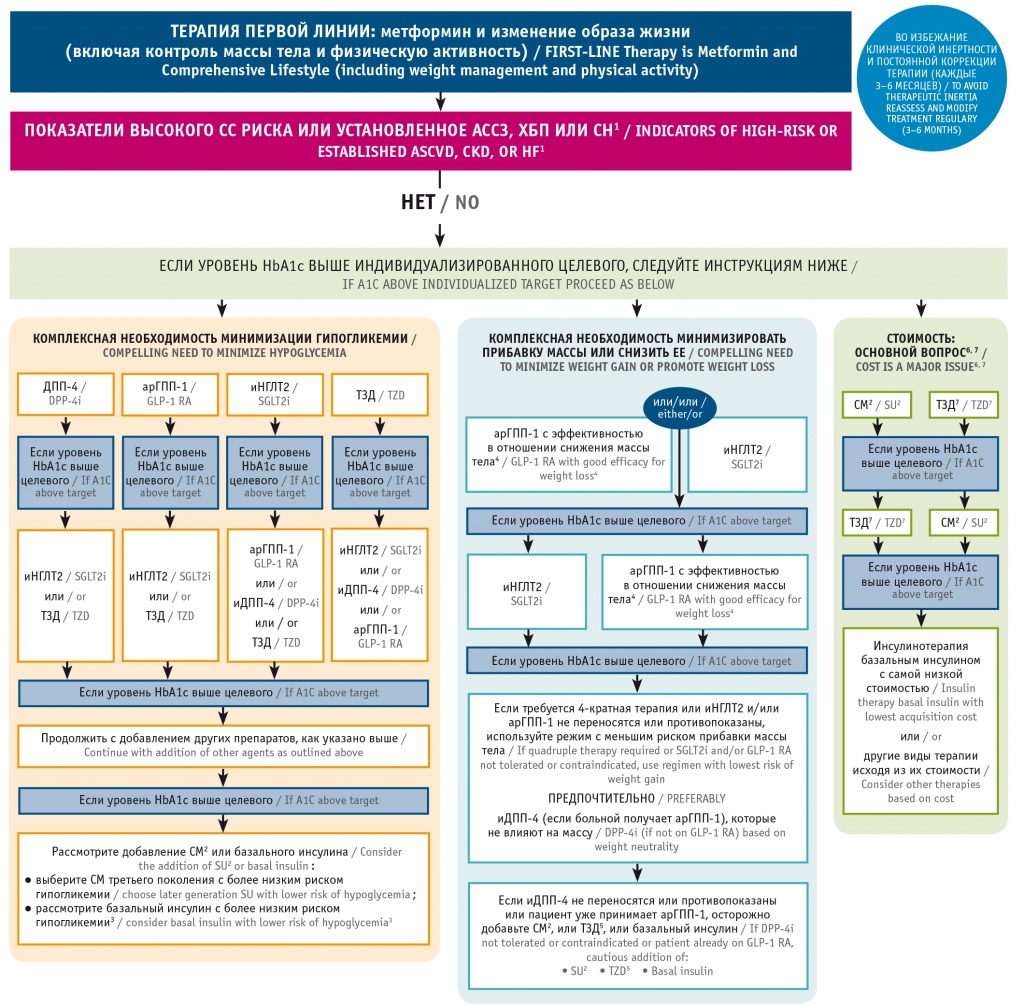

Рис. 4. Факторы, которые следует учитывать при выборе сахароснижающей терапии у взрослых пациентов с сахарным диабетом 2 типа (СД2)[11].
Примечание: АССЗ — атеросклеротические сердечно-сосудистые заболевания, ГПП-1 — глюкагоноподобный пептид 1 типа, ДКА — диабетический кетоацидоз, ДПП-4 — дипептидилпептидаза 4 типа, ЛПНП — липопротеины низкой плотности, НГЛТ2 — натрий-глюкозный котранспортер 2 типа, СКФ — расчетная скорость клубочковой фильтрации, СН — сердечная недостаточность, ХБП — хроническая болезнь почекк, CVOT — Cardiovascular Outcome Trial (клинические исследования по оценке СС безопасности).
* Одобрено Food and Drug Administration (FDA) для снижения риска сердечно-сосудистых осложнений.
** Одобрено FDA для лечения СН.
*** Одобрено FDA для лечения хронических заболеваний почек



В основе представленного алгоритма по выбору лекарственных средств — пациент-ориентированный подход, который включает профилактику сердечно-сосудистых заболеваний (ССЗ), снижение риска гипогликемии, отсутствие прибавки массы тела, уменьшение риска побочных эффектов и учет предпочтений больного. Интенсификация лечения пациентов с СД 2 типа, не достигающего своих целей, не должна откладываться. Режим приема препаратов следует анализировать каждые 3–6 месяцев и корректировать по мере необходимости.
В соответствии с алгоритмами выбора сахароснижающей терапии начинать предпочтительно с изменения образа жизни и назначения метформина, который необходимо принимать длительно[11].
В основу выбора препарата первой линии легли результаты британского проспективного исследования диабета UKPDS 1998 года[8]. В нем показано, что метформин уменьшает продукцию глюкозы печенью и почками (преимущественно через глюконеогенез) и повышает чувствительность к инсулину периферических тканей. При приеме метформина уровень HbА1с снижается на 1–2%, отмечаются низкий риск гипогликемий и незначительное влияние на постпрандиальную гипергликемию. Зафиксировано также улучшение показателей липидного профиля: уменьшение уровней триглицеридов и холестерина липопротеинов очень низкой плотности. Продемонстрировано снижение частоты микро- и макрососудистых осложнений СД 2 типа.
Поскольку прием метформина ассоциирован со снижением/сохранением массы тела вследствие наличия у него анорексигенных эффектов на уровне регуляции экспрессии нейропептида Y в гипоталамусе, препарат рассматривают в качестве первой линии терапии больных СД 2 типа с избыточной массой тела[12, 13]. Постоянно появляются новые данные о сахароснижающих и плейотропных эффектах метформина.
Использование позитронно-эмиссионной томографии позволило выявить новый сахароснижающий механизм действия метформина. Он приводит к накоплению во внутрипросветном пространстве кишечника [18F]-фтордезоксиглюкозы, неметаболизируемого производного глюкозы. Это позволило предположить, что терапия метформином способствует транспорту глюкозы из кровотока в каловые массы[14].
Последние популяционные исследования свидетельствуют о положительном влиянии метформина на лиц с депрессией[15].
В настоящее время нет доказательств, ограничивающих применения метформина у больных LADA диабетом. У большинства пациентов с LADA диабетом клинически диагностируют СД 2 типа и инициируют терапию метформином, прежде чем будет установлен правильный диагноз. У больных LADA диабетом метформин может повысить чувствительность к инсулину, снизить массу тела, уровень холестерина ЛПНП и риск прогрессирования атеросклероза. Назначение метформина возможно при наличии антител к GAD и уровне С-пептида > 0,7 нмоль/л. Обычно длительность терапии — не более 6 месяцев. Продолжаются клинические исследования, изучающие влияние метформина у пациентов с LADA диабетом на уровень метаболического контроля, функцию β-клеток и его переносимость при длительном лечении[16].
В 2016 году были внесены изменения в инструкцию к препарату. Отмечено, что метформин противопоказан при тяжелом поражении почек (скорость клубочковой фильтрации (СКФ) < 30 мл/мин/1,73 м2). Одним из наиболее тяжелых побочных эффектов на фоне терапии метформином является лактоацидоз. В 2020 году опубликованы результаты исследования связи использования метформина или ПСМ с госпитализацией по поводу лактоацидоза среди пациентов с СД 2 типа со снижением функции почек (от легкой до умеренной степени).
Госпитализации по поводу лактоацидоза случались крайне редко, а их частота была сопоставима с таковой у больных, принимавших метформин или ПСМ. Кумулятивная вероятность лактоацидоза у пациентов, продолжавших принимать метформин через 5 лет, составила 0,74% против 0,71% у больных, получавших ПСМ. По мнению авторов, эта разница рисков в 0,03% за 5 лет означает одну дополнительную госпитализацию с лактоацидозом на 3300 больных, получавших метформин в течение 5 лет.
При этом показано, что лечение метформином в течение 1 года в отличие от терапии ПСМ в той же группе пациентов с СД 2 типа и сниженной функцией почек предотвратило 167 серьезных неблагоприятных сердечно-сосудистых событий[13].
У пациентов с СД 2 типа и ухудшением функции почек связь госпитализации по поводу лактоацидоза с приемом метформина незначительна. Достаточно часто случаи лактоацидоза возникали в контексте других заболеваний или состояний, которые были более вероятной его причиной[17]. Распространенность метформин-ассоциированного лактоацидоза оценивалась в ~3–10 случаев на 100 000 человеко-лет и существенно не отличалась от таковой в общей популяции пациентов, получавших ПССП других классов.
Отмечена связь терапии метформином с риском развития анемии средней тяжести у пациентов с СД 2 типа. Механизм раннего снижения содержания гемоглобина неясен и, вероятно, связан не только с дефицитом витамина В12. Однако это не является поводом для прекращения терапии. Периодически необходимо оценивать уровень витамина В12 [18]. Рекомендуется начинать лечение метформином с 500 мг перорально 1 раз в сутки с последующей титрацией дозы каждую неделю по 500 мг; максимальная доза — 3000 мг в сутки.
Алгоритмы инициации и интенсификации сахароснижающей терапии ежегодно претерпевают изменения в связи с появлением новых данных, основанных на выводах, полученных в многоцентровых клинических исследованиях. В клинических исследованиях оценивают не только эффективность и безопасность новых препаратов, но и их влияние на сердечно-сосудистые исходы. Основная задача лечения СД 2 типа — продление жизни больного, поэтому вопросы сердечно-сосудистых исходов являются приоритетными.
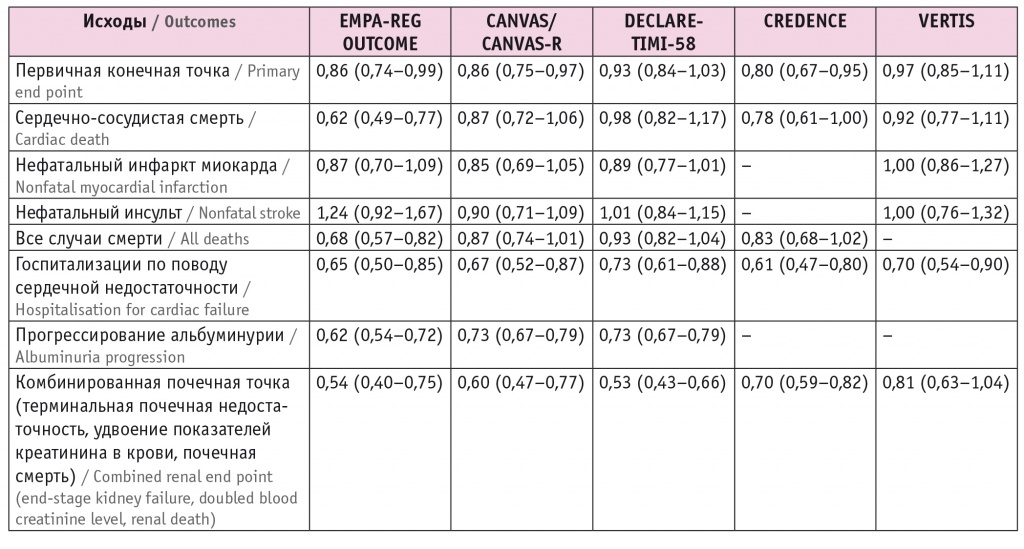
Особый интерес представляют данные по препаратам группы иНГЛТ-2, показавшие преимущества в воздействии на сердечно-сосудистую и почечную систему: EMPA-REG OUTCOME (эмпаглифлозин), CANVAS (канаглифлозин), DECLARE TIMI-58 (дапаглифлозин), CREDENCE (канаглифлозин) и VERTIS (эртуглифлозин). Некоторые препараты класса иНГЛТ-2 уменьшают риск MACE (нефатального инфаркта миокарда, нефатального инсульта, смерти от ССЗ). Использование иНГЛТ-2 сопровождалось класс-эффектом в отношении снижения частоты госпитализаций по поводу сердечной недостаточности (СН), прогрессирования хронической болезни почек (ХБП)[19–22].
В 2019 году в рекомендации American College of Cardiology/American Heart Association по первичной профилактике ССЗ были внесены следующие изменения: возможно использование определенных препаратов для первичной профилактики ССЗ у пациентов с СД 2 типа, HbА1с ≥ 7% и наличием факторов риска ССЗ. Европейские и американские рекомендации по лечению СН и СД 2 типа тоже обновили свои позиции в отношении применения иНГЛТ-2 в терапии больных СД 2 типа.
В августе 2019 года Европейское кардиологическое общество (European Society of Cardiology) в сотрудничестве с Европейской ассоциацией по изучению сахарного диабета (European Association for the Study of Diabetes) выпустило новые рекомендации по лечению и профилактике ССЗ у пациентов с СД и предиабетом. Были даны рекомендации по использованию иНГЛТ-2 как препарата первой линии у больных СД 2 типа с высоким и очень высоким риском и наличием ССЗ.
Данные рекомендации основывались на результатах исследования DECLARE TIMI-58. В этом исследовании показано преимущество раннего назначения дапаглифлозина с целью замедления прогрессирования и развития диабетической нефропатии, снижения риска СН, ССЗ и смертности пациентов с СД 2 типа (независимо от наличия у них ССЗ в анамнезе) или имеющих множественные факторы сердечно-сосудистого риска. Среди побочных эффектов — риски дегидратации, гиповолемии, генитальной инфекции, кетоацидоза, ампутации пальцев стоп, гангрены Фурнье.
Схемы назначения препаратов группы иНГЛТ-2:
- эмпаглифлозин: 10 мг перорально 1 раз/сут, повышение дозы в соответствии с эффектом, максимальная доза — 25 мг/сут;
- канаглифлозин: исходно 100 мг перорально 1 раз/сут, постепенно увеличивать дозу с учетом эффекта, максимально — 300 мг/сут;
- дапаглифлозин: инициация терапии с 10 мг/сут;
- эртуглифлозин: инициировать терапию с 5 мг перорально 1 раз/сут, повышать дозу при необходимости, максимальная доза — 15 мг/сут.
В настоящее время препараты группы иНГЛТ-2 рекомендуют пациентам с СКФ от 30 мл/мин 1,73 м2 и выше (табл. 1)[23–27].
Таблица 1
Клинические исходы в рандомизированных плацебо-контролируемых исследованиях препаратов группы ингибиторов натрий-глюкозного котранспортера 2 типа, относительный риск (95%-ный доверительный интервал)[23]
Результаты исследований препаратов из группы арГПП-1 также послужили поводом для внесения изменений в алгоритмы терапии пациентов с СД 2 типа.
Данные исследований LEADER (лираглутид), SUSTAIN-6 (семаглутид), REWIND (дулаглутид), HARMONY (альбиглутид) показали преимущество арГПП-1 перед плацебо по сердечно-сосудистой безопасности. В исследовании REWIND дулаглутид снижал частоту сердечно-сосудистых событий на 12%, лираглутид в исследовании LEADER уменьшал риск ССЗ на 13%, семаглутид (в инъекциях) в исследовании SUSTAIN-6 — на 26%, семаглутид (пероральная форма) в PIONER-6 — на 21% (табл. 2)[23].
Таблица 2
Клинические исходы в рандомизированных плацебо-контролируемых исследованиях агонистов рецепторов глюкагоноподобного пептида 1 типа, относительный риск (95%-ный доверительный интервал)
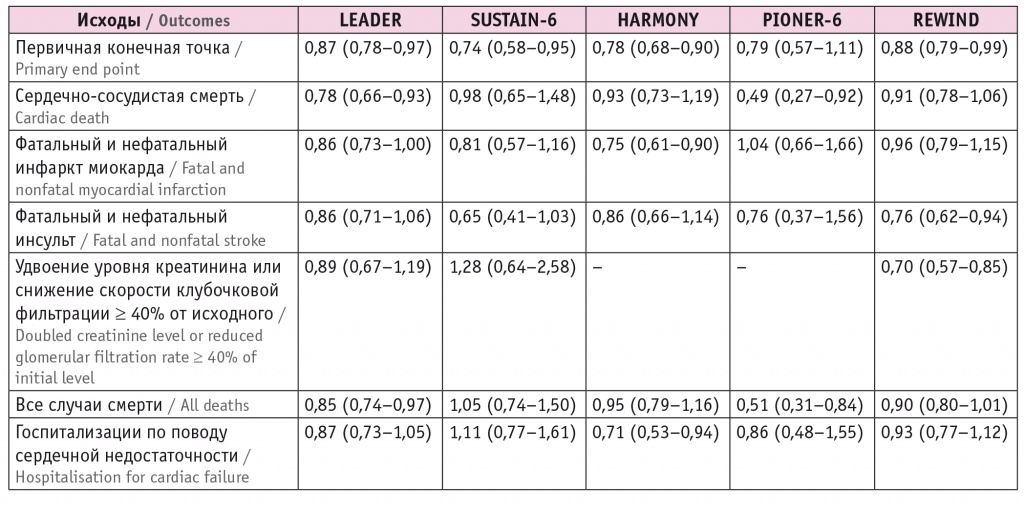
Более того, арГПП-1 (лираглутид, дулаглутид, семаглутид) замедляли прогрессирование альбуминурии. Таким образом, вновь выявленным пациентам с СД 2 типа и ССЗ, а также больным с очень высоким риском ССЗ рекомендуется препарат из группы иНГЛТ-2 или арГПП-1 или его добавление к терапии метформином[23].
Схема назначения препаратов группы агонистов рецепторов глюкагоноподобного пептида 1 типа
- Ликсисенатид: 10 мкг подкожно 1 раз/сут в течение 14 сут, а затем увеличить дозу до 20 мкг 1 раз /сут.
- Эксенатид: исходно 5 мкг подкожно 2 раза/сут, затем доза увеличивается до 10 мкг 2 раза/сут через месяц или назначается пролонгированная форма 2 мг 1 раз в неделю.
- Дулаглутид: исходно 0,75 мг подкожно 1 раз в неделю, затем 1,5 мг 1 раз в неделю.
- Лираглутид: инициация терапии с дозы 0,6 мг подкожно 1 раз/сут, через неделю доза повышается до 1,2 мг/сут, при необходимости — увеличение дозы на 0,6 мг/сут 1 раз в неделю, максимальная доза — 1,8 мг/сут (для препаратов Виктоза, Саксенда), максимальная доза — 3,0 мг/сут.
- Семаглутид: исходно 0,25 мг подкожно 1 раз в неделю в течение 4 недель, затем увеличивают дозу до 0,5 мг 1 раз в неделю в течение не менее 4 недель. Можно повысить дозу до 1 мг 1 раз в неделю, если не достигнута цель лечения. Пероральная форма семаглутида: исходно 3 мг в день в течение 30 дней, затем увеличивают дозу до 7 мг 1 раз/сут в течение 30 дней, затем можно повысить дозу до 14 мг 1 раз/сут[28–33].
Среди побочных эффектов могут быть тошнота, рвота (крайне редко), которые проходят в течение нескольких дней/недель после назначения. К противопоказаниям относятся наличие медуллярного рака щитовидной железы в анамнезе, панкреатит, гастропарез и уменьшение СКФ менее 15 мл/мин 1,73 м2.
У пациентов с ХСН и сниженной фракцией выброса (менее 45%) иНГЛТ-2 обладают более выраженным преимуществом по сравнению с арГПП-1. Для больных с диабетической болезнью почек, представленной в основном альбуминурией, основными препаратами являются иНГЛТ-2, которые тормозят снижение СКФ, улучшают почечные исходы и сердечно-сосудистый прогноз. При противопоказаниях к назначению иНГЛТ-2 возможна терапия препаратом из группы арГПП-1 с доказанным нефро- и кардиопротекторным эффектом[34]. Для пациентов с ХБП стадии С3б и выше предпочтительны аГПП-1. Для больных СД 2 типа, относящихся к группе высокого риска из-за сочетания ХБП и ССЗ, основными средствами терапии будут арГПП-1 и/или иНГЛТ-2 (при СКФ более 30 мл/мин/1,73 м2) с доказанным преимуществом в отношении влияния на ССЗ. Препараты могут быть рекомендованы независимо от концентрации НbА1с и с учетом специфических для пациента факторов.
Если в приоритете снижение массы тела и не достигнут целевой уровень НbА1с, необходимо к метформину добавить препарат из класса иНГЛТ-2 или арГПП-1. При противопоказаниях к терапии арГПП-1 возможно назначение препарата из группы ингибиторов дипептидилпептидазы 4 типа. Инсулин и препараты 2-й генерации сульфонилмочевины применяют только тогда, когда ранее использованная терапия не достигла своей цели.
Некоторым пациентам можно сразу назначать комбинированное лечение, чтобы продлить время до наступления неблагоприятного исхода[35, 36].
Если у больного имеются признаки катаболизма (потеря массы), при наличии симптомов гипергликемии, при уровне НbА1с >10%, глюкозы в крови — 16,7 ммоль/л и более необходимо инициировать инсулинотерапию[37].
ЗАКЛЮЧЕНИЕ
В настоящее время рекомендуют использовать ингибиторы натрий-глюкозного котранспортера 2 типа или агонисты рецепторов глюкагоноподобного пептида 1 типа на начальных этапах терапии СД 2 типа независимо от уровня гликированного гемоглобина при наличии у пациентов атеросклеротических сердечно-сосудистых заболеваний (АССЗ), сердечной недостаточности, хронической болезни почек или факторов риска АССЗ.
Современная стратегия инициации и интенсификации сахароснижающей терапии направлена на эффективное управление сердечно-сосудистыми рисками не только через гликемический контроль, но и через усиление кардиоренопротекции.
Поступила: 18.01.2021
Принята к публикации: 22.03.2021
___________
1 The 9th edition of the IDF Diabetes Atlas. 2019. URL: https://diabetesatlas.org/en/resources/ (дата обращения — 30.02.2021).








