Билиарная патология является наиболее частой причиной развития острого и обострения хронического панкреатита (ХП). Желчнокаменная болезнь (ЖКБ) и высокая литогенность желчи представляют этиологические факторы ХП. Удельный вес холелитиаза в генезе ХП в различных популяциях варьирует в пределах 23–92%[2]. Холецистэктомия не приводит к исчезновению заболевания поджелудочной железы (ПЖ)[16]. У части больных, перенесших холецистэктомию, развивается дисфункция сфинктера Одди, которая выражается в нарушении тонуса сфинктера холедоха, панкреатического протока или общего сфинктера. Мышечная дискинезия сфинктера наиболее часто проявляется его гипертонусом, особенно в первые месяцы после операции.
Гипертонус сфинктера Одди разделяют на два варианта: билиарную и панкреатическую дисфункцию[5, 8, 20, 21]. Риск билиарного панкреатита (БП) в 3 раза выше у пациентов с пигментными камнями, чем со смешанными или холестериновыми[18]. После холецистэктомии возникает качественно новая ситуация в работе органов пищеварения: нарушаются многие физиологические механизмы их взаимоотношений. На протяжении всей оставшейся жизни организм вынужден приспосабливаться к создавшимся условиям. По литературным данным, через 3 года после холецистэктомии у пациентов наблюдают выраженные изменения функционального состояния печени и билиарного тракта, характеризующиеся нарушением моторики, секреции и биохимического состава печеночной желчи[12].
В современной литературе приводятся сведения о формировании билиарной недостаточности при ХП, которая рассматривается с точки зрения уже имеющейся ЖКБ. Панкреатит в этом случае является ее следствием. Проблеме ХП как ведущего звена в возникновении билиарной недостаточности и ЖКБ посвящено мало работ[13, 17]. Нарушение энтерогепатической циркуляции желчных кислот (ЖК) может возникать при частых обильных поносах, являющихся следствием внешнесекреторной недостаточности ПЖ[7]. При тяжелой внешнесекреторной панкреатической недостаточности снижается роль панкреатических ферментов как регуляторов микрофлоры тонкого кишечника. Происходят «пассаж» патогенных микроорганизмов в верхние отделы тонкой кишки и избыточный бактериальный рост в толстой кишке, что обусловливает нарушения деконъюгации, дегидроксилирования и реабсорбции ЖК[9, 22]. Усиленное размножение бактерий (особенно анаэробов) приводит к тому, что деконъюгация ЖК начинается уже в верхних отделах тощей кишки с образованием токсических эндогенных солей ЖК, обладающих токсическим воздействием на печень.
Для нормального функционирования ЖКТ необходимо скоординированное взаимодействие между различными клетками, составляющими его ткани и органы[1]. С помощью межклеточных взаимодействий осуществляется согласованная регуляция метаболизма, дифференциации, пролиферации и физиологических функций данной системы[16]. Основная роль в обеспечении взаимодействия клеток принадлежит гормонам. Большое значение в регуляции функций ЖКТ имеют гастроинтестинальные гормоны.
Секретин играет ключевую роль в регуляторных механизмах экзокринной секреции ПЖ. Синтез и действие секретина и секретин-релизинг-пептидов частично опосредуются через ваговагальные механизмы с рефлекторным участием афферентных сенсорных нейронов в проксимальных отделах тонкой кишки и эфферентных холинергических нейронов в ПЖ. На синтез секретина, помимо ацетилхолина, оказывают влияние многие нейромедиаторы или нейромодуляторы[19].
Глюкозозависимый инсулинотропный полипептид (ГИП) относится к инкретинам. Показано, что инкретины увеличивают количество β-клеток ПЖ и уменьшают массу α-клеток. Следовательно, они контролируют секрецию инсулина, глюкагона, соматостатина, снижая уровень глюкозы[24]. Этот гормон также является ингибитором секреции соляной кислоты в желудке. Предполагают, что существует взаимосвязь между уровнем экспрессии и локализацией рецепторов к ГИП на клетках ПЖ, однако полученные данные противоречивы[23, 25].
Вазоактивный интестинальный пептид (ВИП) — гормон из семейства секретина. Секретируется преимущественно D1(H)-клетками островков Лангерганса ПЖ. Он оказывает выраженное расслабляющее действие на гладкие мышцы кровеносных сосудов и сфинктеров, стимулирует секрецию бикарбонатов ПЖ и тормозит кислотную продукцию желудка[10].
Показано, что синтез и секреция гастроинтестинальных гормонов могут значительно нарушаться при различных заболеваниях ПЖ, и особенно при их осложненном течении[3, 4, 15].
Цель исследования: изучение состава ЖК и гастроинтестинальных гормонов у больных ХП.
МАТЕРИАЛЫ И МЕТОДЫ
Обследованы 95 больных ХП в возрасте от 33 до 60 лет (43 женщины, 52 мужчины), из них у 40 человек выявлен БП, у 55 — алкогольный панкреатит (АП). Группу контроля составили 20 человек без признаков поражения ЖКТ.
Из 55 больных АП у 32 отмечали осложненное течение заболевания, приводившее к значительным морфологическим изменениям в ткани ПЖ. У 10 из этих пациентов выявили вторичный сахарный диабет (СД) и кальциноз ПЖ, у 12 — кальциноз без СД, у 10 — кисты ПЖ.
У всех больных БП проведена холецистэктомия, у двух в анамнезе отмечен панкреонекроз.
Содержание гормонов и пептидов определяли иммуноферментным методом; секретина, ВИП и ГИП — с помощью реактивов фирмы Peninsula Laboratories (США); С-пептида — с применением реактивов фирмы AccuBind (США). Для оценки уровня панкреатической эластазы 1 (Э-1) в кале использовали набор реактивов фирмы Bioserv Diagnostic (Германия).
Исследование желчевыделительной функции печени проводили многомоментным зондированием у 20 больных АП, 17 больных БП и 15 человек группы контроля. Желчь собиралась по пятиминутным фракциям в течение 30 минут после введения раздражителя (30,0 мл 33%-ного раствора магния сульфата). Определяли отдельные фракции ЖК фотометрически после их предварительного разделения методом тонкослойной хроматографии на силикагеле. Проводили исследование конъюгированных желчных кислот (КЖК) — таурохолевой, объединенной фракции таурохенодезоксихолевой, тауродезоксихолевой, гликохолевой и объединенной фракции гликохенодезоксихолевой и гликодезоксихолевой кислот, — свободных ЖК: холевой, объединенной фракции дезоксихолевой, хенодезоксихолевой кислот и литохолевой кислоты.
Для статистической обработки данных применяли пакет прикладных программ Statistica 5.0 — Nonparametric Statistics — Wilcoxon matched pairs test и инженерный калькулятор. Различия считали статистически значимыми при р < 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
У больных БП наблюдали умеренное нарушение экзокринной функции ПЖ: содержание Э-1 в кале было ниже, чем в контрольной группе, — 170,0 ± 28,9 и 365,3 ± 24,8 мкг/г соответственно. В группе с АП уровень Э-1 был 78,4 ± 6,3 мкг/г, что соответствовало тяжелой степени экзокринной недостаточности ПЖ — ниже 100,0 мкг/г.
Концентрация С-пептида у больных АП составила 0,93 ± 0,16 нг/мл, из них у 10 обследованных с развернутой картиной СД уровень С-пептида был снижен до 0,11 ± 0,02 нг/мл. У больных БП содержание C-пептида в крови было 1,40 ± 0,38 нг/мл, в контрольной группе — 1,50 ± 0,31 нг/мл.
В группах больных АП и БП отмечали статистически значимое снижение базального уровня секретина и ГИП по сравнению с группой контроля: секретин — 0,26 ± 0,032 нг/мл, 0,27 ± 0,021 нг/мл и 0,96 ± 0,09 нг/мл соответственно (р < 0,05); ГИП — 0,59 ± 0,13 нг/мл, 0,70 ± 0,21 нг/мл и 1,10 ± 0,18 нг/мл соответственно (р < 0,05).
Уровень ВИП у больных с билиарной патологией был снижен, однако из-за большого разброса значений различия с контролем не были статистически значимыми: 0,12 ± 0,09 и 0,31 ± 0,026 нг/мл соответственно (p > 0,05). В группе АП содержание ВИП (0,37 ± 0,029 нг/мл) статистически значимо не отличалось от контрольных значений.
Таким образом, при АП наблюдались более выраженные нарушения функционального состояния ПЖ, чем при панкреатитах билиарной этиологии, что согласуется с гистологическими изменениями в ПЖ. Морфология БП представлена преимущественно липидно-жировой дистрофией ацинарной клетки при сохранении способности к синтезу ферментов. При АП преобладают процессы атрофии ацинарной паренхимы и заместительного фиброза, что приводит к снижению синтеза ферментов в ацинарной клетке[14].
В дуоденальной желчи больных АП и БП наблюдали повышение абсолютного и процентного (% от суммы ЖК) содержания суммарной фракции тауродиоксихолановых (тауродезоксихолевой + таурохенодезоксихолевой) кислот. В частности, их процентное содержание увеличилось до 10,2 ± 1,6 и 15,0 ± 2,3 соответственно; в контрольной группе — 9,5 ± 1,2%. По данным литературы, тауродезоксихолат натрия влияет на концентрации холецистокинина и секретина в крови, объем и концентрацию бикарбонатов, экзокринную панкреатическую секрецию и на уровень панкреатического полипептида[26].
Уменьшение процентного содержания конъюгатов холевой кислоты выявлено нами у всех больных ХП. Процентное содержание гликохолевой кислоты в группах больных АП и БП находилось приблизительно на одном уровне — 24,1 ± 1,6 и 23,7 ± 3,7 соответственно; в группе контроля — 36,4 ± 2,4% (р < 0,05). При этом у больных АП отмечено более значительное, чем у пациентов с БП, снижение содержания таурохолевой кислоты (до 4,5 ± 0,7%), в контроле — 9,2 ± 0,7% (р < 0,05). Описанные изменения в составе конъюгатов холевой и тауродиоксихолановых ЖК, по-видимому, могут опосредованно приводить к изменению концентраций в крови холецистокинина и секретина, экзокринной панкреатической секреции, объема и концентрации бикарбонатов, рН в двенадцатиперстной кишке, абсорбции в кишечнике не только холестерина, но и самих ЖК. Медиаторами этих изменений являются гормоны или нервные механизмы.
Амплитуда колебаний объема получасовой секреции желчи у больных ХП в нашем исследовании значительно изменялась: от 0,025 до 0,124 л. При этом средние показатели у больных АП и БП были снижены (табл. 1).
Таблица 1
Секреция и содержание компонентов желчи у больных хроническим панкреатитом (М ± m)
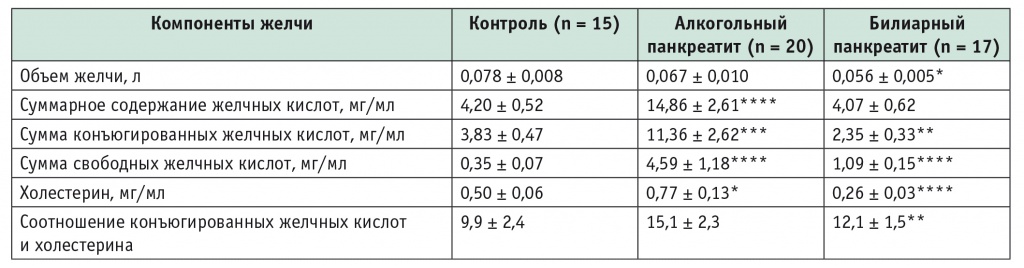
В желчи больных АП (см. табл. 1) отмечали существенное увеличение суммарного содержания ЖК: до 14,86 ± 2,61 мг/мл (р < 0,001) за 30-минутный период секреции. Это в значительной степени было связано с ростом содержания КЖК до 11,36 ± 2,62 мг/мл (р < 0,01). Амплитуда индивидуальных колебаний содержания КЖК у больных АП изменялась от 1,66 до 17,74 мг/мл, у больных БП — от 0,41 до 7,92 мг/мл; в контрольной группе данный показатель составлял в среднем 3,83 ± 0,47 мг/мл. При этом в группе больных ХП в зависимости от характера секреции желчи и содержания в ней КЖК и холестерина можно было выделить подгруппы с высоким и низким содержанием основных компонентов желчи. У 2/3 больных АП с длительностью заболевания до 7 лет практически не измененная секреция желчи сочеталась с высоким содержанием КЖК (в 2,8 раза превышавшим показатели контроля). С увеличением длительности заболевания в желчи больных АП снижение секреции желчи до 35% сочеталось с уменьшением содержания в ней холестерина с 0,59 ± 0,23 до 0,37 ± 0,07 мг/мл и КЖК с 10,32 ± 2,17 до 2,80 ± 1,14 мг/мл (р < 0,05). При этом нормальное соотношение фракций КЖК изменялось в крови и желчи (табл. 2): снижалось содержание (% от суммы ЖК) фракций, конъюгированных с глицином и таурином.
Таблица 2
Процентное содержание фракций желчных кислот (% от суммы желчных кислот) в желчи больных хроническим панкреатитом (М ± m)
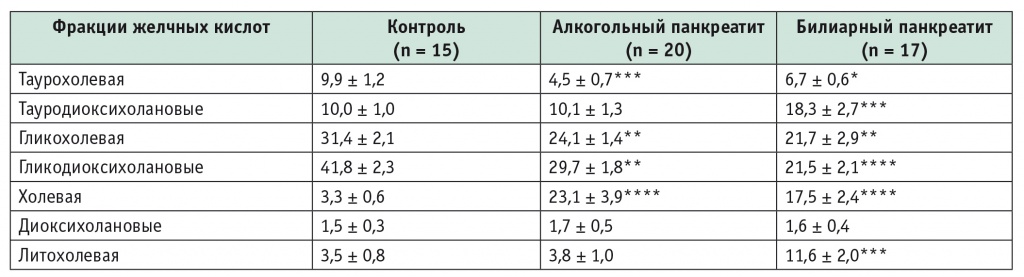
Примечание. При сравнении с контролем: (*) — p < 0,05; (**) — p < 0,02; (***) — p < 0,01; (****) — p < 0,001.
Среди свободных ЖК в дуоденальной желчи больных ХП преобладала холевая кислота (см. табл. 2). С одной стороны, увеличение содержания литохолевой кислоты могло быть связано с изменением в печени процессов конъюгации ЖК не только с глицином, но и с таурином (о чем свидетельствует, например, сниженное в 2 раза содержание таурохолевой кислоты в желчи больных АП). С другой стороны, резкое увеличение абсолютного и процентного содержания свободной холевой кислоты могло являться следствием ускорения процессов преждевременной деконъюгации ЖК при патологическом росте бактериальной микрофлоры в тощей кишке, что наиболее характерно для больных БП[11]. С увеличением длительности заболевания (более 10 лет) в желчи больных АП также отмечалось значительное возрастание процентного содержания литохолевой кислоты: с 3,1 ± 0,6% до 6,7 ± 1,8% (р < 0,01). У больных БП в желчи содержание литохолевой кислоты увеличилось более чем в 2 раза (р < 0,05).
В отличие от больных АП, у пациентов с БП отмечали снижение секреции желчи, уменьшение содержания в ней КЖК до 2,35 ± 0,33 мг/мл. При этом выявляли значительное уменьшение содержания в желчи холестерина: от 0,293 до 0,016 мг/мл, что в среднем для группы составило 25% от уровня контроля.
Своеобразие индивидуального состава КЖК в дуоденальной желчи больных АП заключалось в снижении уровней таурохолевой, гликохолевой и гликодиоксихолановых кислот соответственно в 2, 1,5 и 1,4 раза. Следует отметить, что абсолютное и процентное содержание тауродиоксихолановых кислот было повышено у всех больных ХП. В целом для группы больных АП эти изменения являлись причиной несущественного снижения глицин/тауринового коэффициента. Однако с увеличением длительности заболевания наблюдалось более значительное снижение данного показателя — от 5,0 ± 0,99 до 3,0 ± 0,7 (или до 65% от уровня контроля), — что указывало на нарушение процесса конъюгации ЖК с глицином в клетках печени.
Следует отметить, что синтез ЖК в печени является сложно регулируемым процессом, который контролируется, по крайней мере, двумя механизмами обратной связи: количеством ЖК, поступающих в печень из кишечника по системе воротной вены, и количеством поступающего в печень эндо- и экзогенного холестерина. У больных ХП снижается способность к усвоению экзогенного холестерина и ЖК, что наряду с установленными значительными потерями ЖК с фекалиями, в 3 раза превышающими соответствующий показатель у здоровых лиц, может являться причиной компенсаторного усиления в печени синтеза ЖК. По данным литературы, в условиях эксперимента с полным выведением желчи наружу значительно увеличивается синтез ЖК, повышается содержание свободных ЖК с преобладанием холевой кислоты[6].
К возможным причинам уменьшения содержания холестерина в желчи больных ХП следует отнести снижение всасывания в кишечнике экзогенного холестерина, не только подтвержденное у больных ХП, но и выявленное у 2/3 больных после операций на желчных путях. При этом необходимым условием нормального всасывания холестерина является не только достаточное общее содержание ЖК в просвете кишечника, но и их нормальное соотношение: конъюгаты триоксихолановых кислот (таурохолевая и гликохолевая кислоты) образуют мицеллы меньшего размера, которые быстрее диффундируют через неперемешиваемый водный слой, прилегающий к щеточной каемке[6, 7].
Как показало проведенное нами исследование, в дуоденальной желчи пациентов всех обследованных групп уменьшилось содержание таурохолевой и гликохолевой кислот. Снижение глицин/тауринового коэффициента было обусловлено более низким содержанием гликодиоксихолановых кислот. У 85% больных после операций на желчных путях имеются нарушения состава и соотношения физиологической микрофлоры кишечника, что, вероятно, влияет на рост содержания свободных ЖК и может являться причиной значительного и статистически значимого (р < 0,05) увеличения процентного содержания в желчи литохолевой кислоты (в 3,5 раза у обследованных нами больных)[7]. При этом известно, что рост содержания вторичных ЖК, и особенно литохолевой кислоты, может являться одной из причин снижения в печени синтеза ЖК.
ЗАКЛЮЧЕНИЕ
При хроническом панкреатите (ХП) изменяется секреция желчи и ее основных компонентов. Нарушение конъюгации желчных кислот (ЖК) в печени с глицином и, особенно, таурином может приводить к изменениям качественного состава ЖК и всасывания экзогенного холестерина, наиболее выраженным у больных с билиарнозависимыми формами панкреатита.
В желчи 75% больных алкогольным панкреатитом содержание конъюгированных желчных кислот (КЖК) повышено. С увеличением длительности заболевания снижаются секреция желчи, содержание в ней КЖК и холестерина, уменьшается конъюгация с глицином. Своеобразие индивидуального состава ЖК в желчи больных ХП в нашем исследовании заключалось в снижении содержания конъюгатов холевой кислоты (таурохолевой и гликохолевой), в значительном уменьшении содержания гликоконъюгатов, и особенно гликодиоксихолановых кислот, в существенном росте уровней свободной холевой кислоты и тауродиоксихолановых кислот; доля литохолевой кислоты увеличивалась с ростом длительности и тяжести заболевания поджелудочной железы (ПЖ).
Таким образом, секреция ПЖ контролируется комплексом паракринных и эндокринных путей, поэтому столь важно понимание механизмов контроля путей в норме и при патологии. Выявленные изменения в составе ЖК и нарушения секреции гастроинтестинальных гормонов усугубляют первичную внешнесекреторную недостаточность ПЖ.








