Постгемиколэктомический синдром развивается при хирургическом удалении правой или левой половины ободочной кишки и выражается в ухудшении всасывания, моторных и секреторных процессов, а также в нарушении бактериального равновесия кишечника. Несмотря на современные достижения в медицине, результаты лечения больных после гемиколэктомии (ГКЭ) неудовлетворительны[2–4, 6].
В экспериментальных работах последних лет описаны обширные морфологические и нейрохимические изменения в гипертрофированной кишке, расположенной проксимальнее хронического частичного стеноза просвета кишки[1]. Так, перед декомпенсацией кишечной проходимости, в престенотическом сегменте кишки иногда отмечали уменьшение уровня субстанции Р, вазоактивного интестинального полипептида[9]. Более того, в другом исследовании при изучении нейромышечной перистальтической передачи были выявлены нарушения за счет как рецепторного (ацетилхолинового), так и нерецепторного (К+) пути, которые восстанавливались только через 2 недели после устранения обтурации[7]. Анализ литературных данных показал, что механизмы развития экспериментального постгемиколэктомического синдрома недостаточно ясны.
Цель исследования: изучение электрофизиологических и морфологических особенностей экспериментального постгемиколэктомического синдрома.
МАТЕРИАЛЫ И МЕТОДЫ
В экспериментах использовали самок белых крыс породы Вистар массой 210,0–230,0 г в возрасте 6 месяцев, предоставленных питомником лабораторных животных при филиале Института биоорганической химии им. академиков М. М. Шемякина и Ю. А. Овчинникова РАН. Животных содержали согласно соответствующим нормативам, одобренным локальным этическим комитетом Московского клинического научно-практического центра, и в соответствии с требованиями приказа МЗ РФ от 19 июня 2003 г. № 267 «Об утверждении Правил лабораторной практики». Животным был предоставлен свободный доступ к пище (им давали стандартный гранулированный корм) и воде. За 12 часов до операции их перестали кормить, оставив доступ к воде.
Эксперименты проводили на трех группах животных: в первой (n = 6) электромиограмму (ЭМГ) регистрировали через 1–5 минут после ГКЭ; во второй (n = 6) — через 1,5 месяца после ГКЭ; в третьей (n = 6) — через 6 месяцев после ГКЭ. Контрольную группу составили 5 животных. Животных выводили из эксперимента группами спустя 1–5 минут, 1,5 месяца и 6 месяцев после ГКЭ.
Правостороннюю ГКЭ проводили с формированием илеотрансверзоанастомоза по типу «конец в конец», исключив из процесса пищеварения слепую и восходящую кишку, которые по содержанию микробной флоры превосходят другие отделы толстой кишки у крысы. Выполняли нижнесрединную лапаротомию: в рану выводили подвздошную, слепую и поперечную ободочную кишку, регистрировали ЭМГ путем наложения контактных серебряных электродов площадью 1 мм2. Регистрацию ЭМГ производили в течение 15–20 минут в условиях предусиления и с использованием аппаратно-программного комплекса CONAN-m (Россия) с полосой пропускания от 0,01 до 10 кГц и уровнем шумов менее 1–5 мкВ. На кривой ЭМГ измеряли амплитудно-частотные характеристики медленных волн (МВ) и спайков. После этого проводили ГКЭ и формировали илеотрансверзоанастомоз с проксимальным отделом поперечной ободочной кишки.
Морфологическое исследование области илеотрансверзоанастомоза и поперечной ободочной кишки выполняли у животных третьей группы через 6 месяцев после наложения анастомоза. Образцы ткани фиксировали в 9%-ном растворе формалина, обезвоживали в спиртах возрастающей концентрации от 70 до 96 °С, заключали в парафин, готовили гистологические срезы, окрашивали гематоксилином и эозином.
Статистическую обработку полученных данных проводили с применением пакета программ Statistica 6.0 (StatSoft, США). Все количественные данные, подчинявшиеся нормальному распределению, представляли в виде M ± m. Для обработки полученных результатов применяли t-критерий Стъюдента с последующим определением уровня статистической значимости различий (p) и критерия χ2. Различия между средними значениями считали статистически значимыми при р < 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Проведение правосторонней ГКЭ у животных первой группы привело к повышению у них частоты МВ ЭМГ подвздошной кишки до 9,4 ± 0,7 в минуту против 8,51 ± 0,5 в контрольной группе (10,5%, р > 0,05) при тенденции к снижению амплитуды МВ с 0,35 ± 0,05 до 0,32 ± 0,06 мВ (8,6%, р > 0,05). В области анастомоза частота МВ ЭМГ составляла 10,0 ± 1,5 в минуту, амплитуда — 0,2 ± 0,03 мВ, что, возможно, было связано с повышением возбудимости механорецепторов афферентного отдела интрамуральной нервной системы кишки.
Правосторонняя ГКЭ у животных первой группы привела к снижению у них частоты МВ ЭМГ поперечной ободочной кишки до 9,2 ± 0,9 в минуту против 14,0 ± 0,9 у животных контрольной группы (34,3%, р < 0,05) при повышении амплитуды МВ с 0,12 ± 0,02 до 0,2 ± 0,03 мВ (66,7%, р < 0,05). Таким образом, формирование анастомоза изменяет хроно- и инотропные взаимоотношения гладких мышц толстой кишки. Определенную роль в возникновении моторных нарушений кишки играют разрыв целостности афферентных и эфферентных рефлекторных дуг интрамуральной нервной системы, нарушение передачи возбуждения в экстрамуральных путях: нисходящих возбуждающих и восходящих тормозных рефлекторных влияний.
Спустя 1,5 месяца после ГКЭ у животных второй группы частота МВ подвздошной кишки продолжала увеличиваться — с 9,4 ± 0,7 до 14,2 ± 0,8 в минуту (51%, p < 0,05), — амплитуда МВ восстановилась с 0,32 ± 0,06 до 0,35 ± 0,04 мВ (9,3%, р > 0,05), появилась спайковая активность: частота спайков составляла 0,25 ± 0,03, амплитуда — 0,05 ± 0,0012 мВ, что, возможно, было связано с повышением возбудимости гладких мышц циркулярного слоя.
Спустя 1,5 месяца после ГКЭ амплитудно-частотные характеристики медленноволновой активности ЭМГ анастомоза остались практически неизменными. Отличием явилось появление средневыраженной спайковой активности области анастомоза у животных второй группы: ее частота составила 0,3 ± 0,013, амплитуда — 0,12 ± 0,021 мВ.
Частота МВ поперечной ободочной кишки у животных второй группы через 1,5 месяца после формирования анастомоза увеличилась с 9,2 ± 0,9 до 12,3 ± 1,7 в минуту (33,4%, р < 0,05), амплитуда — с 0,2 ± 0,03 до 0,3 ± 0,023 мВ (50,1%, р < 0,05), т. е. произошло изменение хроноинотропных взаимоотношений в гладких мышцах толстой кишки и усилился перистальтический рефлекс ниже развивающегося препятствия в области анастомоза. У крыс контрольной группы показатели ЭМГ исследуемых отделов кишки оставались стабильными.
Через 6 месяцев после ГКЭ у животных третьей группы отмечали уменьшение амплитудно-частотных характеристик подвздошной кишки по сравнению с аналогичными показателями через 1,5 месяца после оперативного вмешательства: их частота снизилась с 14,2 ± 0,8 до 10,8 ± 1,1 в минуту (26,7%, р < 0,05), амплитуда — с 0,35 ± 0,04 до 0,18 ± 0,03 мВ (48,6%, р < 0,05). Спайковая активность не проявлялась, по-видимому, в связи с декомпенсацией сократительной функции мышечного слоя перед формировавшимся в области анастомоза стенозом, что подтверждалось дальнейшим снижением моторной функции анастомоза. Так, у животных третьей группы наблюдали снижение амплитудно-частотных характеристик области анастомоза: частота МВ уменьшилась с 10,3 ± 0,7 до 7,6 ± 1,0 в минуту (26,2%, р < 0,05), частота амплитуды — с 0,2 ± 0,03 до 0,14 ± 0,03 мВ (30%, р = 0,05). Спайковая активность отсутствовала.
Частота МВ ЭМГ поперечной ободочной кишки у животных третьей группы уменьшилась с 12,3 ± 1,7 до 9,1 ± 1,2 в минуту (27,7%, р < 0,05), амплитуда — с 0,3 ± 0,023 до 0,18 ± 0,04 мВ (39,9%, р < 0,05). Спайковая активность не регистрировалась, что могло свидетельствовать о снижении возбудимости гладких мышц тонкой и толстой кишки и в целом о снижении пассажа содержимого по тонкой и толстой кишке через 6 месяцев после операции.
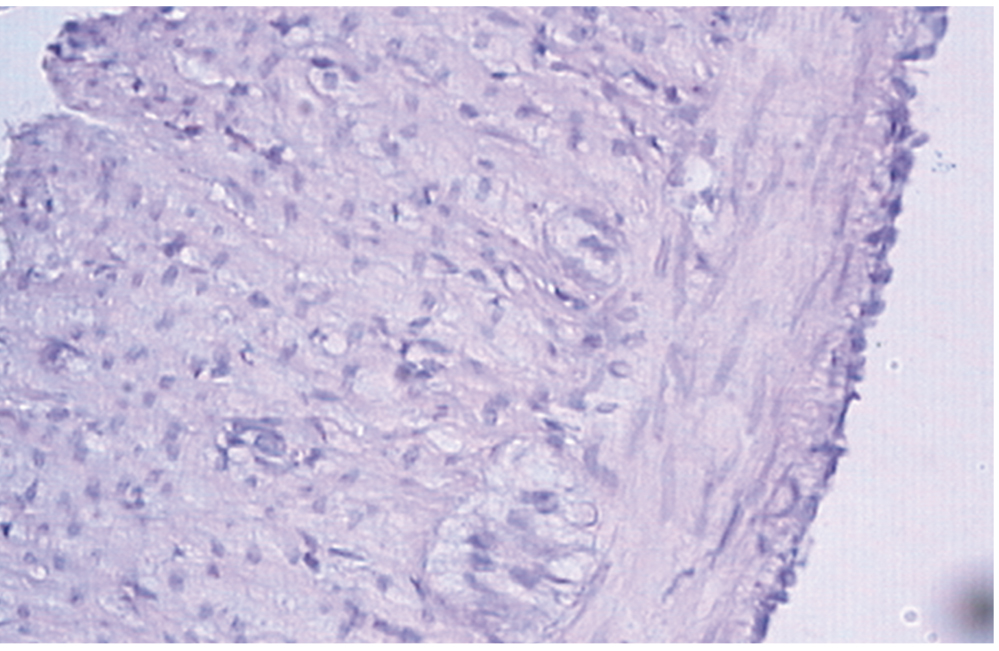
Морфологически через 6 месяцев после ГКЭ в области анастомоза у животных третьей группы определяли выраженную круглоклеточную инфильтрацию слизистого и подслизистого слоя, поддерживавшую в области анастомоза явления воспаления. Отмечали вакуольную дистрофию нейронов ганглиев межмышечного нервного сплетения. Наблюдали избыточное развитие соединительной ткани в области анастомоза с нарушением структуры кишечных ворсинок и крипт (рис. 1). Были выявлены наличие соединительнотканной прослойки между мышечными слоями и проникновение соединительной ткани в толщу мышечных слоев. Отмечали выраженное расслоение пучков гладкомышечных клеток в результате прорастания соединительной ткани. На отдельных участках единичные гладкомышечные клетки или небольшие их группы оказались окруженными соединительной тканью. По периферии мышечных слоев выявляли атрофированные мышечные клетки. Вместе с тем в толще мышечного массива многие гладкомышечные клетки были гипертрофированы. Этой стадии процесса соответствовало развитие вакуольной дистрофии нейронов межмышечного нервного сплетения (рис. 2).
Рис. 1. Развитие соединительной ткани и межмышечное нервное сплетение области илеотрансверзоанастомоза при гемиколэктомии (увеличение × 250; окраска гемотоксилином и эозином). Фото авторов
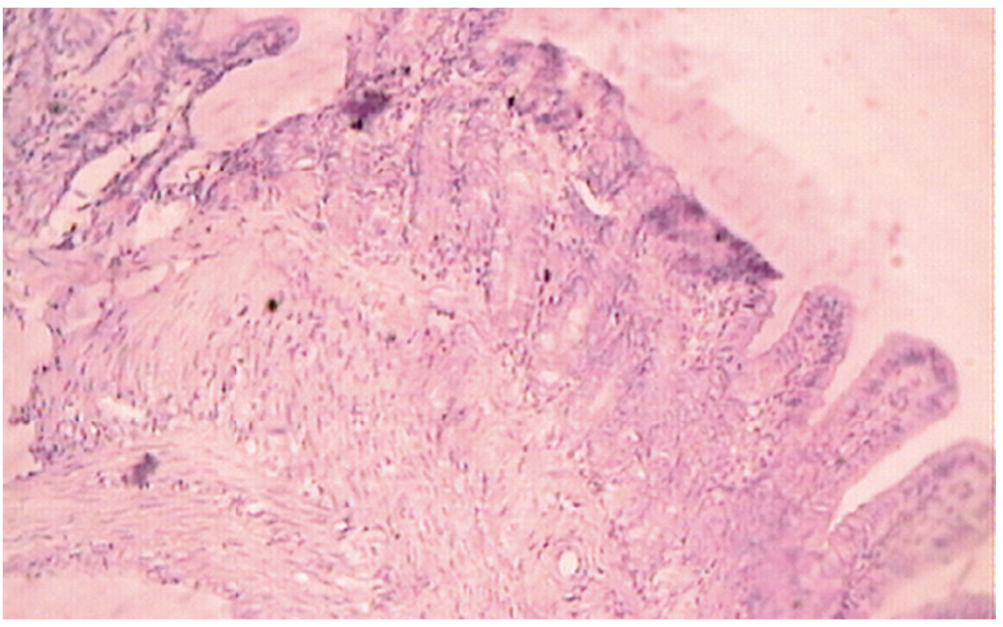
Рис. 2. Межмышечное нервное сплетение толстой кишки при гемиколэктомии (увеличение × 250; окраска гематоксилином и эозином). Фото авторов
ОБСУЖДЕНИЕ
Исследование моторной функции подвздошной кишки, области анастомоза и поперечной ободочной кишки показало, что соотношение частоты МВ у животных третьей группы (через 6 месяцев после ГКЭ) по сравнению с животными второй группы (спустя 1,5 месяца после ГКЭ) составляло в указанных областях соответственно 1,42 : 1 : 1,19, тогда как у животных второй группы по сравнению с животными первой группы (через 1–5 минут после ГКЭ) — соответственно 1,38 : 1 : 1,19, что может свидетельствовать о постепенном нарастании гиперреактивности циркулярных мышечных волокон подвздошной кишки.
Полученные электрофизиологические данные согласуются с результатами исследований S. Bertoni и соавт. (2008, 2013), показавших, что гипертрофия гладких мышц кишки приводит к гиперреактивности циркулярных мышечных волокон и к повышенной чувствительности к расслабляющимся агентам продольных мышечных волокон[5, 7, 8]. При электронной микроскопии была выявлена гипертрофия миоцитов и фибробластов I–II типа. В свою очередь, повышение количества фибробластов приводит к увеличению содержания коллагеновых волокон в подслизистом, мышечном и адвентиционном слоях кишки, что также может оказывать негативное влияние на ее сократительную функцию.
ЗАКЛЮЧЕНИЕ
Таким образом, нарушение моторной функции подвздошной кишки может быть обусловлено избыточным развитием соединительной ткани, наблюдаемым в области анастомоза и может определяться нарушением функционирования интрамуральной нервной системы области анастомоза. Дисфункция межмышечного нервного сплетения усугубляет нарушение пропульсивной активности кишки. Развитие соединительной ткани в области анастомоза усиливает функциональную нагрузку на мышечный слой преданастомотического участка кишки. Постепенная декомпенсация моторной функции подвздошной кишки способствует градуальному снижению пропульсивной активности толстой кишки.
Сопоставление функциональных и структурных изменений, выявленных в ходе исследования, позволяет считать эту стадию процесса субкомпенсированным состоянием илеотрансверзоанастомоза, о чем дополнительно свидетельствует развивающаяся дилатация подвздошной кишки.








