В рамках ХХ Объединенной Российской гастроэнтерологической недели (6–8 октября 2014 года, г. Москва) состоялся симпозиум, посвященный актуальной теме — функциональным расстройствам ЖКТ, занимающим значительное место в структуре гастроэнтерологических заболеваний. Докладчиками освещены вопросы, касающиеся роли моторных нарушений при желудочно-кишечных заболеваниях как функционального, так и органического характера, современных лечебных подходов.
Механизмы формирования моторных нарушений при функциональных заболеваниях желудочно-кишечного тракта. От патогенеза к лечению
 |
Агафонова Наталья Анатольевна Кандидат медицинских наук, доцент, ученый секретарь кафедры гастроэнтерологии и диетологии факультета дополнительного профессионального образования ГБОУ ВПО «Российский национальный исследовательский медицинский университет имени Н. И. Пирогова» Минздрава России, г. Москва |
Как правило, в основе жалоб больных на абдоминальные боли, изжогу, отрыжку, тошноту, рвоту, нарушения стула, вздутие живота лежат моторные нарушения, которые могут быть первичными (функциональными) и вторичными — возникающими на фоне органических изменений ЖКТ. Симптомы формируются в основном вследствие нарушения моторной активности либо стенки полого органа (по гипер- или гипомоторному типу), либо сфинктерного аппарата (с наличием спазма или недостаточности). Функциональные расстройства различных органов ЖКТ могут накладываться друг на друга, что создает определенные трудности для диагностики и лечения.
Основной симптом, свидетельствующий о нарушении моторной активности ЖКТ, — абдоминальная боль. Боль при функциональных нарушениях по механизму формирования относится к висцеральному типу. Висцеральная боль возникает при наличии патологических стимулов во внутренних органах (таких как растяжение стенки полого органа или капсулы паренхиматозного органа). Поскольку большинство органов пищеварения — это полые органы, механизм формирования боли в значительной степени связан с нарушением тонуса их гладкой мускулатуры с преобладанием гипертонуса, спазмом или растяжением полого органа. Висцеральная боль является ноцицептивной болью. Ноцицепторы — это чувствительные рецепторы, расположенные в слизистой оболочке большинства мышечных органов, воспринимающие различные сигналы, которые кодируются и передаются в центральную нервную систему (ЦНС). Ноцицептивная система, обеспечивающая формирование боли, имеет много уровней и иерархически организована.
Важную роль в формировании висцеральной боли играет висцеральная гиперчувствительность, которая оказалась универсальным механизмом практически для всех функциональных нарушений ЖКТ, а не только для синдрома раздраженного кишечника (СРК), при котором впервые была описана. Висцеральная гиперчувствительность трактуется как повышенная чувствительность к периферическим стимулам любого происхождения (механическим, термическим, химическим), проявляющаяся возникновением болевых ощущений, моторных и секреторных нарушений в ответ на их допороговые значения.
В формировании боли принимает участие антиноцицептивная система — так называемый аппарат контроля боли. В этот аппарат входит ряд структур головного мозга, которые осуществляют нисходящий цереброспинальный контроль афферентного пути, вызывая торможение нейронов спинного мозга. Активируясь ноцицептивными сигналами, структуры антиноцицептивной системы при помощи петли обратной связи угнетают передачу болевых импульсов, тормозя ноцицептивные нейроны в задних рогах спинного мозга, в ретикулярной формации, ядрах таламуса. Это приводит к ослаблению болевого стимула и спасает от болевого шока. Наибольшее значение в нейрохимических механизмах обезболивания имеют опиоидергическая, серотонинергическая, норадренергическая и каннабиноидная системы мозга.
Регуляция моторной функции органов ЖКТ имеет многоуровневый характер, можно выделить местный, сегментарный и центральный уровни. Местная регуляция моторики ЖКТ осуществляется благодаря наличию клеток — водителей ритма в гладкой мускулатуре; например, в желудке они располагаются в проксимальной части большой кривизны, для тонкой кишки — в проксимальной части двенадцатиперстной кишки (ДПК). В ряде случаев такими водителями ритма могут выступать одиночные миоциты — клетки Кахаля.
Структурной единицей моторной активности является мигрирующий моторный комплекс (ММК), фазы которого представлены на рисунке 1.
Рис. 1. Фазы мигрирующего моторного комплекса (Тропская Н. С., 2010)

Изучение моторной активности кишки показало, что для СРК с запором характерно наличие дискретных кластерных спазмов во второй фазе ММК, тогда как в норме в этой фазе отсутствуют высокоамплитудные сокращения. Этот феномен ряд исследователей связывают со спазмом поперечного слоя гладкой мускулатуры кишечника, который вызывает боль и замедление транзита кишечного содержимого при СРК с запором.
При СРК с диареей же имеются усиленные пропульсивные сокращения, которые начинаются в тонкой кишке. Они обусловлены спазмом продольных мышц кишки, при этом у больных формируются диарея и спастическая боль.
Важное значение в регуляции моторной активности принадлежит энтеральной нервной системе. Обнаружено более 30 функциональных типов нейронов, и идентифицировано около 25 различных нейротрансмиттеров в энтеральных нейронах. Некоторые медиаторы хорошо изучены — это ацетилхолин, норадреналин, дофамин. Плотность рецепторов для восприятия этих медиаторов в различных органах ЖКТ различная. Так, плотность М-холинорецепторов выше в желудке, чем в кишке, поэтому атропиноподобные вещества лучше работают в желудке, чем в кишке. Дофаминергические рецепторы расположены только до трейцевой связки, и в связи с этим препараты, работающие на дофаминовых рецепторах, эффективны в основном в области пищевода, желудка и частично ДПК. Продолжается изучение различных типов серотониновых рецепторов, поскольку они играют большую роль в формировании висцеральной чувствительности, моторной активности и секреции кишечника.
Некоторые нейропептиды, в том числе энкефалины, модулируют активность интрамуральных нейронов.
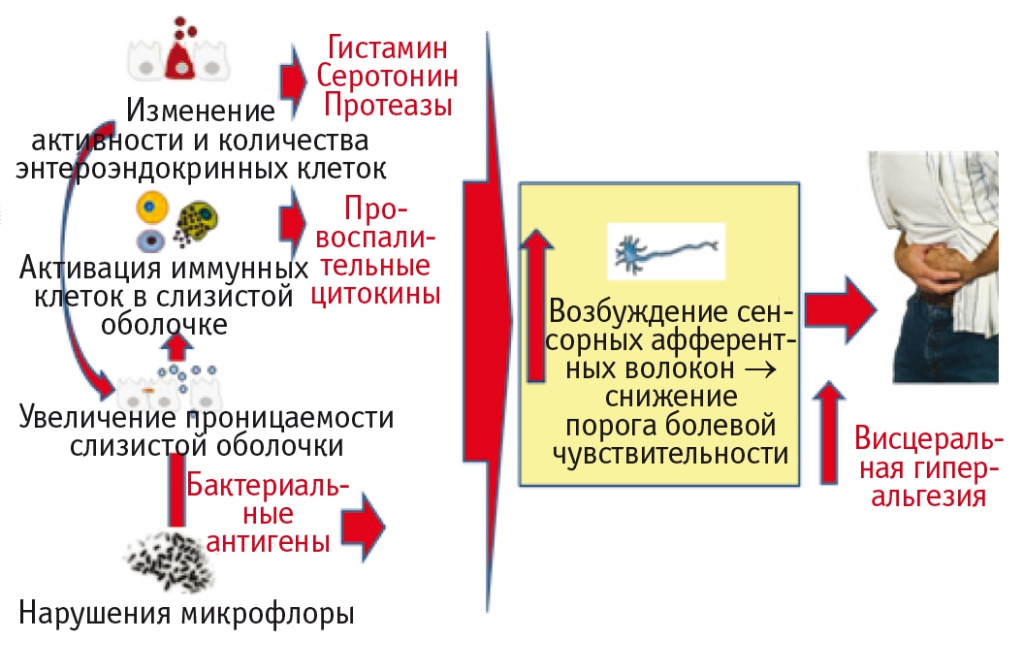
Значительное местное влияние на состояние моторики ЖКТ оказывает микрофлора. Деятельность микроорганизмов, населяющих кишечник, приводит к увеличению объема каловых масс, газообразованию, снижению порога чувствительности миоцитов, к стимуляции выработки холецистокинина и других активных веществ. Помимо этого, сами бактерии вырабатывают огромное количество различных веществ, так или иначе воздействующих на моторику: медиаторы (гистамин, серотонин, ГАМК, циклические АМФ и ГМФ); токсины и пептиды; бактериальные метаболиты желчных кислот; короткоцепочечные жирные кислоты (КЦЖК) и др. Нарушение состава кишечной микрофлоры приводит к изменению спектра продуцируемых ею метаболитов: КЦЖК, деконъюгированных желчных кислот. Это оказывает негативное влияние на работу кишечника, особенно на его моторику. Проведенные в последнее время исследования показали, что микробная флора участвует в формировании висцеральной чувствительности у пациентов с СРК (рис. 2). Поэтому коррекции микрофлоры ЖКТ отводится значительное место в лечении его моторных нарушений.
Рис. 2. Участие микробной флоры в механизме развития висцеральной гиперчувствительности при синдроме раздраженного кишечника
Нарушение функционирования ЦНС является одним из важнейших факторов, приводящих к моторным нарушениям ЖКТ. Психоэмоциональные реакции, общий психоэмоциональный фон, органические поражения ЦНС оказывают эфферентные влияния на состояние вегетативной нервной системы (симпатической и парасимпатической), которая через внекишечные и внутрикишечные ганглии, собственную нервную систему кишечника регулирует работу гладких миоцитов и желез.
Таким образом, регуляция моторной активности действительно является многоуровневой, строго организованной.
Лечение заболеваний ЖКТ, сопровождающихся моторными нарушениями, как правило, комплексное. Однако подходы к коррекции собственно моторных нарушений практически сходны как при первичных (функциональных), так и при вторичных нарушениях. В основном используются два класса препаратов — прокинетики и спазмолитики.
Прокинетики повышают тонус и двигательную активность ЖКТ и ускоряют транзит пищевого болюса по нему. Если рассматривать основных представителей класса прокинетиков: метоклопрамид, домперидон, итоприда гидрохлорид, — то они работают на верхнем этаже брюшной полости: в пищеводе, желудке и частично в ДПК. Прукалоприд — полный агонист 5-НТ4-рецепторов — увеличивает пропульсивную активность только толстой кишки. Тримебутин, являющийся агонистом опиатных рецепторов, нормализует моторику ЖКТ и может считаться в какой-то степени прокинетиком: снимая спазм, он запускает нормальную моторику. Препарат действует во всех отделах ЖКТ, практически не имеет побочных эффектов и может оказывать антиэметическое (противорвотное) действие (табл.).
Таблица
Сравнительная характеристика прокинетиков
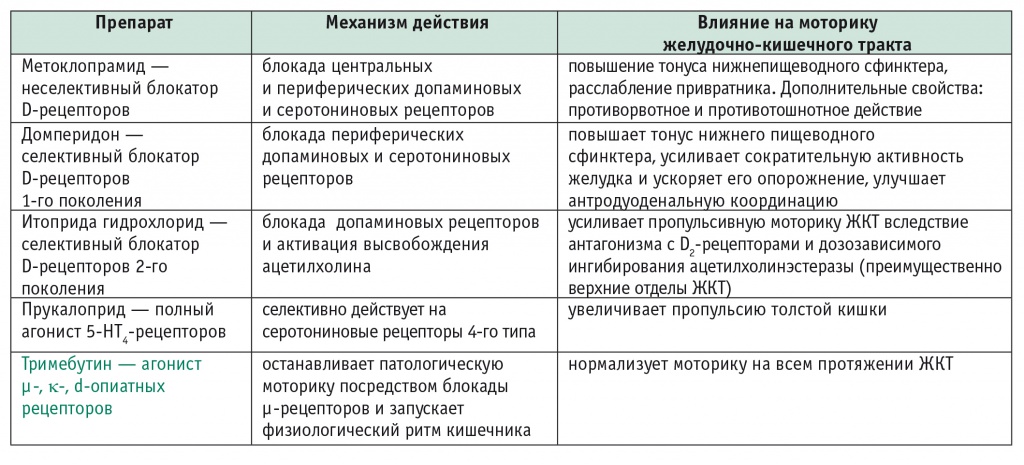
Когда используются прокинетики? В основном в комплексном лечении гастроэзофагеальной рефлюксной болезни, варианта функциональной диспепсии — постпрандиального дистресс-синдрома, а также в симптоматическом лечении тошноты и рвоты. Прукалоприд применяется при запоре в качестве последней линии терапии.
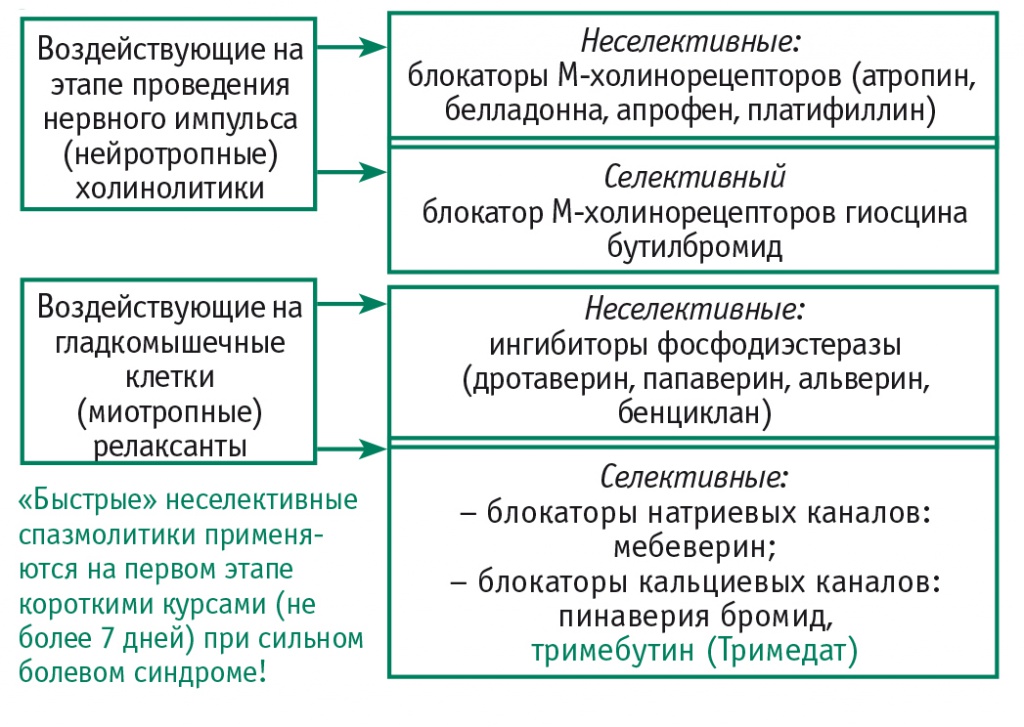
Спазмолитики — это лекарственные средства, которые снижают тонус скелетной мускулатуры, уменьшают двигательную активность. Расслабление гладкомышечных клеток способствует купированию боли и восстановлению пассажа. Существуют различные пути предотвращения сокращения мышечного волокна. Можно блокировать передачу импульса, воздействуя на холинорецепторы на преганглионарном и постганглионарном уровнях с помощью холинолитиков. Однако при этом возможность возбуждения гладкомышечной клетки остается, поскольку в формировании ее сокращения могут участвовать не только ацетилхолин, но и простагландины, тахикинины, выделяющиеся при воспалении. Поэтому полностью снять спазм гладкомышечной клетки с помощью холинолитиков далеко не всегда возможно. Следующий этап сокращения мышечной клетки — это открытие натриевых каналов на самой гладкомышечной клетке. Натриевые каналы блокирует препарат мебеверин, который хорошо известен как селективный спазмолитик. В настоящее время описан такой же эффект для тримебутина.
Далее можно купировать спазм гладкомышечной клетки с помощью селективного блокатора кальциевых каналов пинаверия бромида. Подобный опосредованный эффект на кальциевые каналы производит и тримебутин. Необходимо также отметить блокирующее действие на фосфодиэстеразу 4-го типа в гладкомышечной клетке хорошо известных спазмолитиков альверина и дротаверина. Наконец, еще один путь — регуляция мышечного сокращения посредством воздействия на периферические опиатные μ-, δ- и k-рецепторы, и это один из фармакологических эффектов тримебутина.
Выбор спазмолитического препарата зависит от выраженности болевого синдрома, необходимой длительности его применения и безопасности. При выраженном болевом синдроме, как правило, используются средства парентерального введения, это в основном неселективные миотропные спазмолитики и холинолитики. Что касается курсового лечения, то применяются селективные спазмолитики, работающие только на ЖКТ, — мебеверин, пинаверия бромид и тримебутин (рис. 3).
Рис. 3. Релаксанты гладкой мускулатуры желудочно-кишечного тракта
Но в клинической практике часто возникают случаи, когда гастроинтестинальные расстройства в различных отделах ЖКТ, сопровождающиеся разнонаправленными моторными нарушениями, могут накладываться друг на друга. Описаны такие сочетания, как функциональная диспепсия и СРК, ГЭРБ и функциональная диспепсия, ГЭРБ и СРК и т. д. Многообразие сочетаний подобных синдромов может ставить перед врачом трудные и часто прямо противоположные задачи (например, предполагающие назначение прокинетика и спазмолитика одновременно), что существенно затрудняет выбор адекватного лекарственного препарата для коррекции выявленной патологии. При сочетанных, комбинированных нарушениях в различных отделах ЖКТ препаратом первого выбора выступает тримебутин (рис. 4).
Рис. 4. Фармакологическое действие тримебутина (Тримедата)
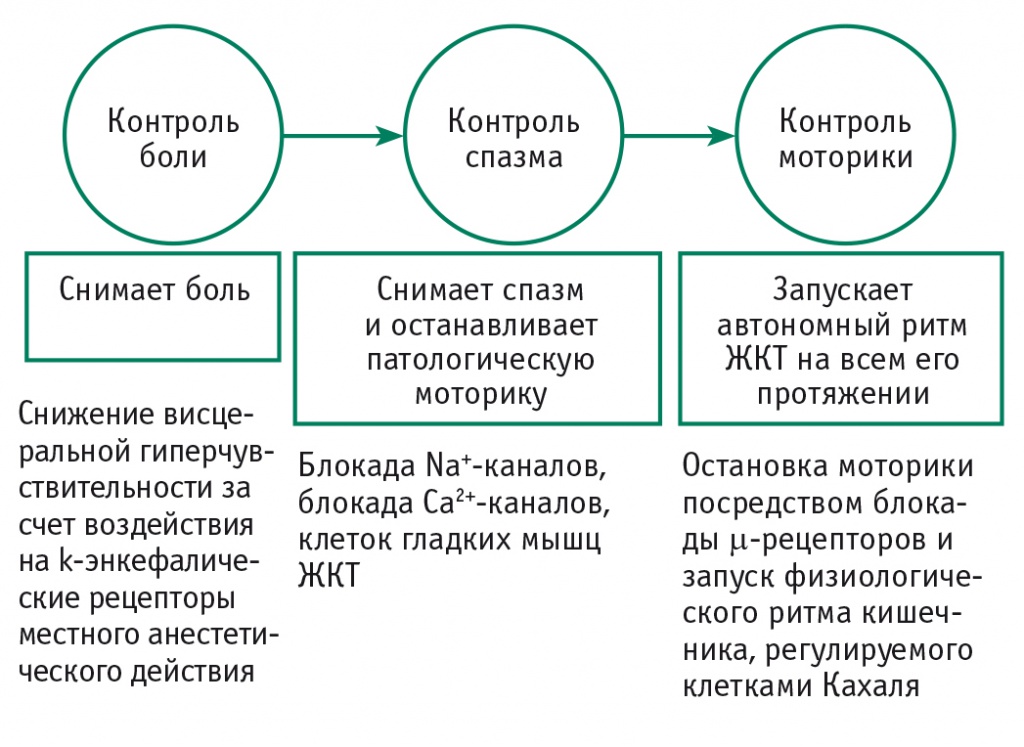
Тримебутин является агонистом периферических μ-, δ- и k-опиатных рецепторов и оказывает модулирующее действие на моторную функцию, которое проявляется в его нормализующих эффектах как при гипо-, так и при гиперкинетических нарушениях на всех уровнях ЖКТ, включая билиарную систему. На сегодняшний день благодаря фармакологическим исследованиям получены данные, уточняющие механизм действия этого препарата. Тримебутин снимает спазм, блокируя Na+- и Ca2+-каналы клеток гладких мышц ЖКТ, останавливает патологическую моторику, блокируя µ-рецепторы, и запускает физиологический ритм кишечника, регулируемый клетками Кахаля. Тримебутин также снижает висцеральную чувствительность за счет воздействия на k-рецепторы — энкефалические рецепторы местного анестетического действия.
Следует еще раз подчеркнуть: тримебутин не только нормализует моторные нарушения в ЖКТ, но и повышает порог болевой чувствительности, что является особенно важным у больных с функциональными нарушениями.
Таким образом, тримебутин, действуя на энкефалинергическую систему, является универсальным регулятором моторики и висцеральной чувствительности. В России препарат выпускается под торговым названием Тримедат®.
Показаниями к назначению Тримедата являются моторные расстройства при функциональных заболеваниях ЖКТ — это и ГЭРБ, и диспепсические расстройства при гастродуоденальных заболеваниях; препарат применяется для купирования болей, нарушений пищеварения, тошноты, рвоты, а также при СРК и при послеоперационной паралитической кишечной непроходимости. Кроме того, Тримедат может использоваться в подготовке к рентгенологическому и эндоскопическому исследованиям: нормализуя моторику ЖКТ, препарат способствует получению более точных и диагностически ценных данных.
Тримедат у взрослых применяется по 200 мг (1 табл.) 3 раза в сутки. Курсовое лечение может составлять от 4 до 6 недель, курсы могут повторяться. Важно, что препарат разрешен к применению у детей с 3 лет, схема приема зависит от возраста ребенка. На сегодня это единственный спазмолитик, разрешенный к применению с трехлетнего возраста.
 |
Минушкин Олег Николаевич Доктор медицинских наук, профессор, заведующий кафедрой гастроэнтерологии ФГБУ «Учебно-научный медицинский центр» Управления делами Президента РФ. Главный гастроэнтеролог Главного медицинского управления Управления делами Президента РФ, заместитель главного терапевта г. Москвы, вице-президент Российской гастроэнтерологической ассоциации |
В 1988 г. в Риме по инициативе участников Всемирного конгресса гастроэнтерологов был создан постоянно действующий Рабочий комитет по функциональным заболеваниям, который возглавил профессор Д. А. Дроссман. Целями создания Комитета и рабочей группы явились изучение механизмов возникновения функциональных расстройств желудка, двенадцатиперстной кишки (ДПК) и кишечника и достижение среди ученых единого понимания этих механизмов; разработка для практических врачей единых согласованных рекомендаций по их диагностике и лечению, которые получили название Римских критериев.
Я подчеркиваю разницу «функциональных расстройств» и «функциональных заболеваний». То, что они не вошли в нашу повседневную практику, — дело времени. Функциональные заболевания характеризуются как «вариабельная комбинация хронических или рецидивирующих симптомов, не объясняемых структурными или биохимическими изменениями». Они не включают в себя хорошо известные расстройства, в своей основе являющиеся вторичными по отношению к структурным/органическим заболеваниям или заболеваниям нервной системы. Диагноз функционального расстройства становится возможным после исключения органической патологии.
По определению Римских критериев III, функциональные заболевания ЖКТ представляют собой клинический продукт взаимодействия психосоциальных факторов и измененной физиологии кишки через ось «мозг — кишка».
Определены общие признаки всех функциональных расстройств:
- продолжительность не менее 3 месяцев в течение последних 6 месяцев;
- отсутствие органической патологии и видимого морфологического субстрата;
- множественный характер жалоб со стороны разных органов, а не только пищеварительной системы;
- существенное снижение качества жизни;
- участие психосоциальных факторов в формировании симптомов;
- функциональные расстройства часто сопровождаются психоневрологическими отклонениями (тревогой, страхом, депрессиями, истерическими реакциями), требующими психокоррекции.
В настоящем сообщении не стоит цель обсудить классификацию, я хочу лишь напомнить о ее существовании. Основным классификационным признаком избран органный. Исходя из этого, выделяют:
- функциональные расстройства пищевода;
- функциональные гастродуоденальные расстройства;
- функциональные расстройства кишечника;
- синдром функциональной абдоминальной боли;
- функциональные расстройства желчного пузыря и сфинктера Одди;
- функциональные аноректальные расстройства;
- функциональные расстройства новорожденных, детей и подростков, которые имеют свои особенности.
Выделение группы функциональных заболеваний дало следующие преимущества:
- избавило больных от активной противовоспалительной терапии;
- обеспечило отсутствие прогрессирования;
- явилось толчком к синтезу препаратов, влияющих либо оказывающих регулирующее воздействие на те или иные расстройства сократительной функции органов пищеварения, т. е. фактически управляющих этими органами.
Согласно Римским критериям II и III, функциональная диспепсия определяется как комплекс расстройств, включающий в себя боль или чувство жжения в подложечной области, чувство переполнения в эпигастрии после еды и раннее насыщение, которые отмечаются у больного в течение последних 3 месяцев (при общей продолжительности жалоб не менее 6 месяцев) и которые не могут быть объяснены органическими, метаболическими или системными заболеваниями. Подчеркнуты признаки, позволяющие отличить функциональную диспепсию от иных функциональных заболеваний, в частности кишечных. При функциональной диспепсии расстройства:
- не уменьшаются после дефекации, что свойственно синдрому раздраженного кишечника;
- не сопровождаются дисфункцией желчного пузыря или сфинктера Одди.
Для лечения функциональной желудочной диспепсии, связанной и с расстройствами моторики, и с изменением чувствительности, в своем наблюдении мы избрали Тримедат®. Препарат относится к группе опиатных пептидов, является агонистом периферических µ-, к-, δ-опиатных рецепторов и влияет на высвобождение желудочно-кишечных пептидов. Его основное действие на ЖКТ состоит в восстановлении физиологической двигательной активности (независимо от характера моторных расстройств). Тримедат изменяет висцеральную чувствительность, уменьшая висцеральную боль.
Исследованы 30 больных (20 женщин, 10 мужчин), средний возраст которых составил 36,8 года. В их числе 25 больных имели функциональную диспепсию. Все пациенты получали Тримедат в суточной дозе 600 мг в течение 28 дней. В исследовании определяли время транзита по карболеновой пробе, оценивали динамику метаболитов кишечной микрофлоры, состояние которой зависит от моторики кишечника.
Результаты лечения. На седьмой день симптомы были купированы у 9 больных; через 2 недели — у 11 и значительно уменьшились у 9; через 2,5 недели симптомы были купированы у 27 больных. У 3 пациентов симптомы значительно уменьшились, но периодически возобновлялись на протяжении всего исследования. По всей вероятности, здесь имел место перекрест симптомов. Именно перекрестные функциональные нарушения не позволили получить эффект у всей группы больных.
В таблице представлены средние показатели электрической активности (мощности сокращений), а также коэффициента ритмичности, которые отражают восстановление моторики — не только верхних отделов ЖКТ, но кишечника в целом.
Таблица
Средние показатели электрогастроэнтерографии для различных отделов желудочно-кишечного тракта на фоне лечения Тримедатом
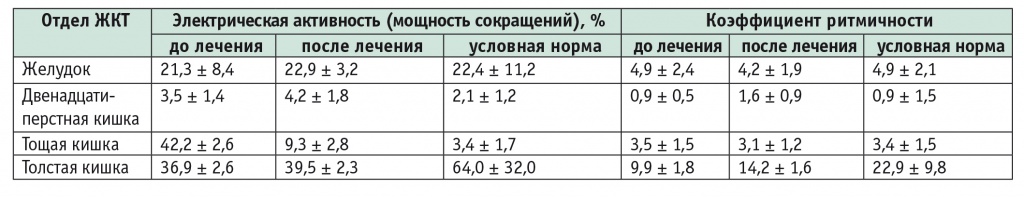
После лечения Тримедатом показатели электрической активности тощей кишки и ДПК выравниваются. Моторика толстой кишки улучшается, повышается коэффициент ее ритмичности. Отмечены также положительные сдвиги в экосистеме толстой кишки, заключающиеся в тенденции к восстановлению (в ряде случаев — в восстановлении) качественного (родового) состава микроорганизмов, соотношения аэробных/анаэробных популяций микрофлоры и их протеолитической активности за счет восстановления среды обитания индигенной микрофлоры вследствие нормализации моторно-эвакуаторной функции кишечника.
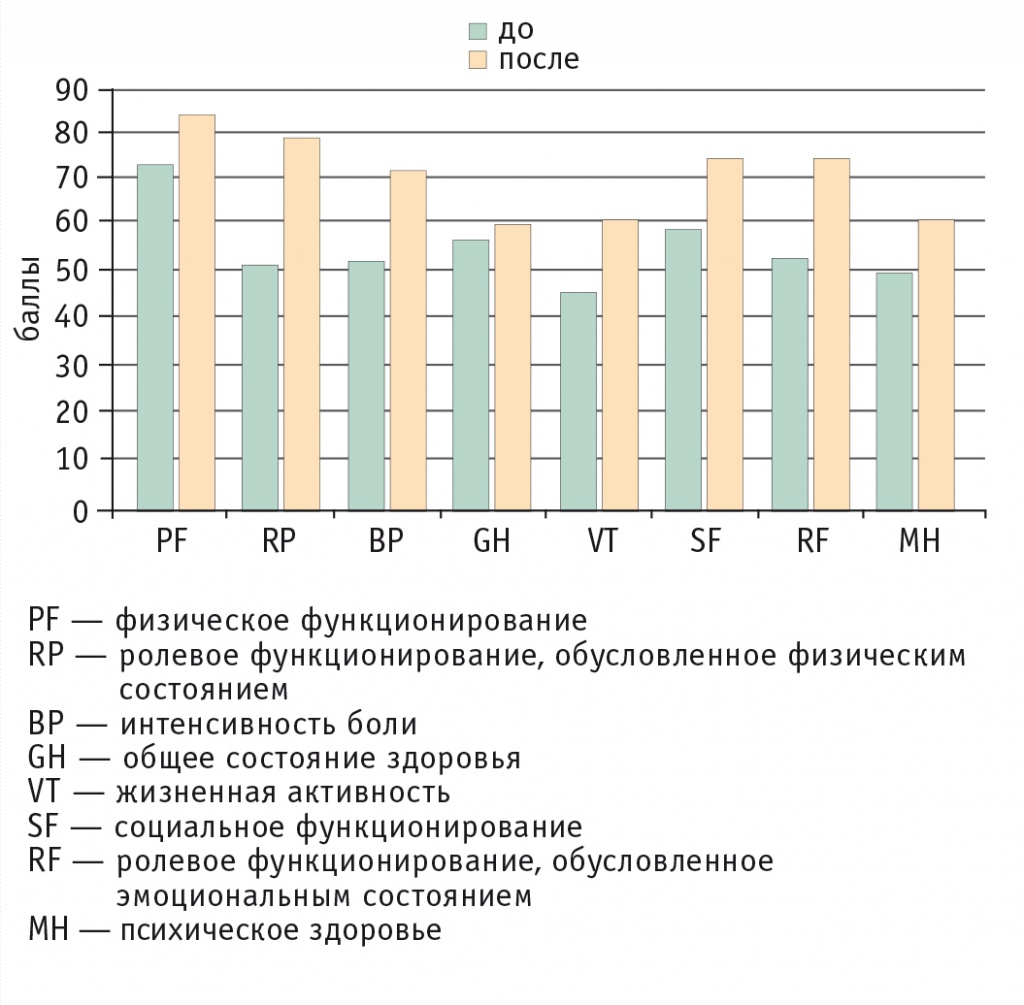
На рисунке отражено улучшение качества жизни наших пациентов по всем шкалам.
Рис. Показатели качества жизни по опроснику SF-36 до и после лечения Тримедатом
Выводы:
- Тримедат эффективен в купировании функциональной диспепсии. Его эффективность, по нашим данным, составляет 90%;
- механизм действия препарата связан с восстановлением моторных взаимоотношений «желудок — ДПК» и чувствительности рецепторов (снимает гиперчувствительность);
- одновременно с купированием симптомов функциональной диспепсии нормализуется моторика кишечника, отмечается восстановление кишечной микрофлоры (по уровню ее метаболитов).
Современные подходы к лечению функциональных расстройств желудочно-кишечного тракта
 |
Яковенко Эмилия Прохоровна Доктор медицинских наук, профессор, академик РАЕН, профессор кафедры гастроэнтерологии факультета усовершенствования врачей ГБОУ ВПО «Российский национальный исследовательский медицинский университет имени Н. И. Пирогова» Минздрава России, г. Москва |
Для синдрома раздраженного кишечника (СРК) характерно наличие рецидивирующей абдоминальной боли со спектром интенсивности от легкого дискомфорта и терпимой ноющей до интенсивной схваткообразной. При этом абдоминальная боль или дискомфорт возникают на протяжении не менее чем 6 месяцев перед постановкой диагноза, не реже 3 дней в месяц за последние 3 месяца. Таким образом, у пациента в течение последних 3 месяцев должно быть не менее 9 эпизодов болей в животе. Эти боли, как правило, стихают или уменьшаются после дефекации и отхождения газов и не беспокоят по ночам. Боли часто сочетаются с вздутием и растяжением живота, усилением перистальтики кишечника, а главное, с изменением частоты стула и формы кала. При наличии запора кал становится плотным или бобовидным, при диарее — разжиженным или водянистым. В зависимости от формы кала выделяют клинические варианты данного заболевания.
При варианте СРК с запором у пациента возникают эпизодические боли в животе, при более чем 25% актов дефекации отмечается твердый или бобовидный кал. В то же время у данного больного может быть кал разжиженной или нормальной консистенции, но менее чем в 25% опорожнений кишечника от общего числа.
Диагноз СРК с диареей выставляется в том случае, если у пациента наряду с вышеуказанным болевым синдромом имеется разжиженный или водянистый кал при более чем 25% актов дефекации. В то же время у данного больного может быть твердый или бобовидный кал или даже кал нормальной консистенции, но менее чем в 25% опорожнений кишечника от общего числа.
При СРК смешанного типа одновременно с болями в животе имеется чередование нарушений стула с наличием твердого либо бобовидного кала при ≥ 25% или неоформленного (кашицеобразного) либо водянистого кала при ≥ 25% опорожнений кишечника из общего числа.
Неклассифицированному СРК свойственно наличие абдоминальных болей и нарушений формы кала, однако недостаточная выраженность отклонений консистенции стула не позволяет идентифицировать один из вышеуказанных типов СРК.
При анализе жалоб и анамнеза пациента врачу, как правило, трудно рассчитать процентное соотношение форм кала в общем числе опорожнений кишечника за определенный промежуток времени. Но больной четко ощущает, какая форма кала у него преобладает или с какой частотой она чередуется. В связи с этим в идентификации клинических форм СРК необходимо учитывать и мнение пациента.
СРК — это функциональное заболевание, проявляющееся комплексом моторно-секреторных расстройств в отсутствие органической патологии в кишечнике. В то же время при СРК могут выявляться и другие функциональные, а в ряде случаев и органические заболевания органов пищеварения, которые длительное время сосуществуют. Комплекс клинических признаков, подобных СРК, которые имеют место при органических заболеваниях кишечника и других заболеваниях ЖКТ, предложено обозначать термином «СРК-подобные нарушения» с указанием типа (с запором, с диареей, смешанного или недифференцированного типа). При формулировке диагноза на первое место выставляется заболевание с наличием органической патологии, а затем — СРК-подобное нарушение с указанием его типа. Термин «СРК-подобные нарушения» впервые был предложен F. Farrokhyar, J. K. Marshall, B. Easterbrook и соавт., которые выявили симптомы СРК у пациентов с язвенным колитом в период ремиссии, подтвержденной эндоскопическими и морфологическими исследованиями. Безусловно, СРК-подобные нарушения требуют лечения, чтобы поддержать хорошее качество жизни больного.
Если у пациента есть два функциональных заболевания или более в различных органах ЖКТ, их обозначают как синдром перекреста данных патологических процессов. Например, у пациента имеется симптоматика любого из типов СРК при отсутствии органических изменений в тонкой и толстой кишке. В то же время у данного больного есть симптомы функциональной диспепсии по типу постпрандиального дистресс-синдрома или эпигастральной боли без структурных изменений в слизистой оболочке желудка. В данном случае приемлем термин «синдром перекреста двух функциональных заболеваний». На первое место выставляем диагноз с более выраженными симптомами и при выборе терапии следим, чтобы используемые препараты не снижали терапевтические эффекты друг друга.
Подходы к диагностике и лечению СРК-подобных расстройств строятся по тем же принципам, что и при СРК, но с учетом основного заболевания, на фоне которого формируются эти расстройства.
В ведении пациентов с СРК ведущая роль принадлежит патогенетической терапии. Традиционно в качестве основных звеньев патогенеза СРК рассматриваются:
- изменения моторной функции кишечника, включающие гипермоторную и/или спастическую дискинезию;
- повышение висцеральной чувствительности рецепторов кишечника к нейромедиаторам, гастроинтестинальным гормонам, метаболитам и др.;
- нарушение количественного и качественного состава кишечной микрофлоры, включая наличие условно-патогенных штаммов;
- психосоматические нарушения, реализующиеся по оси: мозг — кишечник — мозг.
Прежде чем назначать лекарственные препараты для нормализации тонуса и моторной активности гладкой мускулатуры кишечника, необходимо оценить состояние моторики во всех отделах ЖКТ, причем очень часто выявленные нарушения имеют разнонаправленный характер: в одной зоне гипомоторная, в другой — гипермоторная дискинезия. Такие разнонаправленные нарушения моторики требуют подбора препарата, который нормализовал бы моторику ЖКТ независимо от ее исходного состояния.
В механизмах формирования висцеральной гиперчувствительности ведущую роль играет повышение давления в просвете кишки. Кроме того, имеют значение изменение химизма кишечного содержимого, и в первую очередь появление патологической кишечной микрофлоры, продуктов ее жизнедеятельности, а также развитие иммунного воспаления в слизистой оболочке.
Следующий механизм формирования СРК — нарушение нормального состава кишечной микрофлоры. Оказалось, что у очень многих больных СРК развивается после перенесенных кишечных инфекций, которые могут протекать в легкой форме. Эти кишечные инфекции опасны тем, что они изменяют состав нормальной кишечной микрофлоры с развитием избыточного бактериального роста в тонкой кишке и толстокишечного дисбиоза. В настоящее время в специальную нозологическую форму выделен постинфекционный синдром раздраженной кишки.
Определенное значение в формировании СРК принадлежит психосоматическим нарушениям, реализующимся по оси: мозг — кишечник — мозг. Однако медикаментозная коррекция психосоматических нарушений проводится тогда, когда имеются убедительные доказательства, что стрессовые и психологические факторы способствуют появлению симптомов СРК.
Основная задача в терапии СРК и СРК-подобных нарушений сводится к нормализации тонуса и моторной активности гладкой мускулатуры кишечника, с нарушением которых связаны формирование болевого абдоминального синдрома, изменение частоты стула и консистенции кала, а также повышение висцеральной чувствительности кишечника.
Для нормализации моторных нарушений и купирования боли препаратами выбора признаны спазмолитики. В связи с тем что у значительной части пациентов имеются разнонаправленные нарушения моторики ЖКТ, препаратом первого выбора является тримебутин (Тримедат®), который признан универсальным регулятором моторики всех отделов пищеварительного тракта. Тримебутин является агонистом периферических опиатных рецепторов, как замедляющих (k), так и стимулирующих (δ, µ) моторную функцию ЖКТ. Доказано модулирующее влияние тримебутина на моторную функцию ЖКТ, которое проявляется в его нормализующих эффектах как при гипо-, так и при гиперкинетических нарушениях моторики на всех уровнях ЖКТ. Тримебутин снижает висцеральную гиперчувствительность слизистой ЖКТ (повышает порог болевой чувствительности, модифицирует оценку боли, уменьшает чувствительность к медиаторам воспаления).
Свыше 70% пациентов с СРК и СРК-подобными нарушениями имеют признаки, свидетельствующие о нарушении состава кишечной микрофлоры, а также о транслокации бактерий во внутреннюю среду (выраженный метеоризм, болезненные урчащие кишечные петли, болезненность при пальпации брыжейки тонкой кишки, наличие лимфангиэктазий в двенадцатиперстной кишке (ДПК) и тонкой кишке, появление в моче кишечных бактерий и др.). Для нормализации кишечной микрофлоры рекомендуется использовать кишечные антисептики (1–2 курса продолжительностью 7–10 дней). Препараты первого выбора (назначается один из препаратов): рифаксимин 200 мг 3–4 раза в день, нифуроксазид 200 мг 3 раза в день, фуразолидон 100 мг 3 раза в день, метронидазол 250 мг 3 раза в день, ципрофлоксацин 250–500 мг 2 раза в день. При диарее любой из вышеуказанных препаратов целесообразно сочетать с препаратами висмута, например с Де-Нолом (120 мг 4 раза в день или 240 мг 2 раза в день за 0,5 часа до еды 2–4 недели). По окончании антибактериальной терапии назначаются мультиштаммовые или мультивидовые пробиотики, например Бифиформ, РиоФлора Баланс Нео или РиоФлора Иммуно Нео, в среднем на 2 недели. Можно использовать кишечные адсорбенты, особенно на период антибактериальной терапии (рис. 1).
Рис. 1. Примерная схема терапии у больных с синдромом раздраженного кишечника с диареей

При терапии СРК с запором следует учитывать, что в основе его лежит спастическая дискинезия толстой кишки. Следовательно, больным назначается спазмолитик, и препаратом первой линии является тримебутин (Тримедат). Одновременно необходимо использовать лекарственные средства, разжижающие консистенцию кала. Лучшее действие оказывают слабительные коктейли на основе Мукофалька или Форлакса. Как правило, достаточно двух пакетиков каждого средства. Первый пакетик растворяется обычной водой, а второй лучше растворить минеральной магнезиальной водой, принимать через день после ужина с часовым интервалом между ними. При недостаточном слабительном эффекте во второй пакетик следует дополнительно добавить лактулозу от 10 до 20 мл или натрия пикосульфата 7–10 капель. Далее проводится терапия кишечными антисептиками с использованием в первую очередь метронидазола (рис. 2).
Рис. 2. Примерная схема терапии у больных с синдромом раздраженного кишечника с запором

В патогенезе функциональных нарушений ДПК (как первичных, так и возникающих при заболеваниях билиарно-панкреатической системы) ведущее значение имеют моторные расстройства с развитием дуоденальной гипертензии, а также избыточный бактериальный рост в тонкой кишке. Основными проявлениями дуоденальной гипертензии являются:
- горечь во рту;
- чувство быстрого насыщения;
- тяжесть и боли в эпигастрии, появляющиеся или усиливающиеся сразу после еды, часто опоясывающие;
- обильные воздушные отрыжки или срыгивания горького содержимого;
- тошнота, реже рвота желчью;
- при пальпации определяются болезненность и урчание в проекции ДПК (центр эпигастральной области, а также справа и слева от позвоночника);
- высокое давление в ДПК провоцирует спазм сфинктера Одди с развитием функциональных нарушений сфинктера Одди и желчного пузыря.
В терапии данных нарушений ведущая роль отводится средствам, нормализующим дуоденальную моторику, и данном случае препаратом выбора является тримебутин (Тримедат) (рис. 3).
Рис. 3. Схема терапии дуоденостаза с наличием микробной контаминации двенадцатиперстной кишки

Деконтаминация ДПК — важным компонент терапии, позволяющий снизить интрадуоденальное давление, купировать воспалительные процессы в слизистой оболочке и, наряду с тримебутином, нормализовать функцию желчного пузыря и сфинктера Одди.
Анализ приверженности пациентов лечению показал, что если больному назначаются более трех препаратов и по 3 раза в день или более, то большинство из них принимают максимум три препарата. Поэтому лучше назначать максимум три препарата, по возможности с двукратным приемом, и лишь по завершении данного курса продолжить курсовое лечение. Облегчите больному выполнение ваших рекомендаций — и результат порадует и вас, и пациента.








