Одной из наиболее важных проблем дерматологии остается поражение кожи и ее придатков микотической инфекцией. Показатель инфицированности патогенными грибами населения России составляет 30–40%, а по данным ВОЗ, каждый четвертый житель Земли поражен грибковыми инфекциями[1]. Известно, что 18–40% всех заболеваний ногтевых пластинок, приводящих к разрушению последних и, соответственно, к снижению качества жизни и работоспособности составляют онихомикозы[4]. Среди патогенных и условно-патогенных грибов, вызывающих поражение ногтевых пластин, доминирующее положение занимают дерматомицеты[7]. Это подтверждено известным международным исследованием «Ахиллес», проведенным в РФ в 1997–2002 гг.[8], проектами «Горячая линия» и «Онихоиндекс»[10]. Показано, что на долю онихомикозов и микозов стоп приходится три четверти всех регистрируемых форм дерматофитий. Дерматофиты, являясь основными возбудителями онихомикозов (68,3–90,7% случаев), большей частью представлены Trichophyton rubrum[6].
Классификация микозов и онихомикозов. При верификации диагноза выделяются:
- четыре формы микозов стоп:
- сквамозная;
- сквамозно-гиперкератотическая;
- интертригинозная;
- дисгидротическая;
- три типа онихомикозов в зависимости от толщины пораженного ногтя (Ариевич А. М., 1976)[9]:
- нормотрофический (толщина и конфигурация ногтевой пластинки сохраняются, изменяются лишь ее цвет и прозрачность);
- гипертрофический (ногтевая пластинка существенно утолщается за счет подногтевого гиперкератоза);
- атрофический (истончение ногтевой пластинки).
Для успешной диагностики грибковых поражений ногтей необходимо подробно изучать анамнез и проводить лабораторные исследования: микроскопическое и культуральное.
В целях объективной оценки тяжести грибкового поражения ногтей, учитывая его клинико-патогенетические особенности и физиологические характеристики ногтя, А. Ю. Сергеевым и Ю. В. Сергеевым предложен индекс КИОТОС, в основу которого положены наиболее значимые клинические характеристики онихомикозов (клиническая форма, выраженность подногтевого гиперкератоза при дистальной форме, степень вовлечения ногтя, т. е. длина пораженной дистальной части ногтя от свободного края) и факторы поражения, определяющие скорость роста ногтя: локализация (кисти, стопы), возраст пациента[8–10]. Индекс является универсальной основой принятия терапевтических решений при онихомикозах; он позволяет определить подход к лечению, основываясь на объективных клинических характеристиках заболевания, и установить приблизительную продолжительность системной терапии.
Лечение. Лечение микозов и онихомикозов предполагает этиотропную терапию, включающую использование системной, местной терапии и ряда немедикаментозных методов лечения. Результативность лечения определяется достаточной концентрацией препарата в структурах ногтевого аппарата, в том числе после окончания лечения.
Применение системной терапии в составе комбинированного лечения позволяет уменьшить дозы и сократить сроки назначения системного препарата, что снижает вероятность развития побочных эффектов. Показания к системной терапии определяются клинической формой онихомикоза, ее эффективность — противогрибковой активностью, спектром действия, фармакокинетикой и профилем безопасности препарата.
В связи с риском побочных или токсических явлений применение системной терапии не рекомендуется в случаях:
- многомесячного приема препаратов, высокая концентрация которых снижает активность цитохрома CYP3A4, с помощью которого они метаболизируются, являясь не только субстратом, но и ингибитором этого печеночного фермента (с чем связан более выраженный гепатотоксический эффект)[5];
- беременности и лактации;
- наличия коморбидной патологии (заболеваний ЖКТ или билиарной системы) и лекарственной аллергии.
По данным исследований, побочные эффекты антимикотиков реализуются разнородными клинико-морфологическими лекарственными повреждениями, обусловливая развитие острой и фатальной печеночной недостаточности не только на фоне имеющейся коморбидной патологии (заболевания печени, системные заболевания, состояния при приеме статинов или других гепатотоксических препаратов), но и в ее отсутствиеV[13, 14].
Систематический обзор и метаанализ рандомизированных контролируемых исследований (выполненных на Тайване и в США), результаты которых были опубликованы в номере Antimicrobial Agents and Chemotherapy (март, 2010), показали, что частота прекращения лечения из-за развития нежелательных лекарственных реакций и возникновения поражений печени у больных с онихомикозом варьировала от 2,2 до 18,8%, повышение сывороточного уровня печеночных ферментов в первые три месяца лечения в 17,4% случаев составило до 9,3%[15]. Причем случаи гепатотоксичности при применении антимикотиков наблюдаются в первые недели лечения. В связи с этим встает вопрос о проведении противогрибковой терапии под прикрытием лекарственных препаратов, обладающих гепатопротекторным действием, т. е. повышающих устойчивость гепатоцитов к патологическим воздействиям, усиливающих антитоксическую функцию печеночных клеток, способствующих восстановлению их функционального состояния, гомеостаза, устойчивости к воздействию патогенных факторов, стимуляции репаративно-регенерационных процессов (нормализации синтеза и тока желчи).
Одним из перспективных препаратов этой группы является Прогепар — натуральный гепатопротектор для комплексной терапии хронических, токсических гепатитов, жировой дистрофии печени, цирроза печени, гепатопатий разного генеза, содержащий пять основных компонентов: гидролизат печени, цианокобаламин, цистеин, холин и миоинозитол[11].
Самым важным компонентом препарата Прогепар признан гидролизат печени, в состав которого входят незаменимые микроэлементы, аминокислоты, олигопептиды, нуклеозиды. Холин и миоинозитол являются донаторами, а цианокобаламин — переносчиком метильных групп, необходимых для синтеза фосфолипидов, цистеин выступает донатором сульфгидрильных групп, необходимых для осуществления обезвреживающей функции и работы системы антиоксидантной защиты. Микроэлементы могут оказывать гепатопротекторное воздействие: к элементам, поддерживающим функцию печени, относятся Al, Cr, Fe, Mg, Se, Zn, Mn, V, Cu, Co; к элементам, способствующим восстановлению кроветворения, — Ni, Zn, Cu, Mn, Mo, Co, Fe; к элементам, поддерживающим обмен углеводов, — V, Mg, Br, Cr, Zn, Mn, Se. Особо следует отметить, что Прогепар — источник хорошо усвояемого «органического» хрома, что позволяет покрывать более 50% суточной потребности в этом микроэлементе. В целом микроэлементный состав Прогепара — важная составляющая терапевтического действия лекарственного препарата[8].
Активные компоненты в составе препарата оказывают поддерживающее и защитное терапевтическое действие при лекарственных интоксикациях, лучевой болезни, терапии цитостатиками. Опыт применения Прогепара у больных жировой болезнью печени, хроническим персистирующим гепатитом, токсическим гепатитом алкогольной этиологии показал, что прием препарата приводит к уменьшению цитолитического воспалительного синдрома[2], к интенсификации репаративных способностей печеночной ткани и процессов I и II стадий детоксикации. Результаты применения Прогепара в клинике подтверждают наличие у препарата гепатопротекторных эффектов и расширяют возможности его клинического применения, в том числе в дерматологии.
В связи с тем, что на сегодняшний день нет единого мнения о том, когда (до или после противогрибковых курсов) следует назначать гепатопротекторы для уменьшения и профилактики побочных эффектов антимикотической терапии, не разработаны четкие критерии использования (возможность и целесообразность) противогрибковых средств у лиц с исходной патологией ЖКТ, нами было проведено исследование применения препарата Прогепар у больных с грибковыми поражениями кожи и ее придатков (онихомикозом). Исследование соответствовало этическим стандартам локального этического комитета, разработанным на основе «Правил клинической практики в Российской Федерации» согласно Федеральному закону от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств». Все пациенты дали письменное информированное согласие на участие в исследовании.
Целью настоящего исследования явилось изучение динамики биохимических показателей печени, данных УЗИ органов брюшной полости, а также частоты и характера нарушений микрофлоры кишечника у больных микозами стоп и онихомикозом в процессе комбинированной (системной и местной) антимикотической терапии на фоне гепатопротекции (препарат Прогепар).
МАТЕРИАЛЫ И МЕТОДЫ
В исследовании приняли участие 42 пациента, средний возраст которых составил 49,9 ± 18,3 года. Мужчин было 12 (28,6%), женщин 30 (71,4%). Срок заболевания варьировал от 5 до 10 лет.
Критериями включения в исследование были: возраст 18 лет и старше, наличие верифицированных интертригинозной и сквамозно-гиперкератотической форм микоза стоп с онихомикозом (подтвержденных лабораторно: микроскопически и культурально).
Согласно дизайну исследования в зависимости от варианта лекарственной терапии и активности печеночных ферментов (АСТ и АЛТ) больные были разделены на три группы:
- 1-я группа (n = 12) — больные микозом стоп с онихомикозом, получавшие только противогрибковую терапию;
- 2-я группа (n = 16) — больные с уровнем трансаминаз в пределах референтных значений, получавшие Прогепар в комбинации с противогрибковой терапией;
- 3-я группа (n = 14) — больные с уровнем трансаминаз, превышавшим нормальные значения, которые получали Прогепар в комбинации с противогрибковой терапией.
Группы были сопоставимы по основным клинико-демографическим параметрам.
В качестве антимикотика пациенты получали итраконазол методом пульс-терапии: по 400 мг/сут в течение недели с последующим 3-недельным перерывом в течение 3–5 туров терапии. Наружно применялись противогрибковые кремы и мази. В качестве гепатопротектора назначали Прогепар: по 2 таблетки 3 раза в день во время еды в течение 3 туров лечения.
Оценку безопасности и эффективности лечения онихомикоза проводили на основании осмотров пациентов, еженедельных для онихомикозов и ежемесячных для микозов стоп, и оценки динамики физикальных данных, клинических и лабораторных показателей крови с учетом:
- состояния кожи (уменьшение глубины поражения, степени гиперкератоза, шелушения, зуда, трещин, жжения, сухости, гиперемии);
- оценки скорости роста ногтя (усиление роста);
- результатов лабораторной диагностики онихомикозов, включавшей микроскопию патологического материала и получение культуры при его посеве (получение отрицательных результатов исследования после проведенного курса лечения антимикотиками).
Положительными эффектами фармакотерапии считались отрастание от проксимального края неизмененного ногтя бледно-розового цвета; уменьшение глубины поражения, степени гиперкератоза, шелушения, зуда, трещин, жжения, сухости, гиперемии; отрицательные результаты микроскопического и бактериологического методов исследования.
Оценку динамики биохимических показателей функции печени выполняли до начала терапии и после окончания каждого тура лечения. В динамике изучали показатели: АСТ (N = 0–40 Ед/л), АЛТ (N = 0–40 Ед/л), общего белка (N = 65–85 г/л), альбумина (N = 35–53 г/л), общего билирубина (N = 3,4–20,5 мкмоль/л) в сыворотке крови методом SPOT-фотометрии на автоматическом анализаторе Olympus AU640, щелочной фосфатазы (ЩФ) (N = 0–115 Ед/л), гамма-глютамилтранспептидазы (ГГТП) (N = 0–38 Ед/л). В качестве биохимического признака цитолитического синдрома рассматривали повышение в плазме крови уровней аминотрансфераз в 1,5–3 раза; признаками холестатического синдрома считали повышение уровня ЩФ более трех норм, рост уровня ГГТП — более пяти.
Бактериологическое исследование содержимого толстой кишки, при котором степень выраженности дисбактериоза кишечника определялась по классификации Р. В. Эпштейн-Литвак, Ф. Л. Вильшанской (1977), проводили до начала и после окончания медикаментозной терапии, как и УЗИ органов брюшной полости.
Статистическая обработка материала была выполнена с помощью программы WinPepi. Использовалось парное сравнение по медиане непараметрическим методом по критерию Вилкоксона.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Клинически среди больных микозами стоп с онихомикозом поражение кожных покровов было представлено интертригинозной и сквамозно-гиперкератотической формами (табл. 1).
Таблица 1
Распределение больных микозами стоп с онихомикозом по полу, возрасту, продолжительности и форме заболевания
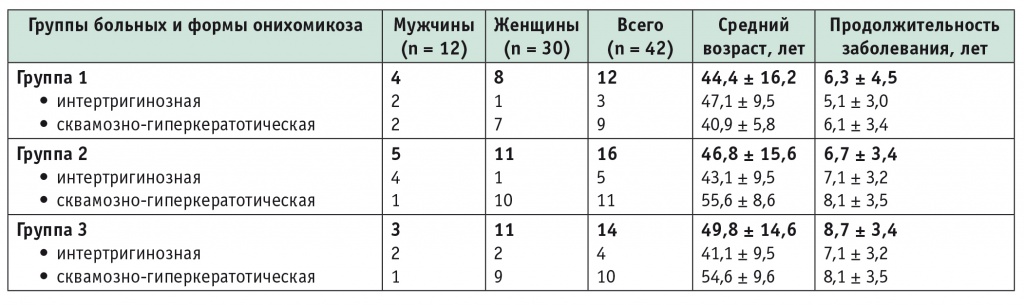
Интертригинозная форма микоза стоп была констатирована у 12 человек, из них у 8 (66,7%) мужчин, 4 (33,3%) женщин. Субъективно больных беспокоили зуд, жжение, болезненность пораженных участков кожи.
Сквамозно-гиперкератотическая форма выявлена у 30 человек, из них у 4 (13,3%) мужчин, 26 (86,7%) женщин. При этом индекс КИОТОС составлял от 9 до 30 баллов, что предполагает назначение системной терапии по схемам для онихомикоза стоп.
Сопутствующая патология ЖКТ и гепатобилиарной системы была выявлена у 76,2% (n = 32) больных (табл. 2).
Таблица 2
Сопутствующие и сочетанные заболевания у больных микозами стоп с онихомикозом
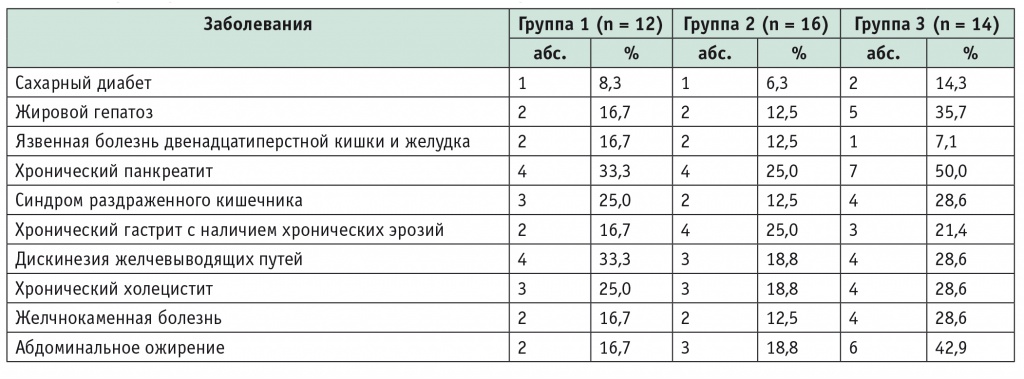
Большая частота таких нозологических форм, как жировой гепатоз, сахарный диабет, хронический панкреатит, абдоминальное ожирение, синдром раздраженного кишечника, отмечена в 3-й группе по сравнению со второй. Кроме того, большинство больных ИБС, продолжительное время принимавших статины, также входили в 3-ю группу (5 человек против двух во 2-й группе), что, наряду с остальной коморбидной патологией, безусловно, вносило свою лепту в исходно «неблагополучный», повышенный фон печеночных трансаминаз и маркеров холестаза. Стаж микотической патологии в 3-й группе превышал 6–7 лет, возраст был выше 49 лет. Пациенты данной группы входили в зону максимального риска в отношении возможности безопасно приступить и полноценно провести системную антимикотическую терапию, не прерывая ее из-за побочных эффектов.
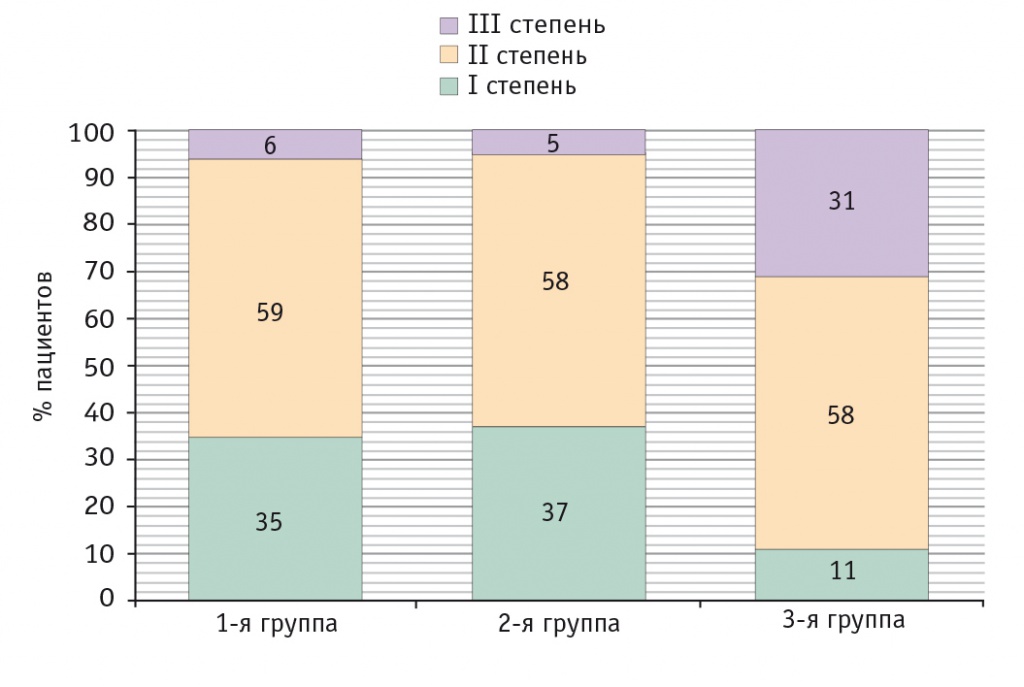
У пациентов с микозом стоп с онихомикозом независимо от наличия жалоб на кишечную диспепсию в 94,3% случаев выявлялись нарушения количественного и качественного состава кишечной микробиоты, что отражалось в результатах исследований кала на дисбактериоз. Они демонстрировали наличие I, II и III степеней отклонения (рис. 1).
Рис. 1. Распределение больных микозами стоп с онихомикозом по степени выраженности дисбактериоза толстой кишки (по классификации Р. В. Эпштейн-Литвак, Ф. Л. Вильшанской, 1977) до лечения, %
Средний уровень общего холестерина крови в 3-й группе оказался выше нормативных показателей, что свидетельствовало о нарушении холестеринового гомеостаза у этих пациентов. У больных 1-й и 2-й групп значимых отклонений указанных параметров от нормы отмечено не было (табл. 3).
Таблица 3
Динамика биохимических показателей крови у пациентов с микозами стоп с онихомикозом в процессе лечения
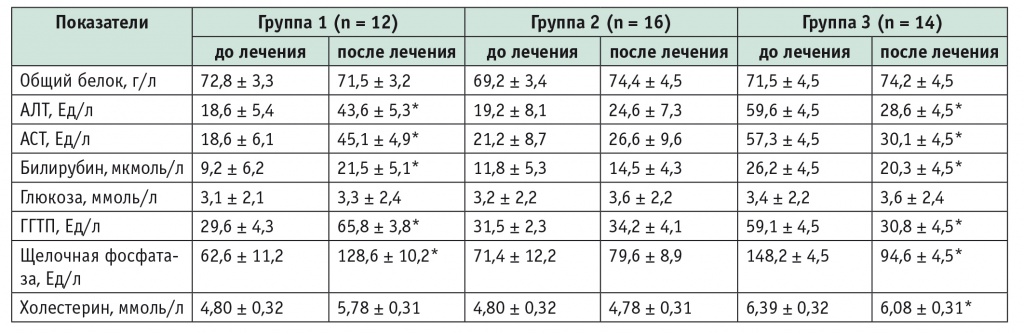
* Статистически значимые различия с показателями до лечения (p < 0,05).
Примечание. АЛТ — аланинаминотрансфераза, АСТ — аспартатаминотрансфераза, ГГТП — гамма-глютамилтранспептидаза.
УЗИ органов гепатобилиарной зоны позволило выявить у больных 3-й группы метаболическую трансформацию печени с признаками жирового гепатоза в 35,7% случаев, увеличением размеров печени с различной степенью гиперэхогенности паренхимы, часто с эффектами «дистального затухания звука» и затруднением визуализации диафрагмального контура. В меньшей степени явления жирового перерождения печени, характеризовавшиеся сглаженным сосудистым рисунком, присутствовали у больных 1-й и 2-й групп.
В процессе проведения системной терапии итраконазолом у большинства больных (у 38 человек, четверо выбыли по неизвестной причине) был получен положительный антимикотический ответ.
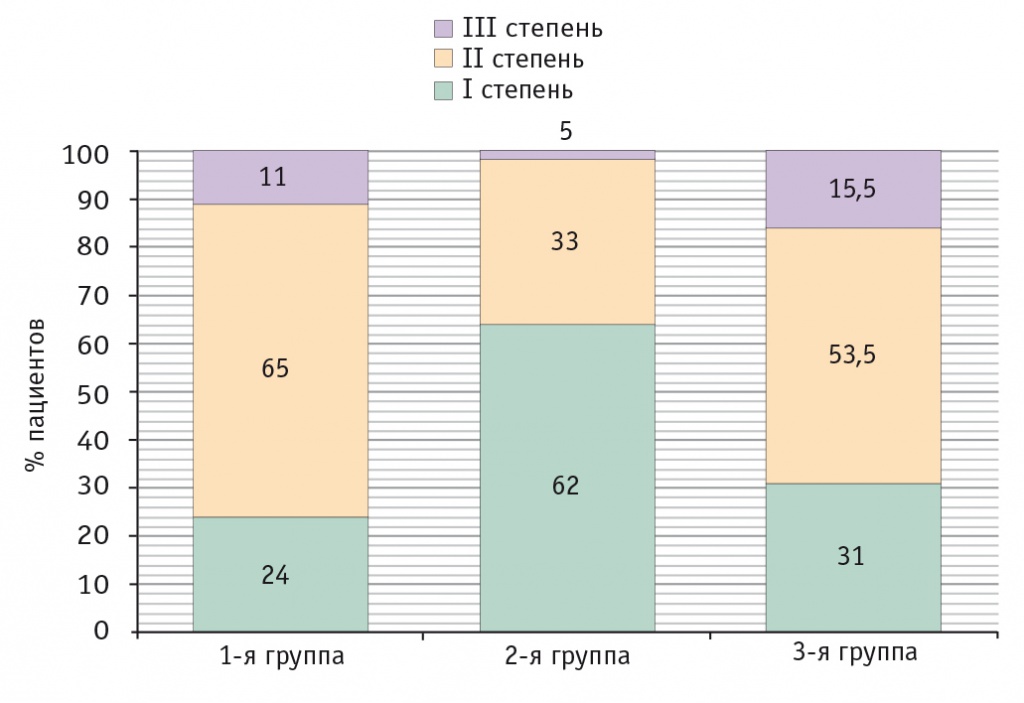
Включение Прогепара в состав комплексной терапии приводило к снижению частоты расстройств со стороны органов пищеварения, способствовало нормализации кишечного микробного гомеостаза и показателей функционального состояния печени. Так, в результате проведенного лечения во 2-й группе дисбиоз II степени у 25% больных перешел в категорию I степени, в 3-й группе число пациентов с III степенью дисбиоза уменьшилось в 2 раза, составив 15,5%, а группа больных с I степенью дисбиоза увеличилась до 31% за счет восстановительных процессов в кишечной микробиоте у больных, изначально имевших II степень тяжести. Динамика дисбактериоза в группе больных без гепатопротекции отличалась: увеличилось число больных со II и III степенью до 65 и 11% соответственно (рис. 2).
Рис. 2. Распределение больных микозами стоп с онихомикозом по степени выраженности дисбактериоза толстой кишки (по классификации Р. В. Эпштейн-Литвак, Ф. Л. Вильшанской, 1977) после лечения, %
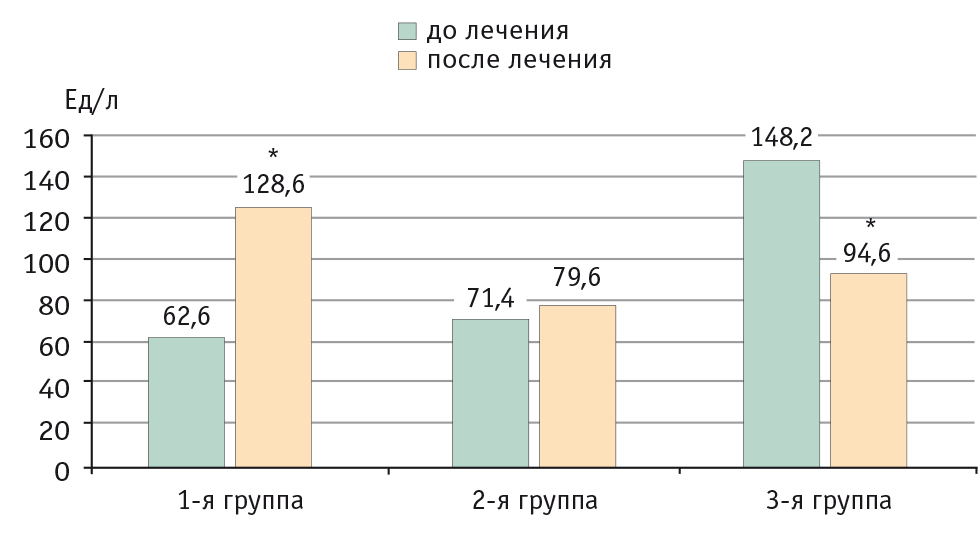
При биохимическом исследовании крови была зафиксирована различная динамика маркеров цитолиза и холестаза в разных группах. Так, в 1-й группе на фоне терапии только итраконазолом в 64% случаев было выявлено статистически значимое повышение уровней ЩФ, АЛТ, АСТ, ГГТП, билирубина в сыворотке крови, что соответствовало I степени гепатотоксичности по Международным критериям токсичности антимикотиков (повышение трансаминаз в 1,25–2,5 раза; повышение уровня билирубина в 1,1–1,5 раза), причем у большинства больных (39,8%) это повышение носило бессимптомный характер, а у остальных регистрировалась клиническая картина синдрома правого подреберья.
Комбинированная терапия (антимикотик + Прогепар) у пациентов 2-й группы позволила предотвратить подьем уровней печеночных трансаминаз и холестатических маркеров в 86,4% случаев по сравнению со статистически значимым повышением уровней маркеров цитолиза и холестаза у больных без гепатопротекции.
В 3-й группе с исходно измененной гепатограммой на фоне пульс-терапии итраконазолом в сочетании с Прогепаром у 60% больных было обнаружено статистически значимое понижение уровней ЩФ (p < 0,005), АЛТ (p < 0,05), АСТ (p < 0,05), ГГТП (p < 0,05), общего билирубина (p < 0,05), т. е. имело место обратное развитие признаков холестаза и цитолиза. У 40% больных выявлена стабилизация указанных лабораторных показателей.
Динамика биохимических показателей крови у всех находившихся под наблюдением пациентов и результаты статистического анализа представлены в таблице 3, на рисунках 3–6.
Рис. 3. Уровни аланинаминотрансферазы в крови у пациентов до и после проведенной трехмесячной терапии, Ед/л.
* P < 0,05
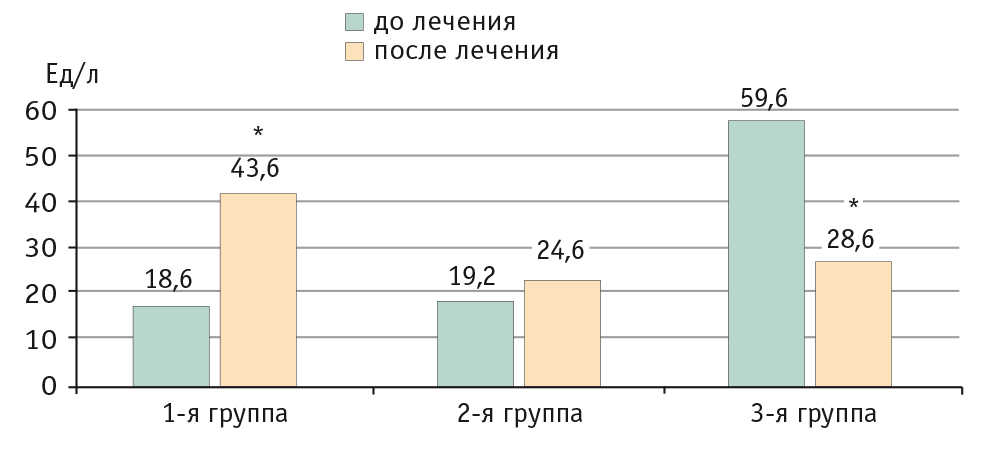
Рис. 4. Уровни аспартатаминотрансферазы в крови у пациентов до и после проведенной трехмесячной терапии, Ед/л.
* P < 0,05
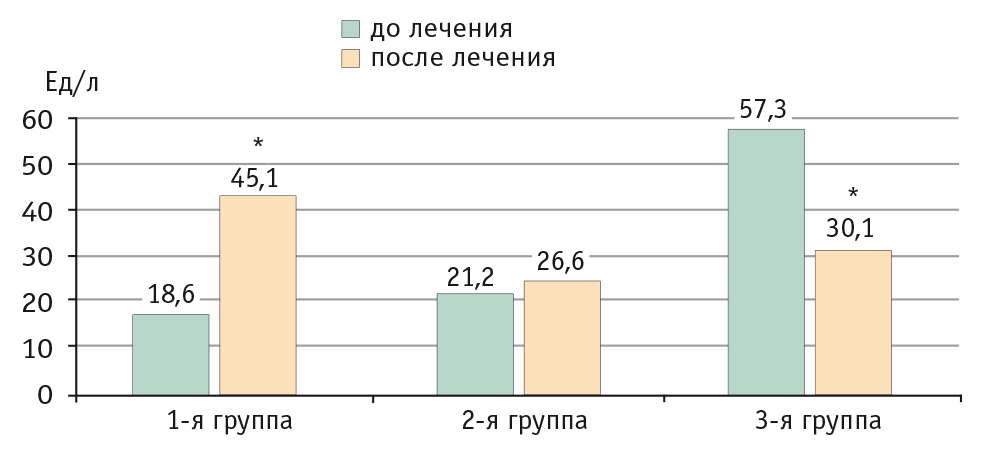
Рис. 5. Уровни гамма-глютамилтранспептидазы в крови у пациентов до и после проведенной трехмесячной терапии, Ед/л.
* P < 0,05
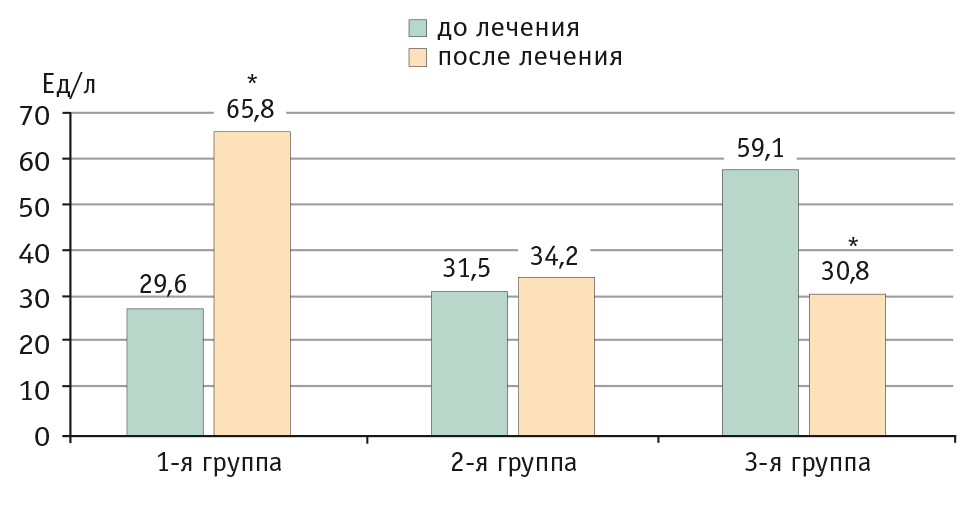
Рис. 6. Уровни щелочной фосфатазы в крови у пациентов до и после проведенной трехмесячной терапии, Ед/л.
* P < 0,05
Проведение контрольного УЗИ показало, что в разных клинических группах наблюдалась различная эхографическая динамика, характеризующая состояние печени. Так, в группах больных с комбинированной терапией отмечалась положительная динамика. Отличительными особенностями приема препарата Прогепар, обладающего гепатопротективным эффектом за счет мембраностабилизирующей, антиоксидантной активности, явились нормализация размеров печени (уменьшение на 18,2%) у 68,6 и 28,6% больных с жировым гепатозом во 2-й и 3-й группах соответственно и изменение акустического импеданса ее ткани в сторону понижения гиперэхогенности, что свидетельствовало об улучшении метаболических и холерических процессов. У больных 1-й группы по окончании курса терапии была отмечена отрицательная эхографическая динамика, что выражалось в повышении эхогенности органа (49,2% случаев) и увеличении его размеров (32,3% случаев).
Выводы
Таким образом, включение препарата Прогепар в стандартный лечебный алгоритм является целесообразной и эффективной альтернативой монотерапии у больных микозами стоп с онихомикозом. Прогепар позволяет значительно улучшить лабораторные показатели функционального и морфологического состояния печени, обладает нормализующим действием на качественный состав кишечной микробиоты, что способствует уменьшению токсического влияния антимикотиков на гепатобилиарную систему, их более эффективному лечебному воздействию благодаря возможности осуществления непрерывных курсов терапии.
ЗАКЛЮЧЕНИЕ
- При исходно повышенных маркерах цитолиза и холестаза рекомендуется проведение антимикотической терапии в комбинации с гепатопротектором.
- Своевременное назначение гепатопротектора позволяет предотвратить дальнейший рост уровней печеночных трансаминаз или обеспечивает их нормализацию.
- У пациентов, входящих в группу риска (возраст старше 50 лет, патология ЖКТ, прием гепатотоксичных препаратов в связи с исходной коморбидной патологией), даже в отсутствие активации маркеров гепатопатии проведение антимикотической системной терапии целесообразно сопровождать гепатопротекцией в виде назначения препарата Прогепар.








