В настоящее время более 200 млн человек во всем мире страдают остеопорозом. Распространенность этого заболевания и переломов, например, позвоночника у женщин старше 50 лет в Европе составляет 30 и 12% соответственно[18], в Российской Федерации (единичные исследования) — 30,5–33 и 7–16% соответственно[2].
Одной из причин нарушений в костной системе могут быть хронические заболевания печени, приводящие к развитию остеодистрофии. По данным различных исследований, печеночная остеодистрофия (ПОД) наблюдается у 20–60% пациентов с прогрессирующими заболеваниями печени[5, 12, 17]. Происхождение ПОД — многофакторное, выраженность нарушений костного обмена варьирует в зависимости от этиологии болезни печени[16]. Согласно общепринятому мнению, у пациентов в терминальной стадии заболеваний печени и/или с выраженным холестазом повышен риск развития остеопороза.
Особенностью гепатогенного остеопороза является то, что нарушение цикла ремоделирования кости может приводить как к ускоренной резорбции, так и к замедленному формированию костной ткани, создавая идеальные условия для прогрессирования остеопороза[7, 10]. Изучению ПОД при аутоиммунных холестатических заболеваниях печени — первичном билиарном циррозе (ПБЦ) и первичном склерозирующем холангите (ПСХ) — посвящено множество работ, однако риск развития нарушений минеральной плотности костной ткани (МПКТ) у пациентов с этими болезнями остается неизученным. Терапия ГКС, используемая при аутоиммунном гепатите (АИГ), а иногда при хронических холестатических заболеваниях печени[1], несомненно, ускоряет потерю костной массы, хотя оценить вклад данного фактора трудно из-за влияния патологии печени как таковой на костный обмен[16, 20].
В 2008 г. экспертная группа по изучению метаболических заболеваний костей ВОЗ (World Health Organization Metabolic Bone Disease Group) на основании возраста, ИМТ и клинических факторов, с использованием показателей МПКТ шейки бедра или без них разработала электронный метод оценки 10-летнего риска переломов (отдельно переломов шейки бедра и основных остеопоротических переломов) Fracture Risk Assessment (FRAX), позволяющий в каждом случае индивидуально принимать решение о необходимости терапевтического вмешательства в процессы костного обмена[15].
В последние годы широко обсуждается роль сывороточных маркеров, в том числе β-изомера С-телопептида коллагена 1-го типа, именуемого также β-кросслапсом, в качестве предикторов риска костных переломов. β-кросслапс — это продукт деградации коллагена 1-го типа, попадающий в кровоток из зоны резорбции органического матрикса. Другим сывороточным маркером костного обмена является остеокальцин — основной неколлагеновый белок, синтезируемый остеобластами при формировании кости.
Цель исследования: изучение отдельных показателей костного обмена и МПКТ поясничного отдела позвоночника и оценка риска развития переломов у пациентов с аутоиммунными заболеваниями печени (АИЗП).
МАТЕРИАЛЫ И МЕТОДЫ
На базе городской клинической больницы № 31 Санкт-Петербурга обследованы 76 женщин и 7 мужчин с АИЗП: с АИГ — 17 женщин; с ПБЦ — 33 женщины и 1 мужчина; с ПБЦ с признаками АИГ (ПБЦ/АИГ) — 22 женщины; с ПСХ — 4 женщины (в том числе три с признаками АИГ) и 6 мужчин. Диагноз устанавливали согласно рекомендациям ведущих гепатологических ассоциаций — Европейской ассоциации по изучению печени и Международной группы по изучению аутоиммунного гепатита[6, 8, 13]. Выраженные стадии фиброза (F3–4 по METAVIR) выявляли у 82,4% пациентов с АИГ, 40,1% с ПБЦ, 66,7% с ПБЦ/АИГ и у 30% с ПСХ. Учитывали дополнительные факторы риска развития остеопороза: менопаузу у женщин и возраст старше 50 лет у мужчин, курение, терапию ГКС (табл. 1).
Таблица 1
Клиническая характеристика и сывороточные лабораторные показатели у обследованных больных (n = 83)
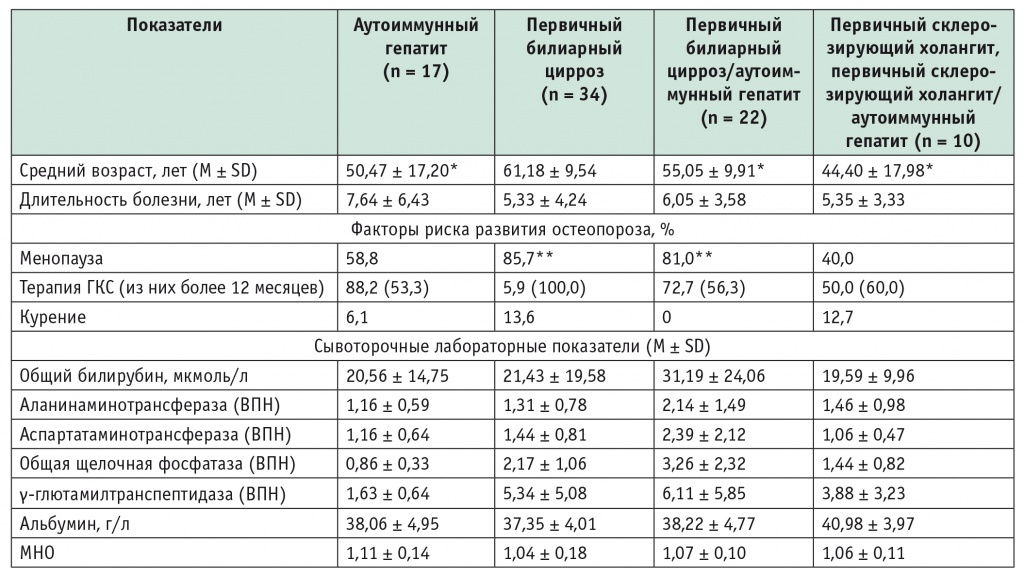
* Отличие от группы первичного билиарного цирроза статистически значимо (р < 0,05).
** Отличие от группы первичного склерозирующего холангита статистически значимо (р < 0,05).
Примечание. ВПН — кратность верхнему пределу нормы, МНО — международное нормализованное отношение.
При холестатических АИЗП все больные получали базисную терапию препаратами урсодезоксихолевой кислоты, а также препараты кальция Д3 с момента установления диагноза.
В контрольную группу вошли 14 женщин без хронических заболеваний печени старше 45 лет, находившихся в периоде менопаузы.
В сыворотке крови иммунохимическими методами определяли маркер формирования кости остеокальцин и маркер активности резорбции костной ткани β-кросслапс с использованием наборов фирмы Immunodiagnostic Systems Ltd (Великобритания) на планшетном иммуноферментном анализаторе Sunrise фирмы Tecan (Австрия). МПКТ поясничного отдела позвоночника (L1–L4) измеряли с помощью двухэнергетической рентгеновской адсорбциометрии (DEXA) на денситометре фирмы Hologic Discovery W (Канада). В соответствии с рекомендациями ВОЗ МПКТ оценивали по критериям Т и Z, основанным на сравнении полученных значений МПКТ с референтными данными. Десятилетний риск основных остеопоротических переломов и переломов шейки бедра рассчитывали с помощью электронного калькулятора FRAX без учета МПКТ[9].
Статистическую обработку данных производили с помощью программы StatSoft Statistica 10. Описание распределений признаков в выборках представлено в виде медианы (M) и стандартного отклонения (SD). Использовали стандартные методы параметрической и непараметрической статистики: χ2-критерий Пирсона, t-критерий Стьюдента и дисперсионный анализ.
РЕЗУЛЬТАТЫ
Биохимические маркеры активности костного метаболизма, показатели МПКТ и абсолютный риск переломов по FRAX приведены в таблице 2.
Таблица 2
Биохимические маркеры активности костного метаболизма, показатели минеральной плотности костной ткани и абсолютный риск переломов при аутоиммунных заболеваниях печени (М ± SD)
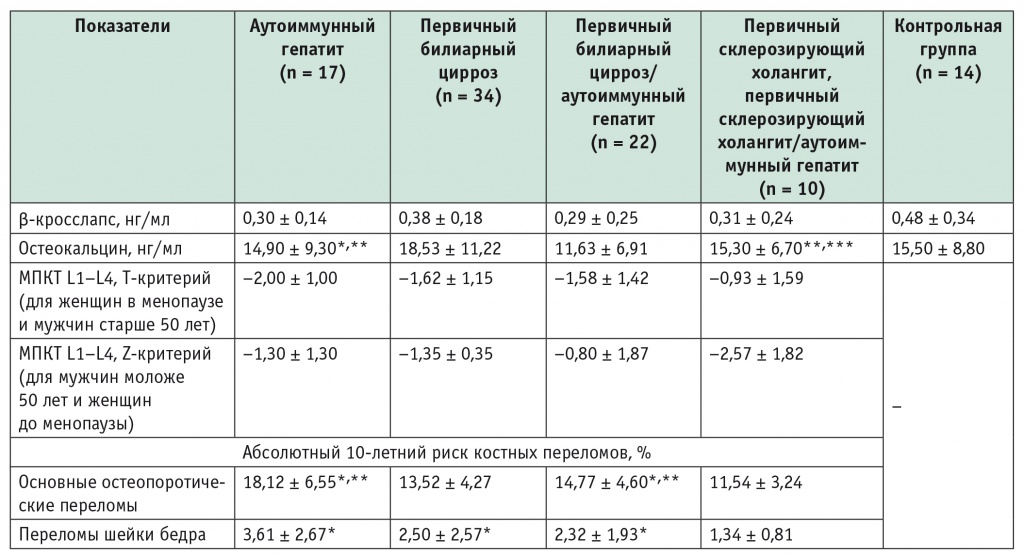
* Отличие от группы первичного склерозирующего холангита, первичного склерозирующего холангита/аутоиммунного гепатита статистически значимо (р < 0,05).
** Отличие от группы первичного билиарного цирроза статистически значимо (р < 0,05).
*** Отличие от группы контроля статистически значимо (р < 0,05).
В группе АИГ остеопороз и тяжелый остеопороз (согласно критериям ВОЗ: T < –2,5 в сочетании с низкотравматичными переломами позвоночника) выявляли в 25,0% случаев каждый, а остеопению — в 16,7% случаев. При ПБЦ и ПБЦ/АИГ тяжелый остеопороз обнаружен у 3 и 15%, остеопороз — у 17 и 10%, а остеопения — у 51 и 36% пациентов соответственно. При ПСХ и ПСХ/АИГ остеопороз и тяжелый остеопороз были у 14% больных в каждой из групп, а остеопения — в 42% случаев. В группе ПБЦ/АИГ различные стадии нарушения МПКТ выявлены у 70% пациентов с повышенным уровнем АСТ против 30% больных с нормальными показателями АСТ на фоне лечения (р < 0,05). Парадоксально, что при ПБЦ у больных с расчетным низким риском переломов шейки бедра (FRAX без учета МПКТ) в 78,9% наблюдений отмечены нарушения МПКТ в поясничном отделе позвоночника различной степени тяжести против 21,1% у пациентов с расчетным высоким риском таких переломов (р < 0,05).
Оценка биохимических маркеров костного обмена показала статистически значимо более низкие уровни сывороточного остеокальцина при АИГ в сравнении с больными ПСХ и пациентами с перекрестным синдромом ПСХ/АИГ. При этом содержание остеокальцина в группах ПСХ и ПСХ/АИГ было статистически значимо ниже, чем при ПБЦ и в группе контроля. Отметим, что у всех больных АИГ со сниженным уровнем остеокальцина показатели аминотрансфераз были в норме, в то время как при нормальных значениях остеокальцина у всех пациентов наблюдался цитолитический синдром. У пациенток с ПБЦ/АИГ обнаружена статистически значимая связь более низких показателей Т-критерия L1–L4 с более высокими значениями сывороточного уровня остеокальцина (r = −0,78, р < 0,05).
Статистически значимых различий в содержании β-кросслапса между группами не выявлено.
ОБСУЖДЕНИЕ
Наши данные подтверждают наличие высокого риска развития костных нарушений при АИЗП. Частота их сопоставима c данными американских ученых K. V. Menon и соавт.[17], P. Angulo и соавт.[5], но расходится с результатами M. M. Guichelaare и соавт.[12], которые показали более высокую частоту ПОД у таких пациентов.
Более тяжелые нарушения МПКТ были обнаружены при АИГ: остеопороз различной степени тяжести зафиксировали в половине случаев. При ПБЦ преобладала остеопения (51%). Отметим, что пациенты с ПБЦ были старше других участников исследования (р < 0,05). У больных ПБЦ/АИГ с лабораторными признаками активности основного заболевания статистически значимо чаще наблюдались нарушения МПКТ различной степени тяжести, что, возможно, объясняется более агрессивным течением основного заболевания либо повышенной потребностью в терапии ГКС.
В ходе оценки абсолютного 10-летнего риска основных остеопоротических переломов в группах исследования статистически значимо более высокие риски выявлены при заболеваниях, в лечении которых применяют ГКС (АИГ и ПБЦ/АИГ). Риски переломов шейки бедра имели прямую связь с возрастом и были статистически значимо ниже при ПСХ, т. е. в группе более молодых людей и с отрицательным менопаузальным статусом. В то же время у пациентов с ПБЦ с низким риском переломов шейки бедра по FRAX (без учета МПКТ) статистически значимо чаще отмечены нарушения МПКТ поясничного отдела позвоночника различной степени тяжести. Мы объясняем данное наблюдение тем, что, как показано шведскими учеными, при ПОД происходит поражение в первую очередь губчатых, а не трубчатых костей[19]. Это следует учитывать при скрининге остеопении и остеопороза.
Для хронического холестаза характерен синдром мальабсорбции кальция и витамина Д[1]. Развитие гипокальциемии способствует повышению секреции паратгормона, который оказывает ингибирующее действие на зрелые остеобласты. Активный метаболит витамина Д кальцитриол влияет на дифференциацию остеобластов, модулируя экспрессию генов, отвечающих за синтез коллагена 1-го типа и остеокальцина.
ГКС также оказывают прямое подавляющее действие на остеобласты и дополнительно угнетают кишечную абсорбцию кальция[4]. Кроме того, in vitro показано ингибирующее действие билирубина на пролиферацию остеобластов[14]. Вероятно, именно снижение активности остеобластов объясняет обнаруженные нами более низкие уровни сывороточного остеокальцина у пациентов с неактивным АИГ вследствие длительного использования ГКС.
Наши данные показывают, что холестаз и возраст являются факторами риска развития остеопении, а терапия ГКС оказывает негативное влияние и приводит к клинически значимому остеопорозу.
Нами не выявлено какой-либо связи между нарушениями МПКТ и такими признаками печеночно-клеточной недостаточности, как нарушение белкового синтеза, повышение уровня сывороточного билирубина и МНО.
Известно, что одна из функций остеобластов — синтез белков органического матрикса кости, в основном коллагена 1-го типа и остеокальцина. В нашем исследовании зафиксированы статистически значимо более низкие уровни остеокальцина у пациентов с ПСХ (ПСХ/АИГ) в сравнении с таковыми у больных ПБЦ, несмотря на то что в группе ПСХ (ПСХ/АИГ) выраженный фиброз наблюдался наиболее редко, а менопаузальный статус был отрицательным. Полученные результаты, вероятнее всего, объясняются выраженностью холестаза при данной патологии.
Нами показано статистически значимое снижение содержания сывороточного остеокальцина у пациенток с АИГ в сравнении с больными ПБЦ, что может быть обусловлено длительной терапией ГКС и выраженностью фиброза у большинства женщин с АИГ. В то же время при нарастании тяжести остеопороза при ПБЦ/АИГ отмечено повышение уровня остеокальцина в крови, что, вероятно, отражает усиленную активность остеобластов. Наши данные позволяют предположить, что для биохимического мониторинга процессов развития гепатогенного остеопороза следует использовать именно оценку содержания остеокальцина в сыворотке крови.
В ряде исследований описан рост уровня β-кросслапса при циррозе печени (в том числе при ПБЦ)[3, 21]. По мнению других авторов, повышенные значения β-кросслапса в сыворотке крови у пациентов с хроническими заболеваниями печени отражают не состояние костного обмена, а ускоренный метаболизм коллагена и тяжесть печеночного фиброза[11]. В нашем исследовании из всех участников только у одного мужчины с ПСХ имелось повышенное содержание β-кросслапса в сыворотке крови, при этом не было обнаружено статистически значимых различий по данному показателю между группами. Таким образом, мы не видим значимости данного показателя в оценке процессов костной резорбции у пациентов с АИЗП.
На основании полученных результатов можно предположить, что нарушение костного метаболизма при АИЗП характеризуется преимущественно снижением активности остеобластов, отвечающих за формирование кости, и обусловлено в основном тяжестью холестатического синдрома и проводимой терапией ГКС. При этом группу наибольшего риска при АИЗП составляют больные АИГ, ПСХ и пациенты с их сочетанием.
ЗАКЛЮЧЕНИЕ
У пациентов с аутоиммунными заболеваниями печени (АИЗП), в особенности с аутоиммунным гепатитом (АИГ) при терапии ГКС, повышаются риски развития остеопении, остеопороза и абсолютные риски костных переломов. Для АИЗП характерно также снижение уровня лабораторного маркера формирования кости остеокальцина, выраженное при первичном склерозирующем холангите, АИГ и их сочетании, при отсутствии изменений сывороточного уровня продукта деградации костного коллагена 1-го типа β-кросслапса.








