В последнее десятилетие распространенность сахарного диабета 1 типа (СД-1) у детей и взрослых во всем мире неуклонно растет [3, 9]. СД-1 представляет собой аутоиммунное заболевание с полисистемным поражением организма (патология почек, сосудистого русла, органа зрения и т. д.). Если патология сердца, почек, органа зрения, сосудистые поражения у детей с СД-1 достаточно детально изучены, то патология пищеварительного тракта, в частности желудка, исследована совершенно недостаточно. Опубликованы единичные работы, посвященные поражению желудка у детей с СД-1 [5].
Зарубежные исследования выявили кислотно-пептическую болезнь у 7% детей с СД-1 [12]. У 93,5% из них был установлен диагноз хронического гастрита, у 38,7% — в сочетании с хроническим дуоденитом, а у 35,5% — с язвенной болезнью. Авторы высказали точку зрения, согласно которой дети, страдающие СД-1, принадлежат к группе риска по развитию патологии верхних отделов пищеварительного тракта.
Отечественные авторы выявляли инфекцию Helicobacter pylori (HP) в слизистой оболочке желудка (СОЖ) у детей с СД-1 значительно чаще: в 65–84% случаев [2, 4, 7]. Г. В. Римарчук и соавт. [7] отметили также, что хеликобактериоз чаще обнаруживается у пациентов с давностью заболевания до 5 лет: 77% против 48,8% при впервые выявленном СД-1.
Цель нашей работы — установить частоту встречаемости хронической гастродуоденальной патологии, ассоциированной с HP, у детей с СД-1.
МАТЕРИАЛЫ И МЕТОДЫ
Нами проведены клинические наблюдения и специальные исследования 139 детей, находившихся на стационарном лечении в эндокринологическом и гастроэнтерологическом отделениях ГБУЗ «Республиканская детская клиническая больница» (г. Уфа) (главный врач — заслуженный врач РФ Р. З. Ахметшин). Все пациенты были обследованы в период с 08.01.2009 по 30.12.2014.
В основную группу входили 108 пациентов с СД-1 (61 девочка и 47 мальчиков) в возрасте от 5 до 17 лет (средний возраст — 13,1 ± 1,9 года). В зависимости от длительности заболевания дети с СД-1 были разделены на две подгруппы: I подгруппа — 57 детей с длительностью СД-1 до 5 лет включительно; II подгруппа — 51 ребенок с длительностью заболевания более 5 лет.Все пациенты с СД-1 постоянно получали интенсифицированную инсулинотерапию, включавшую введение ультракороткого аналога инсулина перед едой (инсулин аспарт или инсулин лизпро) и длительно действующего аналога инсулина (инсулин гларгин или инсулин детемир). Средняя суточная доза инсулина составила 0,82 ± 0,12 ЕД/кг.
Группу сравнениясоставил 31 ребенок с хронической гастродуоденальной патологией — 19 девочек и 12 мальчиков, не страдавших СД-1, в возрасте от 5 до 17 лет (средний возраст — 12,7 ± 1,4 года). Дети группы сравнения находились на госпитализации в гастроэнтерологическом отделении ГБУЗ РДКБ (г. Уфа), куда поступили в связи с выраженным диспепсическим синдромом.
Всем больным, поступившим на стационарное лечение, проведено полное клиническое обследование, включавшее изучение жалоб, анамнеза заболевания, а также объективных клинических данных.
Эндоскопическое исследование верхних отделов пищеварительного тракта было осуществлено ззофагогастродуоденоскопом Exera GIF-Q180 (Olympus, Япония). Фиброэзофагогастродуоденоскопия (ФЭГДС) проводилась у пациентов с СД-1 только после достижения компенсации гликемии натощак, до плановой инъекции инсулина. ФЭГДС во всех случаях производили в условиях местной анестезии с использованием 10%-ного спрей-раствора лидокаина (после получения информации об отсутствии непереносимости препаратов этого ряда).
При наличии признаков воспаления биопсийный материал брали из мест с максимально выраженной гиперемией и отеком. Его забирали из СОЖ у всех больных с признаками ее воспаления. Биопсийный материал получали из тела желудка (2 фрагмента), антрального отдела (2 фрагмента), из дна желудка (1 фрагмент).
Взятый в ходе ФЭГДС материал СОЖ и слизистой оболочки двенадцатиперстной кишки направляли на гистологическое исследование, 1 биоптат антрального отдела желудка изучался для обнаружения HP. Эндоскопическую диагностику HP проводили с использованием уреазного теста ХЕЛПИЛ (ООО АМА, г. Санкт-Петербург). Биоптат антрального отдела желудка помещали на поверхность индикаторного диска на 3 минуты (порог перехода от желтой окраски к ярко-синей), после чего направляли на гистологическое исследование. Чувствительность данного теста, согласно данным литературы [8], достигает 95%, а специфичность — 100%. Препараты в дальнейшем подвергались стандартной окраске гематоксилином и эозином для оценки структуры слизистой и элективной окраске по Романовскому — Гимзе для выявления бактериальных тел HP с использованием 2%-ного раствора краски Гимзы.
Оценку морфологических изменений в СОЖ проводили с учетом визуально-аналоговой шкалы модифицированной Сиднейской системы, предложенной в Хьюстоне в 1994 г. [1]. Выделялись неатрофический и атрофический (аутоиммунный, мультифокальный) хронический гастрит (ХГ) и особая форма — реактивный рефлюкс-гастрит. Такие особые формы ХГ, как лимфоцитарный (вариолиформный), гранулематозный и эозинофильный гастрит, у изучавшихся нами больных не встречались. Морфологические изменения оценивали полуколичественно: обсеменение HP (отсутствует, слабое, умеренное, выраженное), инфильтрация нейтрофилами (отсутствует, слабая, умеренная, выраженная), хроническое воспаление (отсутствует, слабое, умеренное, выраженное), атрофия (отсутствует, слабая, умеренная, выраженная). Регистрировали также феномены, не требовавшие полуколичественной оценки: кишечную метаплазию (полную, неполную), потерю муцина с повреждениями поверхности эпителия (эрозии), лимфатические узелки, фовеолярную гиперплазию.
Наряду с гистологическими методами был использован экспресс-тест для качественного одноэтапного выявления антигена HP в фекалиях человека (HpSA) (Novamed Ltd, Израиль).
Статистическую обработку результатов проводили в операционной среде Windows XP с использованием статистической программы Statistica 6.0. Различия считали статистически значимыми при р < 0,05.
РЕЗУЛЬТАТЫ
Средняя продолжительность СД-1 у детей в основной группе — 5,26 ± 0,35 года, среди пациентов I подгруппы — 2,33 ± 0,21 года, среди детей II подгруппы — 8,53 ± 0,28 года.
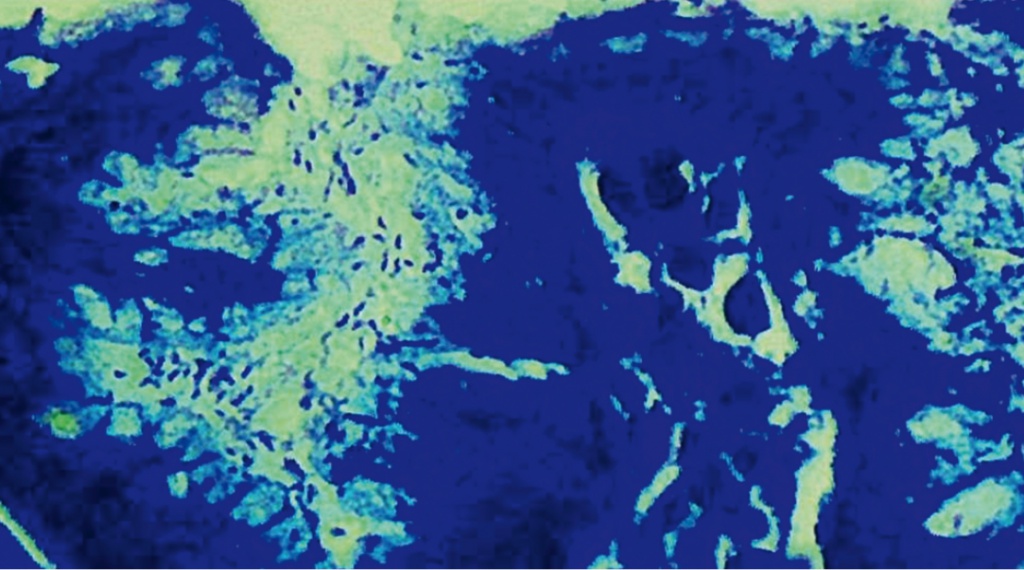
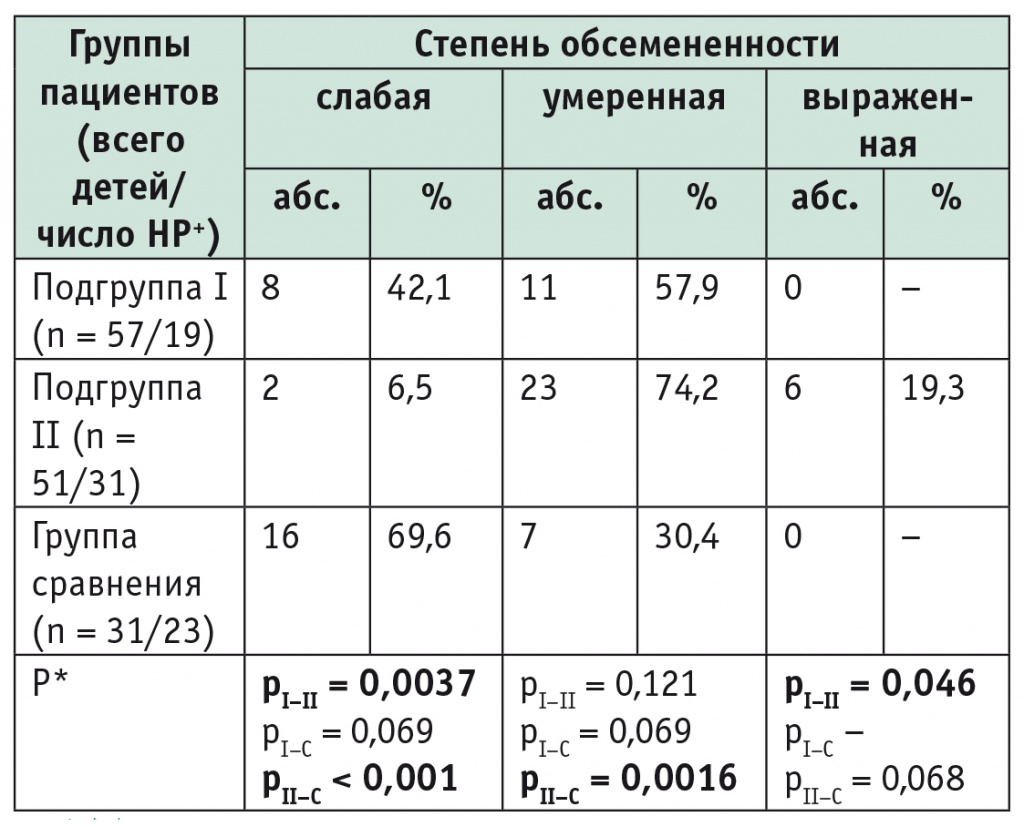
Гистологически бактериальные тела HP были обнаружены у 19 (33,3%) пациентов I подгруппы, 31 (60,8%) ребенка II подгруппы и 23 (74,2%) детей в группе сравнения. У пациентов с СД-1 как I, так и II подгруппы превалировала умеренная степень обсеменения HP — 11 (57,9%) детей и 23 (74,2%) ребенка соответственно. Реже у детей I и II подгрупп встречалась слабая степень обсеменения — 8 (42,1%) и 2 (6,5%) соответственно. Выраженная степень отмечена у 6 (19,3%) детей II подгруппы (рис.), а в I подгруппе не наблюдалась вовсе.
Рис. Колонии Helicobacter pylori в желудочных ямках слизистой оболочки желудка у пациента с сахарным диабетом 1 типа. Видны типичные спиралевидные, S-образные формы бактериальных тел. Выраженная степень обсеменения.
Окраска по Романовскому ― Гимзе (400-кратное увеличение). Фото Г. М. Якуповой
В группе сравнения, напротив, превалировала слабая степень обсеменения HP (16 (69,6%) детей), а умеренная степень встречалась реже — у 7 (30,4%) участников. Результаты сравнения представлены в таблице.
Таблица
Степень обсемененности слизистой оболочки желудка Нelicobacter pylori у детей с сахарным диабетом 1 типа
* Точный тест Фишера.
Биопсийный уреазный ХЕЛПИЛ-тест продемонстрировал положительный результат — от слабоположительного (+) до резко положительного (+++) — у 16 (28,1%) пациентов I подгруппы и 29 (56,9%) II подгруппы. В I подгруппе расхождение результатов отмечено у 3 (5,3%) участников, а во II подгруппе — у 2 (3,9%). Все дети с предполагаемым ложнонегативным результатом уреазного биопсийного теста и в I, и во II подгруппе гистологически имели слабую степень обсеменения СОЖ бактериальными телами HP. Случаев ложнопозитивных результатов среди наших пациентов не было.
В группе сравнения положительный результат биопсийного уреазного теста был получен у 21 (67,7%) пациента и расхождение его с результатами гистологического исследования наблюдалось у 2 (6,5%) детей.
При сравнении общего числа пациентов с HP-инфекцией в обеих подгруппах с числом инфицированных в группе сравнения — 45 (41,7%) против 21 (67,7%) — было обнаружено, что среди детей, не страдающих СД-1, HP-инфекция встречается чаще, чем у детей с СД-1 (p = 0,009).
В то же время в I подгруппе детей с СД-1 HpSA-тест выявил присутствие в кале антигенов HP у 17 (29,8%) пациентов с положительным результатом гистологического исследования, а во II подгруппе — у 29 (56,9%). Параллельно в I подгруппе у 1 (1,7%) пациента с негативным результатом ХЕЛПИЛ-теста HpSA-тест продемонстрировал положительный результат. Во II подгруппе положительных результатов HpSA-теста при отрицательном результате ХЕЛПИЛ-теста не получено.
Таким образом, диагноз HP-инфекции с помощью HpSA-теста был подтвержден у 17 (29,8%) детей в I подгруппе и у 29 (56,9%) во II подгруппе, а также у 21 (67,7%) ребенка в группе сравнения. У участников группы сравнения было получено 2 (6,5%) негативных результата при положительном результате гистологического исследования. Случаев положительной реакции HpSA-теста при негативном результате гистологического метода не было ни в I, ни во II подгруппе детей с СД-1.
Оценивая показатели чувствительности и специфичности HpSA-теста у пациентов с СД-1 в сравнении с гистологическим методом диагностики (как базовым), составившие 100% и 90,41% соответственно, можно отметить его высокую диагностическую значимость. Прогностическая ценность положительного результата — 0,9, прогностическая ценность отрицательного результата — 1, а диагностическая эффективность — 95,21.
ОБСУЖДЕНИЕ
В настоящее время хорошо известно, что хеликобактерии повышают потребность детей с СД-1 в дозах вводимого извне инсулина [10], что указывает на их влияние на уровень гликемического контроля и, следовательно, метаболических процессов в целом. Кроме того, известно, что данные микроорганизмы лучше развиваются в среде с повышенным содержанием сахара. По-видимому, гипергликемия у диабетиков является фактором, способствующим размножению HP на поверхности эпителиоцитов желудка [6]. На это может указывать и более высокий уровень гликированного гемоглобина у детей и взрослых с СД-1, инфицированных HP [19].
Данная точка зрения получила и экспериментальное подтверждение. Американские исследователи доказали на мышах линии C57BL/6 с экспериментальным (стрептозоциновым) диабетом, что уровень гликированного гемоглобина существенно выше у мышей с Helicobacter felis индуцированным гастритом (экспериментальная модель хеликобактерной инфекции человека) [21]. Более того, исследователи обнаружили, что уровень гликированного гемоглобина коррелирует с тяжестью гастрита у экспериментальной модели. Данную точку зрения поддержал целый ряд зарубежных исследователей, показавших, что частота встречаемости HP существенно выше среди взрослых пациентов с СД-1, чем в группе сравнения, где не было больных СД-1 [20].
Полученные нами данные у детей с СД-1 не подтвердили результатов исследования I. Tacheci и J. Bures [20], что, возможно, отражает особенность течения СД-1 в детском возрасте. Было показано, что чем больше стаж заболевания СД-1, тем выше частота встречаемости HP-ассоциированного ХГ у таких пациентов [13]. Наши сведения в целом подтверждают этот вывод.
В контексте данного подхода следует отметить, что в целом ряде работ продемонстрированы существенно более низкие показатели эрадикации HP у пациентов с СД-1 [11, 15, 16], а число рецидивов HP-ассоциированного ХГ также было существенно выше среди пациентов с СД-1 [17, 18]. Следует подчеркнуть, что в ряде случаев низкая эффективность эрадикационной терапии HP может быть объяснена диабетической микроангиопатией, которая, в свою очередь, обусловливает снижение абсорбции антибиотиков в микроциркуляторном русле СОЖ и, соответственно, ухудшает результаты лечения [14].
Наряду с традиционными способами диагностики HP, нами у детей с СД-1 был впервые апробирован неинвазивный HpSA-тест для обнаружения антигенов HP в фекалиях. Тест продемонстрировал очень высокую чувствительность и специфичность (100% и 94% соответственно), что позволяет рекомендовать его для диагностики пилорического хеликобактериоза у детей с СД-1 в качестве высокоточного и безопасного неинвазивного метода, позволяющего избежать ФЭГДС, проведение которой может быть затруднено у отдельных пациентов с СД-1 в связи с необходимостью задержки приема пищи до прохождения процедуры и развитием тяжелого гипогликемического состояния после утренней инъекции инсулина и при наличии сопутствующих нарушений со стороны свертывающей системы крови, когда биопсия может повлечь за собой развитие кровотечения.
Очевидно, что информативность HpSA-теста в диагностике HP-инфекции у детей с СД-1 оказалась достаточно высокой. Тест в первую очередь показан пациентам, у которых проведение инвазивной диагностики HP-инфекции невозможно в связи с тяжестью основного заболевания или сопутствующей патологии (тромбоцитопения и др.) или при отказе пациента и его родителей от проведения эндоскопического исследования.
ЗАКЛЮЧЕНИЕ
Инфекция Helicobacter pylori не играет столь значительной роли в развитии патологии желудочно-кишечного тракта у пациентов с сахарным диабетом 1 типа (СД-1), как у больных с клиническими проявлениями диспепсии. Применение неинвазивных тестов для диагностики H. pylori у детей c СД-1 более предпочтительно, чем использование инвазивных методов диагностики пилорического хеликобактериоза.








