Среди злокачественных заболеваний ЖКТ рак пищевода, конечно, уступает пальму первенства злокачественным новообразованиям желудка, толстой кишки, поджелудочной железы, но при этом распространенность его остается достаточно высокой и, к сожалению, имеет тенденцию к увеличению.
В клинической картине опухолей пищевода превалирует дисфагия, и даже при сохранении способности к глотанию больные часто жалуются на задержку пищевых масс за грудиной, сопровождающуюся болями в результате давления растущей опухоли, или, в тяжелых случаях, на рвоту только что съеденной пищей[2]. К другим симптомам можно отнести выраженное слюноотделение.
Исторически паллиативное лечение опухолей и стриктур пищевода заключалось в наложении гастростомы или использовании жестких пластиковых стентов, проведение которых ниже уровня опухоли сопровождалось всевозможными техническими сложностями. Эти стенты устанавливали в пищеводе методом проталкивания по проводнику (струне) или с помощью визуального эндоскопического контроля. Часто установка подобного стента могла осуществиться только при сочетании эндоскопических и лапароскопических манипуляций с предварительным выведением гастростомы, бужированием пищевода и проведением баллонной дилатации. У более чем 80% больных их установка была сопряжена с осложнениями — перфорацией полого органа (до 10%), кровотечениями (18%), чувством инородного тела (36%), затруднением дыхания (6%), беспокойством и чувством тревоги (30%)[6].
С появлением первых саморасправляющихся металлических стентов в начале 1990-х годов проблема стриктур, казалось, была решена. С тех пор пластиковые жесткие стенты практически вышли из употребления. Металлические саморасправляющиеся стенты значительно улучшили качество жизни больных, устраняя причины дисфагии практически сразу же после установки более чем в 70% случаев[4, 8, 12]. По сравнению с пластиковыми стентами металлические снизили смертность больных, уменьшив количество перфораций на 9,6% и миграций стента на 8%[9]. Однако, как оказалось, металлические стенты достаточно быстро врастают в стенку пищевода — в 13% случаев против 1,6% случаев при использовании пластиковых стентов[10, 20].
В дальнейшем стенты стали частично покрывать силиконовой или пластиковой пленкой поверх металлического сетчатого каркаса для предотвращения врастания его в стенку опухоли. Однако непокрытые концы стентов очень быстро прорастали грануляциями разрастающейся опухоли, что мешало удалять стенты или позиционировать их[17]. Появившиеся в начале XXI века полностью покрытые стенты (покрытие призвано исключить врастание), по сравнению с чисто металлическими, оказывали большее давление на опухоль, сдавливая ее, и это зачастую приносило дискомфорт пациентам.
В последнее время появились новые модели полностью или частично покрытых саморасправляющихся стентов, лишенные этих недостатков. Они состоят из специальных сплавов никеля и титана, которые по сравнению с хирургической сталью меньше склонны к врастанию. Кроме того, новые композитные стенты обладают антирефлюксным механизмом и способностью к биологическому разложению.
Выбор типа, длины и диаметра расправляющегося стента для паллиативного лечения опухолей пищевода зависит от характера роста опухоли, ее протяженности, степени сужения просвета.
Протяженность опухоли перед установкой стента должна определяться в ходе эндоскопического исследования при возможности проведения эндоскопа за опухоль. В случае значительного сужения просвета используются эндоскопы малого диаметра — детские модели, трансназальные эндоскопы или бронхоскопы. Если провести эндоскопию не представляется возможным, протяженность опухоли оценивают рентгенологически. Длина устанавливаемого стента определяется после оценки протяженности опухоли: стент должен быть достаточно длинным, чтобы расправить стриктуру и предотвратить прорастание опухоли в его непокрытые концы, а для этого необходимо, чтобы стент после раскрытия выступал на 2–4 см за края опухоли. Следует учитывать, что при раскрывании стенты сокращаются до одной четверти своей длины.
Если просвет пищевода слишком заужен, то перед проведением стента после предварительного рентгенологического контроля просвет дилатируется с помощью стандартных пищеводных баллонов. Современные саморасправляющиеся стенты, в отличие от аналогов предыдущих лет и более старых моделей, имеют диаметр доставочного устройства не более 6 мм и, соответственно, в меньшей степени нуждаются в предварительном бужировании просвета, что, в свою очередь, снижает вероятность травматизации.
Использование разных моделей стентов позволяет эффективно проводить лечение стеноза пищевода при различной локализации опухолей. Наилучшим местом для расположения стента является средняя треть пищевода, где достаточно легко его установить и при необходимости репозиционировать. Современные стенты возможно устанавливать и в дистальной части пищевода, но это сопряжено с повышением риска развития гастроэзофагеального рефлюкса. В таком случае рекомендуется устанавливать специальные стенты, снабженные антирефлюксным клапаном, хотя их преимущество до сих пор оспаривается некоторыми исследователями[15]. В проксимальной части пищевода установка стентов наиболее эффективна, если опухоль располагается не выше 2 см от верхнего пищеводного сфинктера. Однако даже при проксимальном расположении опухолей стентирование может быть эффективным при использовании стентов с коротким верхним фланцем (до 0,7 см в длину)[16].
По сравнению с жесткими пластиковыми стентами современные саморасправляющиеся стенты более пластичны, гибки, что очень важно, особенно при установке стентов в извилистых злокачественных новообразованиях. Рост некоторых опухолей происходит неравномерно, от этого просвет пищевода все время меняет свою конфигурацию, и при установке прямых негибких стентов практически всегда происходит травматизация опухоли.
Покрытые стенты, в отличие от металлических непокрытых, с успехом могут применяться и при стентировании опухолей пищевода, сочетающихся с трахеопищеводными свищами. Покрытые стенты обеспечивают после своего расправления надежную окклюзию свища[19].
Эффективность применения саморасправляющихся стентов подтверждают многочисленные исследования, проведенные к настоящему времени. В частности R. Conigliaro и соавт. (2007) наблюдали 60 больных с обструкцией пищевода из-за рака пищевода (n = 52), рака легких (n = 7) и опухоли щитовидной железы (n = 1), которым были установлены покрытые стенты Polyflex. Непосредственно после установки стента ранние осложнения, которые не имели критических последствий, были отмечены у 19 (32%) больных (боль в груди, лихорадка, желудочно-пищеводный рефлюкс, неполное раскрытие стента), а серьезные осложнения, приведшие к смерти, зафиксировали у 3 (5%): один случай легочной эмболии и два случая массивного кровотечения. Миграция стента произошла у 5 (8,3%), прорастание опухоли в шейку стента — у 8 (13,3%) пациентов. Средний уровень дисфагии после стентирования снизился с 2,8 до 1,0 балла (р < 0,001)[5].
В проспективном исследовании с участием 33 больных со злокачественными стенозами пищевода, которым было проведено паллиативное стентирование саморасправляющимися стентами, снижение дисфагии наблюдалось во всех случаях[7]. Окклюзия стента из-за разрастания опухоли имела место в 12,1%, миграция стента — в 6,0% случаев, а количество повторных операций составило 21,1%[7]. В другом исследовании у всех 66 пациентов с неоперабельным раком пищевода при использовании саморасправляющихся стентов Polyflex исчезла дисфагия, авторы отметили низкую скорость разрастания опухоли и незначительное количество миграции стентов[18].
Все саморасправляющиеся стенты поставляются в сжатом виде. Это позволяет использовать систему доставки малого диаметра. Как правило, практически все стенты имеют предустановленную систему доставки, и при выполнении стентирования действия врача заключаются только в правильном позиционировании такой системы с последующим раскрытием стента. Лишь некоторые модели требуют предварительной сборки стента и доставочного устройства непосредственно перед выполнением процедуры. Размеры системы доставки варьируются от 6 до 14 мм. Все они имеют рентгенонегативные маркеры, указывающие на размеры сжатого стента, а также метки расположения стента после раскрытия.
В частности, Ultraflex (Boston Scientific, США) представляют собой саморасправляющиеся сетчатые стенты, сплетенные из трикотажных и нитиноловых волокон, с полиуретановой оболочкой, покрывающей основную рабочую часть стента. В неактивном состоянии стент находится в сжатом виде на пластиковом стержне. После позиционирования стента, которое контролируется с помощью рентгенонегативных меток или по визуальным маркерам, удерживающая нить снимается и стент расправляется самостоятельно. Благодаря его большой гибкости и незначительной силе раскрытия сетчатого каркаса снижается риск травматизации опухоли, для полного раскрытия иногда приходится использовать баллонную дилатацию, которая проводится под визуальным контролем эндоскопа после частичного раскрытия стента.
Другой вид стентов — Wallflex (Boston Scientific, США). Он выпускается в двух типах — с полным и с частичным покрытием. В отличие от других стентов, полностью покрытый Wallflex во время установки может быть реконструирован (вновь закрыт) до 75% от максимальной степени расправления до двух раз в течение процедуры для правильного позиционирования стента. Кроме того, эти стенты имеют специальные тефлоновые петли на проксимальном конце, с помощью которых возможно репозиционирование уже установленного стента или его удаление.
После установки стента просвет пищевода расправляется вследствие механического воздействия его каркаса на стенки опухоли. Полное раскрытие стента происходит в течение 3–20 часов в зависимости от модели стента, степени стенозирования пищевода, плотности опухоли. Сразу после установки стента, несмотря на то что большинство пациентов начинают чувствовать себя значительно лучше (исчезают явления дисфагии), им не рекомендуется принимать пищу и жидкости. При установке стентов, даже с самой небольшой силой расправления, сохраняется вероятность повреждения стенки полого органа.
После установки необходимо провести рентгенологическое исследование с барием, чтобы убедиться в правильном позиционировании стента и отсутствии перфораций. Пациентам разрешается пероральный прием пищи не ранее чем через 12 часов после установки, чтобы плотные фрагменты ее не смогли сдвинуть стент. Кроме того, пациентам дают инструкции по приему в первое время после операции щадящей жидкой или гомогенизированной пищи с обязательным запиванием жидкостью для отмывания стентов от остатков пищи, способных задержаться на каркасе. Для предупреждения рефлюкса желудочного содержимого в пищеводе больным рекомендуется спать на постели с приподнятым головным концом (примерно на 30 градусов).
При размещении стента в области кардиоэзофагеального перехода и формировании искусственного зияющего перехода из пищевода в желудок назначают ИПП и прокинетики для предотвращения возможного воздействия агрессивной среды желудка на стенки пищевода[1].
Несмотря на то что стентирование опухолей пищевода за последнее время прошло колоссальный путь развития — от жестких пластиковых и металлических стентов до саморасправляющихся стентов с возможностью повторного закрытия и репозиционирования, — современные научные разработки позволяют далее совершенствовать системы стентирования стенозов и опухолей полых органов.
В последних работах предлагают использовать биоразлагаемые стенты, созданные на основе полимолочных полимеров. Такие системы показали хорошую переносимость и эффективность при лечении доброкачественных ригидных опухолей пищевода, особенно после эндоскопических операций (подслизистой резекции, туннелирования, рассечения подслизистой оболочки)[3, 13, 14]. В недавних публикациях упоминается о появлении стентов с нанесенными на них лекарственными препаратами, которые направлены на медикаментозное воздействие на опухоль и участки воспаления[9, 11].
Наш собственный опыт постановки саморасправляющихся стентов фирмы Boston Scientific (США) больным со злокачественными стенозами пищевода является первым в Туркменистане. Под наблюдением в Ашхабадском Международном центре лечения онкологических заболеваний находились 6 пациентов: 4 мужчины и 2 женщины. Их средний возраст составил 52,3 года. У всех пациентов имелась стриктура пищевода вследствие внутрипросветного роста злокачественных опухолей. К моменту осмотра и постановки стента диаметр просвета пищевода составлял в среднем 5,2 мм (от 4,0 до 6,8 мм), протяженность опухоли — от 2,0 до 12,0 см. У всех больных, отобранных в данную группу, опухоль располагалась в средней трети пищевода.
Всем участникам перед установкой стента проводилось эндоскопическое обследование для определения характера и протяженности опухоли, проходимости пищевода. У 4 пациентов с диаметром просвета свыше 6 мм его делали с помощью детского гастроскопа диаметром 6 мм; у 2 человек с диаметром просвета 4–4,5 мм пищевод исследовали, используя бронхоскоп (рис. 1, 2).
Рис. 1. Рост опухоли в просвет пищевода. Полулунное сужение. Диаметр просвета свыше 6 мм. Эндофото П. Л. Щербакова
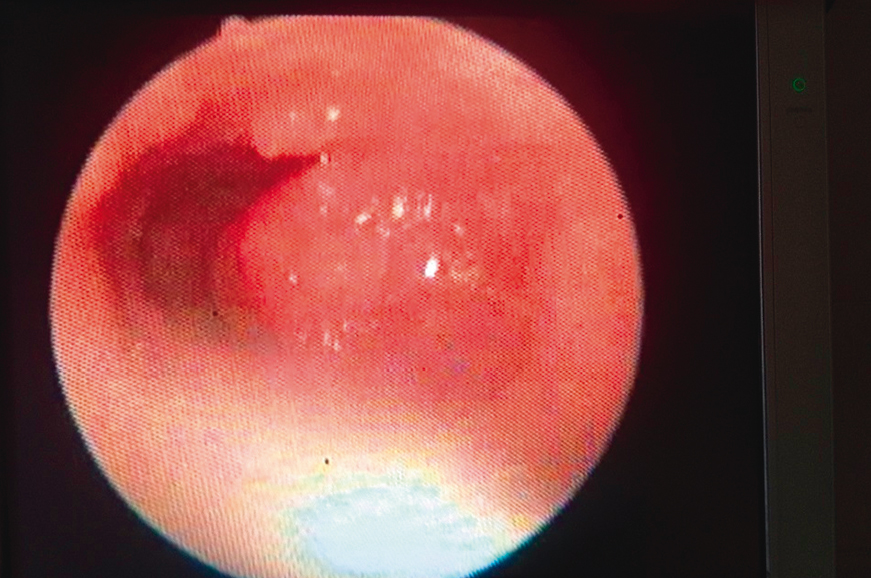
Рис. 2. Стеноз пищевода диаметром 4–4,5 мм. Эндофото П. Л. Щербакова
Через инструментальный канал эндоскопа во время осмотра желудка в него устанавливали гибкий проводник — струну (рис. 3). Перед проведением доставочного устройства стентов у больных с небольшим диаметром просвета (4–4,5 мм) выполнили его предварительное расширение методом баллонной дилатации. После расширения просвета пищевода до 5 мм в него под контролем эндоскопа вводилось доставочное устройство со стентом. Параллельно доставочному устройству заводился трансназальный эндоскоп или бронхоскоп (рис. 4). В зависимости от протяженности опухоли и ее расположения, степени выраженности стеноза мы использовали два типа стентов — покрытые Ultraflex 18/120 или Wallflex 23/150 (рис. 5).
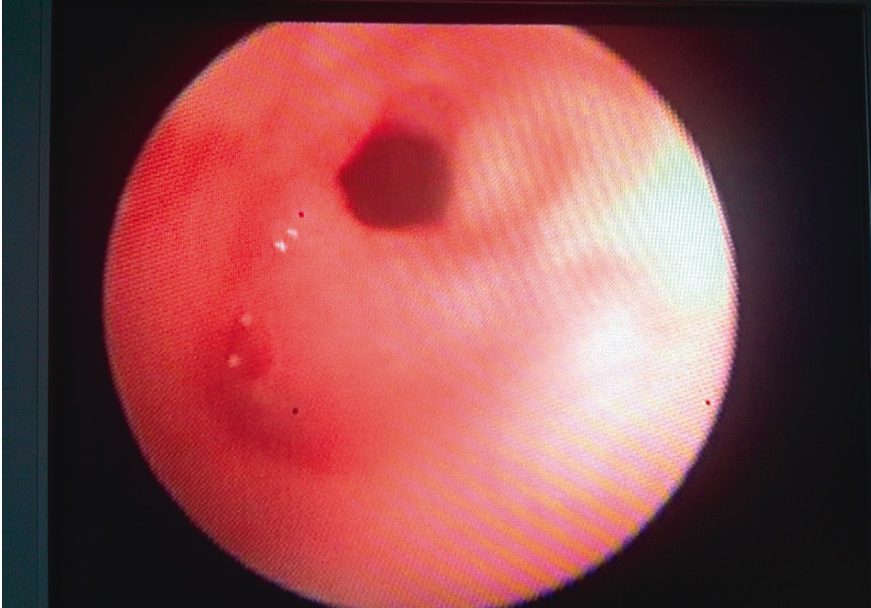
Рис. 3. Проведение струны через стеноз перед низведением по ней стента. Стеноз пищевода свыше 6 мм. Эндофото П. Л. Щербакова
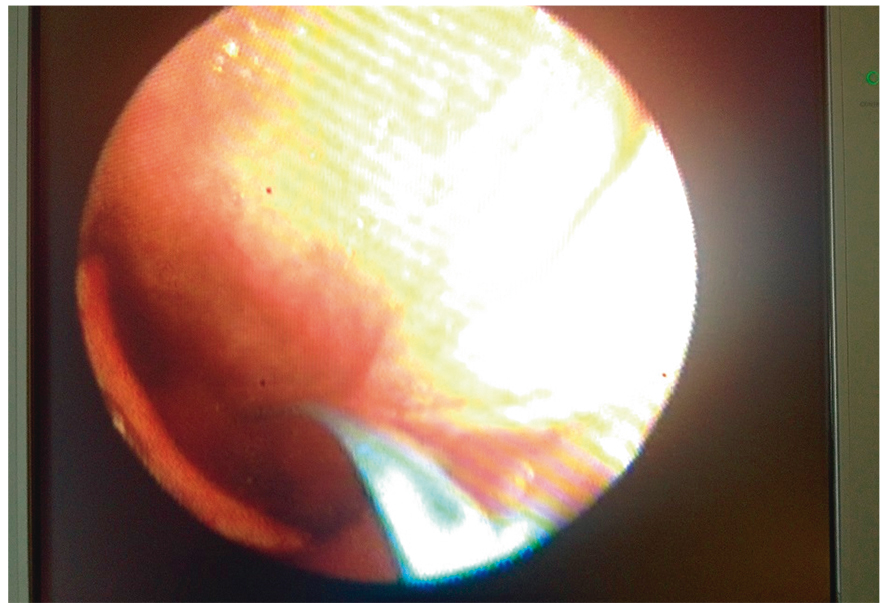
Рис. 4. Этап установки стента. Видно доставочное устройство с метками, заведенное за область стеноза, вызванного опухолью. Эндофото П. Л. Щербакова
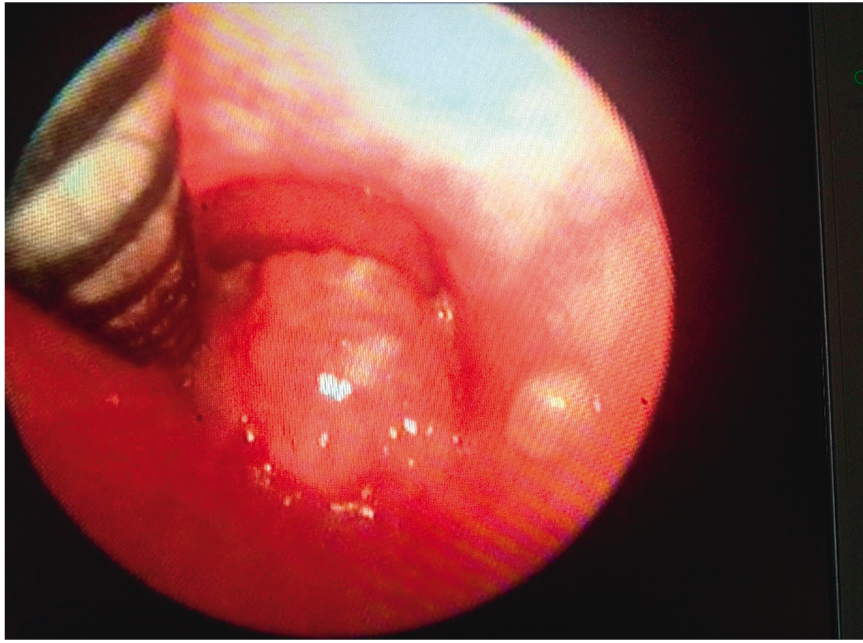
Рис. 5. Саморасправляющиеся стенты Wallflex (Boston Scientific, США). Фото авторов

Позиционирование стентов контролировали с помощью рентгенологического исследования во время проведения эндоскопии. Использовавшиеся нами стенты можно было репозиционировать до полного их раскрытия. Процесс раскрытия стента проводили под эндоскопическим контролем (рис. 6, 7). После раскрытия у всех пациентов отмечалось улучшение. Через месяц после стентирования 4 больным была выполнена радикальная операция. У 2 человек стент был установлен в качестве паллиативной помощи, после чего качество их жизни значительно улучшилось.
Рис. 6. Эндоскопический контроль на этапе установки стента. В центре — удаляемая струна стента. Эндофото П. Л. Щербакова
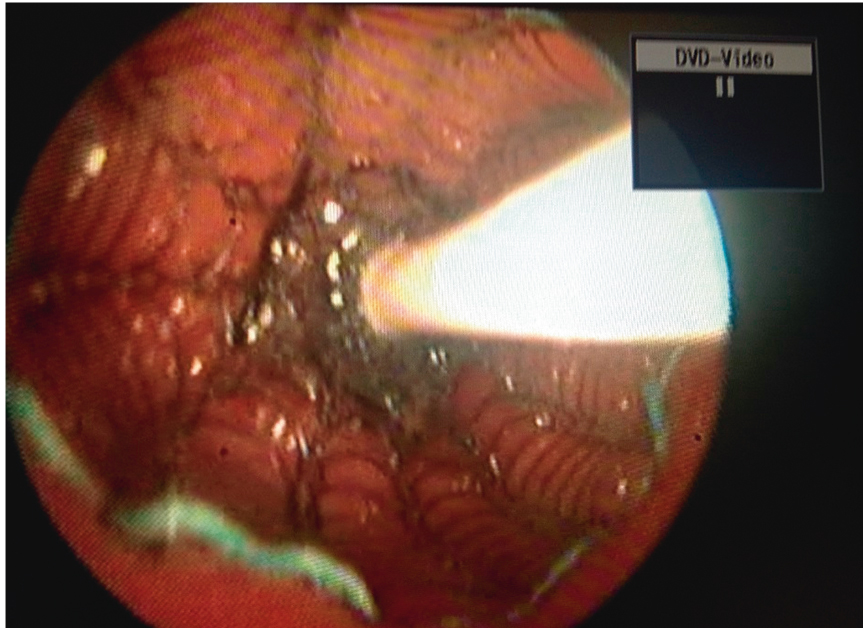
Рис. 7. Эндоскопический контроль после установки стента. Восстановление просвета пищевода. Эндофото П. Л. Щербакова
ЗАКЛЮЧЕНИЕ
Дисфагия, вызванная злокачественным внутрипросветным ростом опухоли, является патогенетически сложным состоянием, часто требующим междисциплинарного подхода для проведения оптимального лечения. Стентирование пищевода оказалось безопасным и эффективным способом лечения ригидных стенозов с дисфагией. Современные технологии, лежащие в основе производства стентов, позволяют оптимизировать процедуру их установки и максимально уменьшить частоту и выраженность возможных осложнений. В результате улучшается качество жизни таких пациентов.
Именно поэтому установка пищеводных стентов является терапией выбора для паллиативного лечения дисфагии и перспективным направлением исследований, посвященных обеспечению длительного и эффективного уменьшения симптомов дисфагии и повышения качества жизни больных.








