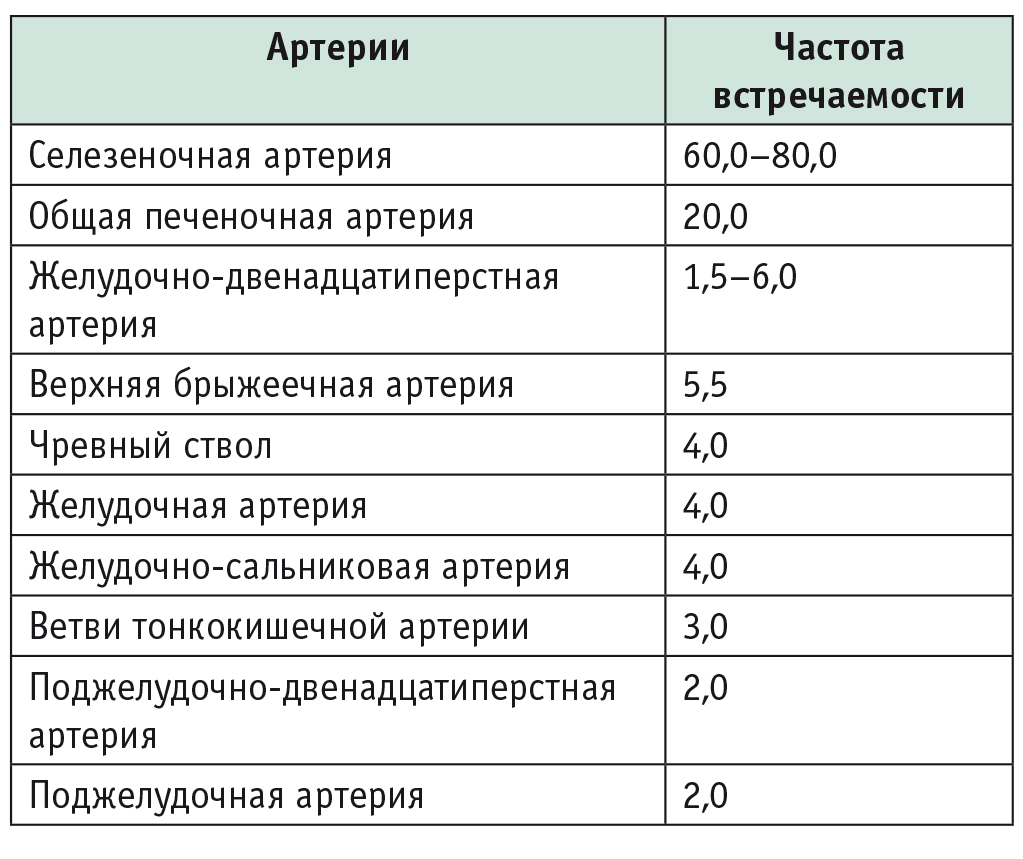
Аневризмы висцеральных артерий (АВА) являются нечастым, но серьезным сосудистым заболеванием, диагностика которого достаточно сложна. Первые сообщения об АВА в медицинской литературе были сделаны G. M. Lan-cisii в 1745 г. и M. Beaussler в 1770 г. К 2004 г. в литературе имеются сообщения о более чем 3000 наблюдений АВА[3]. Большинство авторов, описавших эту патологию, располагают единичными наблюдениями. Частота встречаемости поражений висцеральных артерий по данным литературы представлена в таблице 1[4, 8, 14, 15, 18].
Таблица 1
Частота встречаемости аневризм различных висцеральных артерий по данным литературы, %
АВА разделяют: по этиологии — на врожденные и приобретенные; по морфологическим изменениям — на истинные и ложные; по форме — на мешковидные и диффузные.
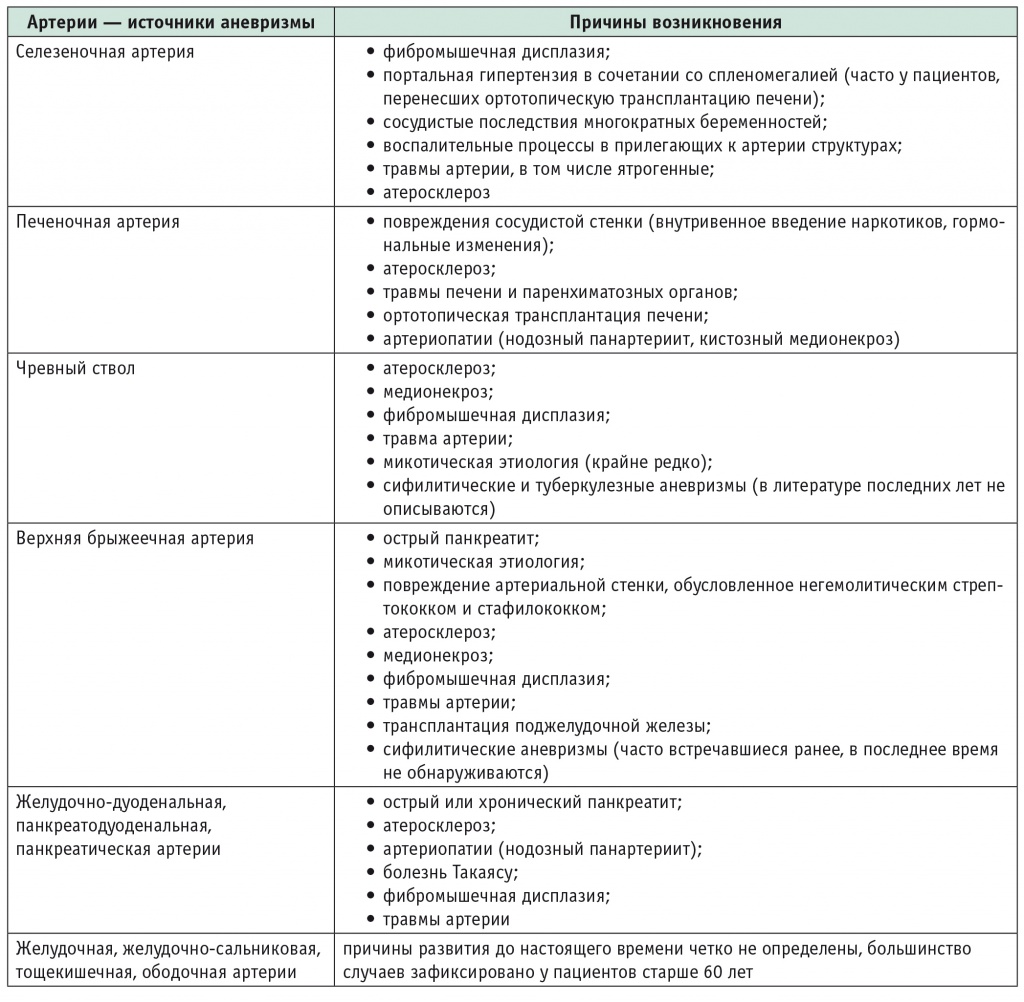
Среди факторов, способствующих развитию АВА в течение жизни, можно выделить: атеросклероз, травмы (в том числе ятрогенные), инфекции и воспалительные процессы в брюшной полости и в забрюшинном пространстве. Среди врожденных причин образования АВА выделяют заболевания соединительной ткани: синдром Марфана и Элерса — Данлоса, наследственную геморрагическую телеангиэктазию (син.: болезнь Рандю — Ослера — Вебера), фибромышечную дисплазию[11, 21]. Причины возникновения аневризм в зависимости от артерии-источника по данным литературы представлены в таблице 2[1, 7, 11, 13, 14, 19, 20, 22].
Таблица 2
Причины возникновения аневризм висцеральных артерий по данным литературы
Истинная АВА формируется по ходу артерии, в качестве стенок аневризмы выступают стенки сосуда (при отсутствии разрыва аневризмы).
Клинические проявления истинной АВА неспецифичны. Пациенты отмечают абдоминальный дискомфорт, боли в животе, не зависящие от приема пищи[1, 9, 13]. При пальпации живота в большинстве случаев отмечается болезненность в эпигастрии, очень редко можно определить пульсирующее образование. При аускультации в проекции аневризмы выслушивается систолический шум. Кроме того, могут иметь место симптомы, обусловленные компрессией соседних структур[1, 13].
Диагностика АВА представляет определенную сложность в связи с тем, что аневризмы длительное время могут протекать бессимптомно. В большинстве случаев заболевание диагностируют случайно, в результате обследования пациента по поводу неспецифических абдоминальных болей или какой-либо другой патологии, либо при развитии осложнений (разрыв аневризмы). В настоящее время для диагностики АВА применяют УЗИ, КТ, МРТ и ангиографическое исследование[11].
Лечение АВА, в том числе и асимптомных, обязательно. Следует учитывать высокий риск разрыва аневризмы, часто с кровотечением, приводящим к летальному исходу[1, 2, 5, 6, 13]. При этом частота осложнений и хирургическая смертность при лечении разорвавшейся аневризмы значительно выше, чем при лечении неосложненных аневризм[13].
С развитием интервенционной радиологии началось активное внедрение в практику эндоваскулярных методов лечения АВА. В тех случаях, когда лигирование аневризмы может привести к ишемии органа, кровоснабжающегося из данной артерии, вследствие недостаточно развитого коллатерального кровообращения, необходимо проведение сосудистой реконструкции[1, 2, 13, 22].
При наличии сопутствующих заболеваний, не позволяющих провести хирургическое лечение, и если размеры аневризмы не превышают 15–17 мм, показаны динамическое наблюдение и мониторирование состояния аневризмы с помощью УЗИ[11].
Цель исследования: показать возможности лучевых методов в диагностике и минимально инвазивном лечении истинных АВА.
МАТЕРИАЛЫ И МЕТОДЫ
За период с 2002 по 2014 г. в Институте хирургии им. А. В. Вишневского проходили обследование и лечение 48 пациентов с истинными АВА. Среди них преобладали женщины — они составили 75% (36 чел.). Пациентам проводилось следующее обследование: УЗИ в В-режиме, в режимах цветового доплеровского картирования, энергии отраженного доплеровского сигнала и импульсной доплерографии; КТ с контрастным усилением и МРТ с контрастным усилением (при необходимости).
РЕЗУЛЬТАТЫ
Диагностика аневризм висцеральных артерий
Единичные аневризмы были выявлены у 44 (91,7%) пациентов, множественные (две, три и четыре аневризмы) по ходу одного сосуда — у 4 (8,3%) пациентов. В 2 (4,2%) случаях было выявлено сразу несколько аневризм, исходивших из разных сосудов. В 1 (2,0%) случае аневризма общей печеночной артерии распространялась также и на собственную печеночную артерию. Большинство диагностированных аневризм (70,6%) исходили из селезеночной артерии. Множественные аневризмы были диагностированы только в селезеночной артерии. По форме все выявленные аневризмы были мешотчатыми. Размеры аневризм варьировали от 8,0 до 32,0 мм в диаметре. Распределение аневризм в зависимости от сосуда — сточника аневризмы представлено в таблице 3.
Таблица 3
Распределение аневризм в зависимости от сосуда — источника аневризмы
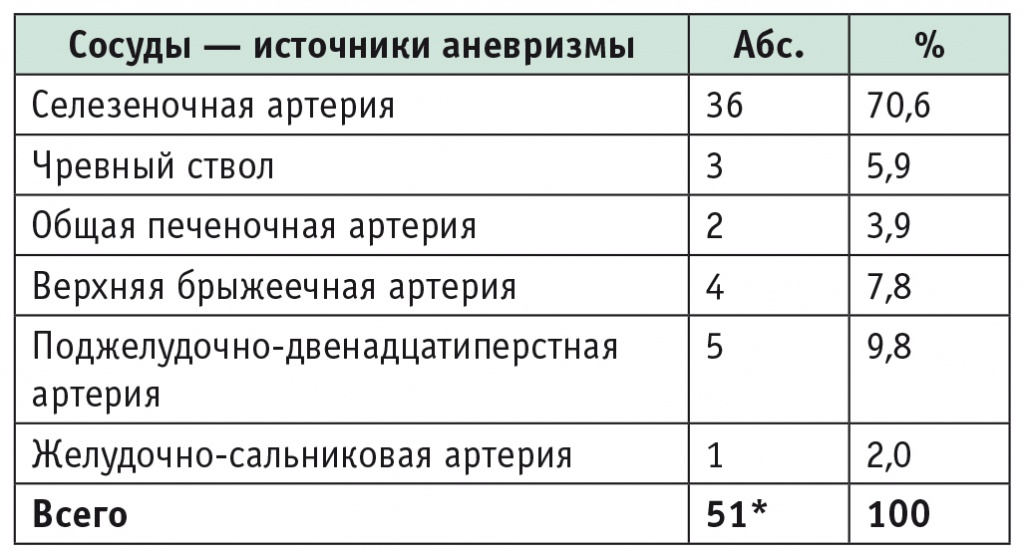
* Число сосудов больше, чем число пациентов, так как у двух пациентов были выявлены 3 и 2 аневризмы, исходившие из разных сосудов (чревный ствол + общая печеночная артерия + селезеночная артерия и чревный ствол + селезеночная артерия).
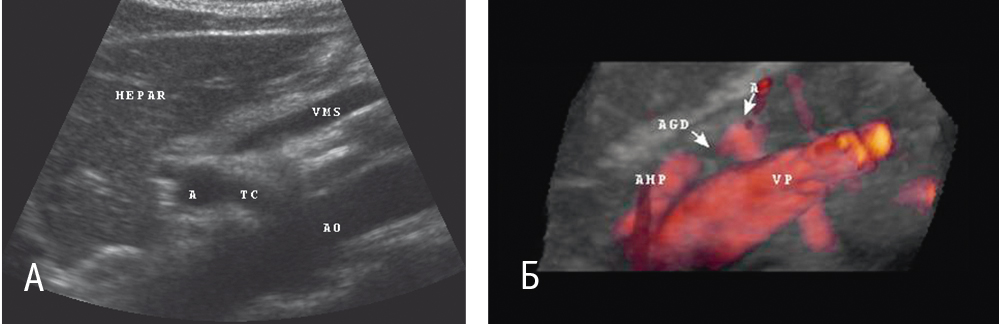
При комплексном УЗИ в В-режиме визуализировалось анэхогенное образование овоидной формы с тонкими, преимущественно эхоплотными стенками (рис. 1). В режимах цветового доплеровского картирования и энергии отраженного доплеровского сигнала полость аневризмы полностью окрашивалась, исключение составляли пристеночные тромботические массы различной степени выраженности и эхоплотности. Образование всегда находилось в проекции анатомического хода артерии. В режиме импульсной доплерографии линейная скорость кровотока на входе в аневризму была повышена на 17,0–41,1% относительно нормальных значений с высокой диастолической составляющей. В полости аневризмы спектр кровотока турбулентный.
Рис. 1. Ультразвуковое изображение аневризмы чревного ствола при продольном сканировании в В-режиме (А) и при сканировании в режиме трехмерной реконструкции (Б). Фото авторов.
Примечание. На рис. А: А ― аневризма, TC ― чревный ствол, AO ― аорта, HEPAR ― печень VMS ― верхняя брыжеечная артерия. На рис. Б: AGD ― желудочно-двенадцатиперстная артерия, AHP ― собственная печеночная артерия, VP ― воротная вена; аневризма указана стрелками
Трехмерная реконструкция ультразвукового изображения в режиме ангиографии позволила более четко определить локализацию аневризмы относительно окружающих ее сосудов, так как этот метод дает возможность проследить ход всего сосуда вне зависимости от его потенциальной извитости, а не отдельных его локусов, как при двумерном исследовании. У пациентов, страдающих хроническим панкреатитом, при значительно развитых петлеобразных портальных коллатералях аневризмы незначительных размеров (до 8,0 мм в диаметре) могут быть диагностированы только при ультразвуковой ангиографии, так как при двумерном исследовании из-за незначительных размеров аневризмы отграничить ее от венозных коллатералей диаметром до 7,0–8,0 мм затруднительно (рис. 2).
Рис. 2. Аневризма селезеночной артерии: А ― компьютерная томограмма, артериальная фаза; Б ― компьютерная томограмма, трехмерная реконструкция изображения; В ― интраоперационная картина аневризмы (ПЖ — поджелудочная железа). Фото авторов
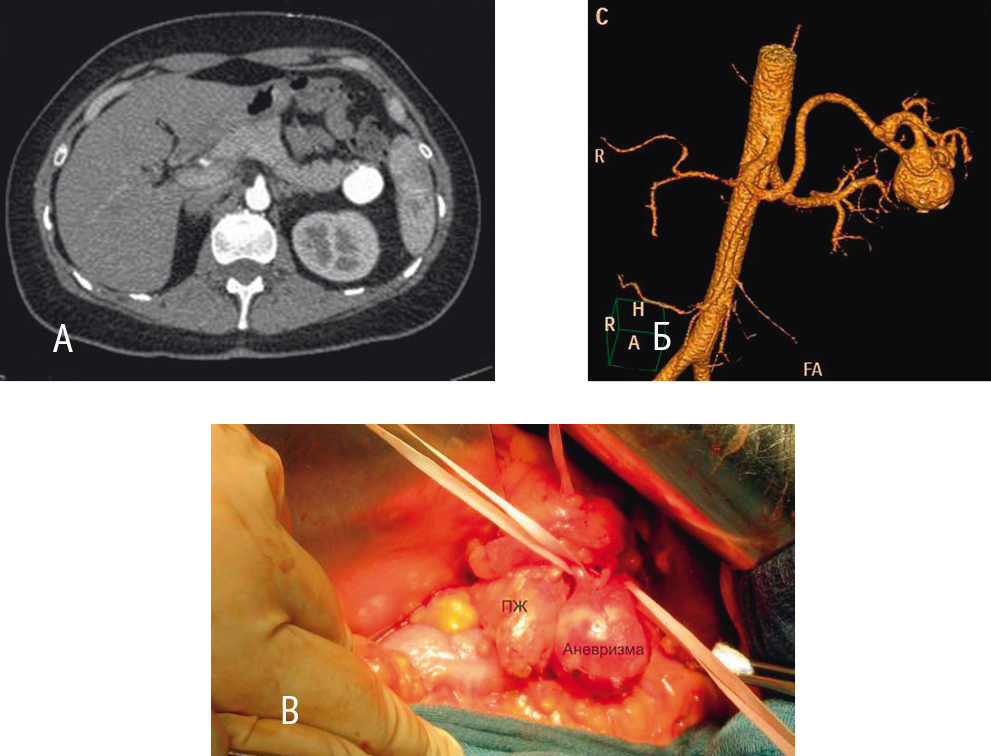
По данным КТ истинная аневризма в нативную фазу исследования диагностировалась как образование низкой плотности с четкими ровными контурами. При введении контрастного вещества образование также определялось в проекции анатомического хода сосуда, его полость контрастировалась в артериальную фазу исследования (плотностью до 250 ед. Н). Интенсивность контрастирования полости истинной аневризмы по интенсивности накопления контраста аналогичен аорте (см. рис. 2А). Трехмерная реконструкция изображения при мультидетекторной КТ дает возможность четко визуализировать аневризму и ее взаимоотношение с окружающими органами и сосудистыми структурами, что сопоставимо с интраоперационными данными (см. рис. 2Б).
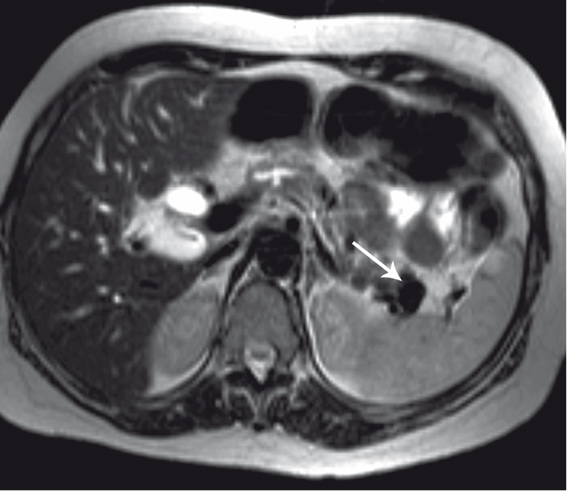
МРТ целесообразно проводить в режиме ангиографии, позволяющей оценить состояние сосудистого русла в зоне локализации аневризмы и самой аневризмы. Возможна оценка стенок истинной аневризмы, наличия или отсутствия тромботических масс, а также пространственного взаимоотношения аневризмы с прилежащими органами и сосудами (рис. 3).
Рис. 3. Магнитно-резонансная томограмма брюшной полости. Т2-взвешенное изображение, аксиальная проекция. Визуализируется аневризма селезеночной артерии (указана стрелкой). Фото авторов
Полипроекционную ангиографию брюшного отдела аорты и ее ветвей выполняли для уточнения локализации аневризмы, оценки анатомического хода артерии — источника аневризмы и в целях определения возможности использования методов эндоваскулярного лечения. Исследование начинали с выполнения обзорной аортографии в двух стандартных проекциях, затем выполняли селективную целиакографию, верхнюю мезентерикографию и суперселективную ангиографию непарных висцеральных артерий брюшного отдела аорты в прямой, боковой и косых проекциях, в режимах Roll-sсan и Propeller-sсan.
Безусловно важной является оценка не только самой аневризмы, но и всего сосудистого бассейна висцеральных артерий и их ветвей с целью определения возможных путей компенсации кровообращения.
Лечение аневризм висцеральных артерий
Методика рентгенэндоваскулярного лечебного вмешательства определялась хирургом вместе со специалистом лучевой диагностики исходя из топографо-анатомических особенностей аневризм и возможных путей компенсации кровообращения индивидуально для каждого пациента. При проведении ангиографии, в зависимости от полученных данных, выбор методики подтверждали или корректировали. Варианты рентгенэндоваскулярных лечебных вмешательств представлены на рисунке 4.
Рис. 4. Варианты рентгенэндоваскулярных лечебных вмешательств: А ― окклюзия артерии-источника дистальнее и/или проксимальнее аневризмы; Б ― окклюзия полости аневризмы спиралями/спиралями и окклюдером; В ― стент-ассистируемая окклюзия полости аневризмы; Г ― эндопротезирование. Фото авторов
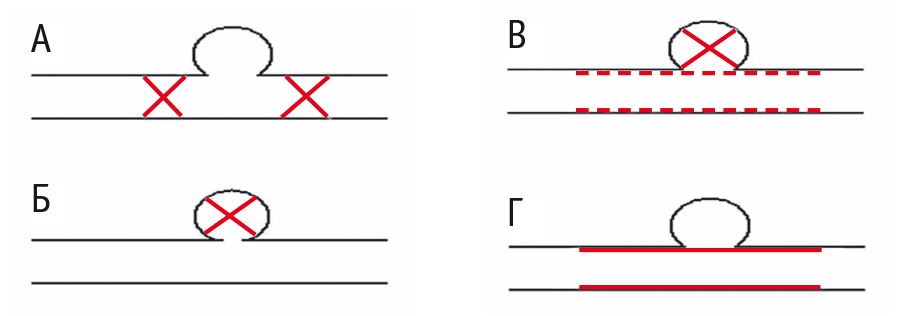
Следует отметить, что окклюзию артерии-источника дистальнее и/или проксимальнее аневризмы применяли только при аневризмах селезеночной артерии.
Топографо-анатомические особенности, которые следует учитывать при выборе метода рентгенэндоваскулярного лечения аневризм непарных висцеральных артерий:
- аневризмы дистальных ветвей непарных висцеральных артерий с узкой шейкой — целесообразно применение эмболизации полости аневризмы окклюзирующими спиралями;
- аневризмы крупных ветвей непарных висцеральных артерий с широкой шейкой — возможно применение стент-ассистируемой окклюзии или эмболизации полости аневризмы окклюдером и спиралями;
- аневризмы крупных ветвей непарных висцеральных артерий как с узкой, так и с широкой шейкой — возможно использовать эмболизацию артерии — источника аневризмы окклюзирующими спиралями и эндопротезирование.
Из 14 (29,2%) пациентов с аневризмами чревного ствола, общей печеночной, верхней брыжеечной, поджелудочно-двенадцатиперстной и желудочно-сальниковой артерий в отношении 13 больных по результатам предоперационного обследования были выбраны следующие тактики ведения и лечения - окклюзия полости аневризмы спиралями в 4 (28,6%) случаях при наличии шейки аневризмы незначительного размера относительно диаметра аневризмы (рис. 5);
- стентирование артерии в 3 (21,4%) случаях;
- резекция аневризмы с линейным протезированием в 1 (7,14%) случае при наличии S-образно извитого хода артерии;
- эндопротезирование чревного ствола (где локализовалась большая аневризма) в 1 (7,14%) случае при наличии сочетанных аневризм чревного ствола, общей печеночной артерии и селезеночной артерии;
- эмболизация селезеночной артерии в 1 (7,14%) случае при наличии сочетанных аневризм чревного ствола и селезеночной артерии;
- резекция аневризмы с протезированием в 1 (7,14%) случае при наличии аневризмы общей печеночной артерии с переходом на собственную печеночную артерию;
- динамическое пятилетнее наблюдение за состоянием аневризмы в 2 (14,3%) случаях, когда размеры аневризмы не превышали 15–17 мм.
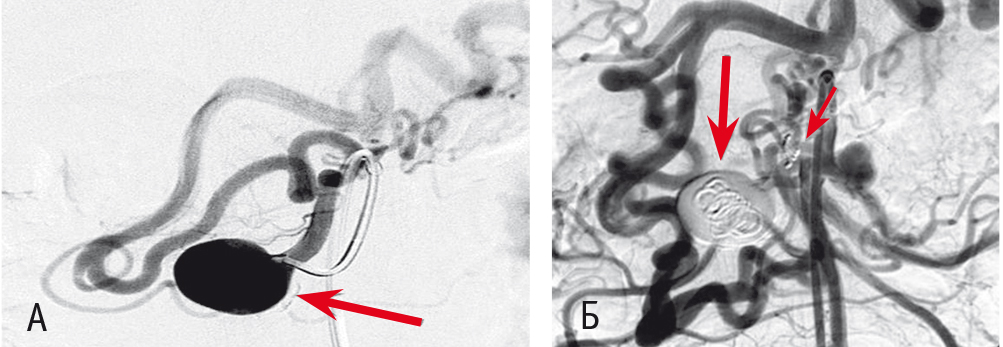
Рис. 5. Селективные ангиограммы аневризмы поджелудочно-двенадцатиперстной артериидо (А) и после (Б) эмболизации спиралями. Фото авторов.
Примечание. На рис. А аневризма указана стрелкой; на рис. Б короткая стрелка ― спирали в просвете поджелудочно-двенадцатиперстной артерии, длинная стрелка ― спирали в полости аневризмы
Одна пациентка (7,14%), у которой была выявлена аневризма верхней брыжеечной артерии, распространявшаяся на бифуркацию артерии, от лечения отказалась.
Аневризмы селезеночной артерии диагностированы у 34 (70,8%) больных. Единичные аневризмы селезеночной артерии наблюдались у 30 пациентов (88,2% от всех больных с аневризмами селезеночной артерии). В 17 случаях они локализовались в проксимальном отделе сосуда, в 13 случаях — в дистальном. Множественные аневризмы выявлены у 4 пациентов (11,8% от всех больных с аневризмами селезеночной артерии). В 2 случаях они локализовались как в проксимальном, так и в дистальном отделе сосуда, в 2 случаях — в воротах селезенки.
С учетом данных предоперационного обследования, у пациентов с аневризмой селезеночной артерии были выбраны следующие тактики ведения и лечения:
- при локализации аневризм в проксимальной части артерии (10 наблюдений):
- эндоваскулярная окклюзия селезеночной артерии дистальнее и проксимальнее аневризмы в 4 (40,0%) наблюдениях;
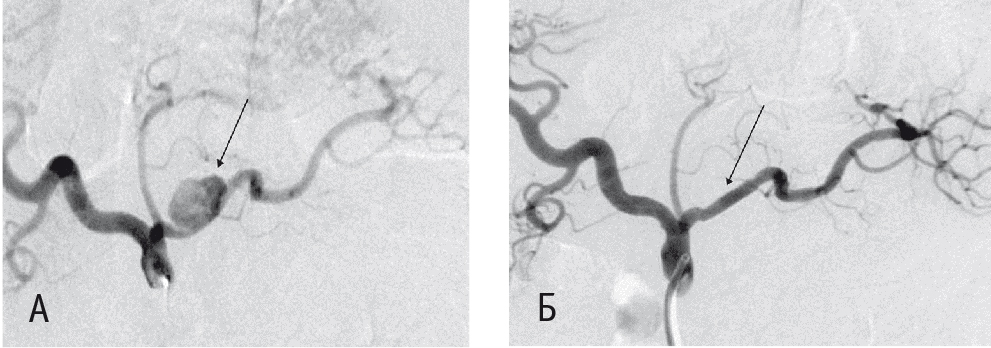
- эндопротезирование артерии в 4 (40,0%) наблюдениях (рис. 6);
- стент-ассистируемая окклюзия полости аневризмы в 2 (20,0%) случаях;
- при локализации аневризм в воротах селезенки (7 наблюдений):
- эндоваскулярная окклюзия аневризмы спиралями и окклюдером в 3 (42,9%) наблюдениях;
- резекция аневризмы, спленэктомия с имплантацией фрагментов селезенки в 4 (57,1%) наблюдениях.
Рис. 6. Целиакогрммы: А ― в проксимальном отделе селезеночной артерии контрастируется аневризма; Б ― после эндопротезирования полость аневризмы не контрастируется, просвет селезеночной артерии сохранен. Фото авторов
При локализации аневризм в проксимальной и дистальной частях (1 наблюдение) произведена эндоваскулярная окклюзия селезеночной артерии на проксимальном сегменте. При отсутствии жалоб и случайном выявлении аневризмы, а также при ее локализации в воротах селезенки и размерах до 12–15 мм в диаметре была избрана тактика динамического наблюдения за состоянием аневризмы в 15 (44,1%) наблюдениях. У 1 (2,9%) пациентки атеросклеротическая аневризма (диаметром до 2,0 см) в воротах селезенки была выявлена как сопутствующее заболевание при неоперабельной опухоли поджелудочной железы, вследствие чего решено проводить динамическое наблюдение за состоянием аневризмы.
Представленный на рисунке 7 клинический пример демонстрирует хороший результат применения стент-графта при лечении больной с аневризмой селезеночной артерии. В данном случае были решены основные задачи эндоваскулярного вмешательства: аневризма выключена из кровотока, проходимость артерии — источника аневризмы и антеградный магистральный кровоток в бассейне селезеночной артерии сохранены.
Рис. 7. Этапы диагностики и стент-ассистируемой окклюзии аневризмы селезеночной артерии: А ― компьютерная томограмма, нативная фаза исследования; Б ― компьютерная томограмма, артериальная фаза исследования; В, Г ― компьютерная томограмма, трехмерная реконструкция изображения (аневризма и ее взаимоотношение с чревным стволом и его ветвями); Д ― селективная ангиогрмма селезеночной артерии до эндоваскулярного вмешательства; Е ― этап установки доставляющего устройства; Ж ― селективная ангиогрмма селезеночной артерии после стент-ассистируемой окклюзии полости аневризмы; З ― ангиогрмма селезеночной артерии после стент-ассистируемой окклюзии полости аневризмы; И ― ультразвуковое исследование через 3 месяца после вмешательства (полость аневризмы в режиме цветового доплеровского картирования не окрашивается, просвет стента проходим. Фото авторов
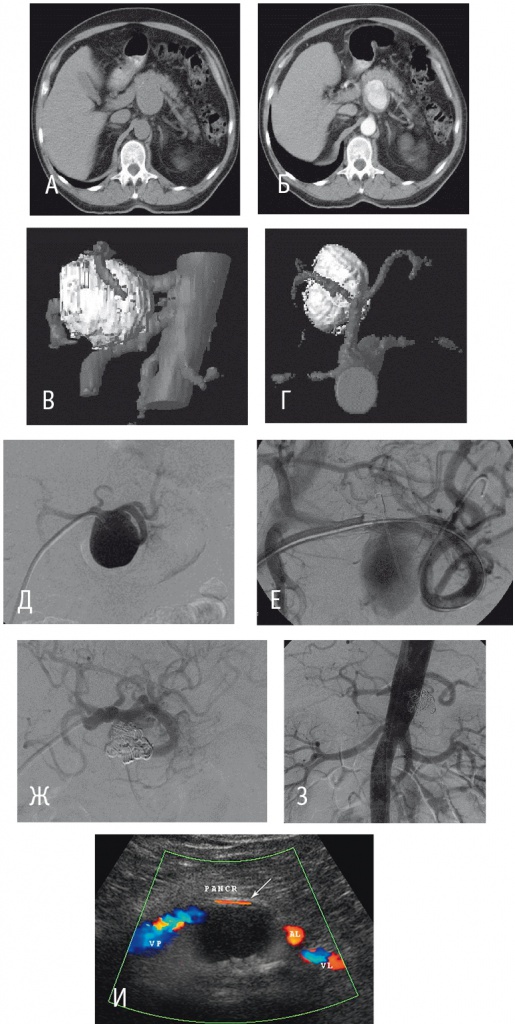
Имплантация стент-графта позволяет сохранить полноценную артериальную перфузию в бассейне селезеночной артерии и предотвратить ишемию селезенки. Длина эндопротеза подбирается таким образом, чтобы стент-графт, перекрывая шейку аневризмы, располагался в артерии на 15 мм проксимальнее и дистальнее шейки аневризмы.
Противопоказаниями и ограничениями к эндоваскулярному лечению АВА являются:
- наличие S-образной извитости или извитости артерии под острым углом;
- локализация аневризмы в воротах селезенки;
- выраженный болевой синдром и/или угроза разрыва кисты (необходимо экстренное открытое оперативное вмешательство).
Выключение аневризмы из кровотока происходило в различные сроки в зависимости от примененного метода рентгенэндоваскулярного лечения. Интраоперационно полное выключение аневризмы отмечали при проведении эндопротезирования. Во всех случаях в раннем послеоперационном периоде пациентам проводили регулярное мониторирование состояния полости аневризмы с помощью УЗИ (через 1, 3 и 5 дней после вмешательства и при выписке). После выполнения эмболизации полное выключение аневризмы из кровотока отмечали при проведении УЗИ через 3–5 дней после оперативного вмешательства.
Целью мониторирования, проводившегося после рентгенэндоваскулярных вмешательств при аневризмах селезеночной артерии, также являлась оценка состояния селезенки. Так, в одном наблюдении после рентгенэндоваскулярной окклюзии селезеночной артерии спиралями у пациентки с множественными аневризмами при проведении УЗИ было заподозрено наличие инфаркта селезенки, что подтвердилось при КТ.
В отдаленном послеоперационном периоде, через 3, 6 и 12 месяцев после выполнения эндоваскулярной окклюзии, эндопротезирования артерии и окклюзии аневризмы под защитой стентирования, проводили УЗИ с целью определения состояния «заинтересованной» артерии. Результаты исследования показали, что после эндоваскулярной окклюзии артерии — источника аневризмы просвет артерии в режимах цветового доплеровского картирования и энергии отраженного доплеровского сигнала не окрашивался, как и полость аневризмы. После селективной эмболизации полости аневризмы просвет артерии полностью окрашивался, иногда визуализировали стент в виде двух линейных, параллельных друг другу гиперэхогенных структур, а полость аневризмы не окрашивалась. В одном наблюдении при выполнении эмболизации полости аневризмы окклюзирующими спиралями с защитой стентом полного выключения аневризмы селезеночной артерии удалось добиться спустя 6 месяцев после рентгенэндоваскулярного вмешательства. Это было обусловлено тем, что в послеоперационный период пациенту была назначена ацетилсалициловая кислота (100 мг/сут). После отмены препарата произошло полное тромбирование полости аневризмы в течение семи дней по данным УЗИ.
Несмотря на то, что диагностировались аневризмы разных висцеральных артерий, вызванные ими жалобы, а также клиническая картина были аналогичными. Поэтому представляется целесообразным для анализа данных использовать общие результаты обследования всех 48 пациентов, независимо от сосуда — источника аневризмы.
Опубликованные в литературе данные свидетельствуют о том, что для диагностики АВА применяются УЗИ[10, 11], КТ[10, 11, 16, 17], МРТ[10, 11] и ангиография[12, 17], однако нет никаких сведений о преимуществах этих методик, равно как и рекомендаций по наиболее эффективному их использованию при данной патологии. В нашем исследовании всем пациентам выполняли комплексное УЗИ, которое, благодаря последним достижениям в развитии ультразвукового метода визуализации, позволяло уже на первом этапе диагностики получить практически все необходимые данные для определения тактики лечения пациента. При сопоставлении с интраоперационными данными точность комплексного УЗИ в нашем исследовании составила 100%.
Для уточнения взаимоотношения аневризмы с окружающими ее органами и сосудами выполняли спиральную КТ с болюсным контрастным усилением, которая, безусловно, позволяла достаточно полно и четко определить необходимые параметры. В 19 (39,6%) случаях данные, полученные при КТ, были сопоставлены с данными МРТ. Результаты сравнения свидетельствуют о том, что МРТ в режиме ангиографии позволяет не менее четко и наглядно (при трехмерной реконструкции), причем без лучевой нагрузки и введения контрастного вещества, визуализировать аневризму, ее источник и окружающие сосуды, оценить взаимоотношение аневризмы с окружающими органами и тканями.
Результаты наблюдения за пациентами с АВА показывают, что при незначительных размерах аневризмы (до 15–17 мм) возможно динамическое наблюдение. В случае увеличения размеров аневризмы или при появлении жалоб предпочтительным методом лечения истинных аневризм является эндоваскулярное лечение.
ЗАКЛЮЧЕНИЕ
Лучевые методы исследования (предпочтительно ультразвуковое исследование в сочетании с магнитно-резонансной томографией) позволяют диагностировать истинную аневризму висцеральных артерий, определить ее источник и на основании анализа ее характеристик выбрать метод эндоваскулярного или открытого оперативного лечения. Эндоваскулярные методы предпочтительны при лечении аневризм висцеральных сосудов. Методика рентгенэндоваскулярного лечебного вмешательства определяется хирургом совместно со специалистом лучевой диагностики исходя из топографо-анатомических особенностей аневризм и возможных путей компенсации кровообращения индивидуально для каждого пациента.








