Внедрение результатов научных исследований, успехи трансплантационной хирургии, создание эффективных современных средств иммуносупрессивной терапии позволили повысить выживаемость реципиентов печени в отдаленном послеоперационном периоде. Вследствие значительного снижения смертности реципиентов печени их абсолютное число в нашей стране, по данным лидеров трансплантологии [1], увеличилось с 1150 в 2013 г. до 2152 в 2017 г. Через 1 год после трансплантации доля выживших реципиентов печени варьирует от 80% до 90% в разных источниках[2–6], а через 5 лет составляет 75%[7], что сопоставимо с результатами нашего центра: в ГБУЗ «Научно-исследовательский институт — Краевая клиническая больница № 1 им. проф. С.В. Очаповского» Минздрава Краснодарского края число выживших реципиентов печени через 5 лет после операции — 113 (83,1%) из 136[8]. Таким образом, продолжительность жизни реципиентов внутренних органов является высокой, а среди причин их смерти, по данным трансплантационных центров, на первые позиции вслед за отторжением и инфекционными осложнениями выходят хронические неинфекционные заболевания (ХНИЗ), в частности сердечно-сосудистые патологии, злокачественные новообразования, хроническая болезнь почек, СД и т. д. Согласно зарубежным источникам, доля летальных исходов вследствие онкологических, сердечно-сосудистых заболеваний, почечной недостаточности через 1 год после трансплантации составляет соответственно 22%, 11%, 6%[9]. Улучшению клинических результатов в значительной мере могут способствовать совершенствование тактики ведения реципиентов в отдаленном периоде, своевременное выявление ХНИЗ и факторов риска их развития.
Цель настоящего исследования — изучить частоту различных хронических неинфекционных заболеваний у реципиентов печени по данным регионального регистра.
МАТЕРИАЛЫ И МЕТОДЫ
Проведено независимое ретроспективное исследование, в ходе которого собирались данные о пациентах, перенесших трансплантацию печени в ГБУЗ «Научно-исследовательский институт — Краевая клиническая больница № 1 им. проф. С.В. Очаповского» Минздрава Краснодарского края с февраля 2016 г. по май 2019 г.
Данные реципиентов печени были получены методом выкопировки из первичной медицинской документации: медицинской карты амбулаторного больного (форма № 025/у-87), медицинской карты стационарного пациента (форма № 003/у-80). Проанализирована частота заболеваний сердечно-сосудистой системы и ЖКТ пациентов до и через 4 года после трансплантации.
Критерием невключения в исследование был возраст моложе 18 лет. За указанное время в электронный регистр были внесены записи о 135 пациентах. В дальнейшем записи о троих из них были признаны непригодными для обработки (в основном из-за отсутствия катамнеза в связи с переездом пациента в другой регион). Эти записи были удалены, и в исследование были включены 132 пациента.
Статистическую обработку проводили с использованием пакета программ Statistica 10.0. Различия считали статистически значимыми при двустороннем р < 0,05.
РЕЗУЛЬТАТЫ
Среди участников исследования было 60,6% мужчин и 39,4% женщин. Возраст пациентов варьировал от 17 до 69 лет, в среднем составив 50,0 ± 10,8 года.
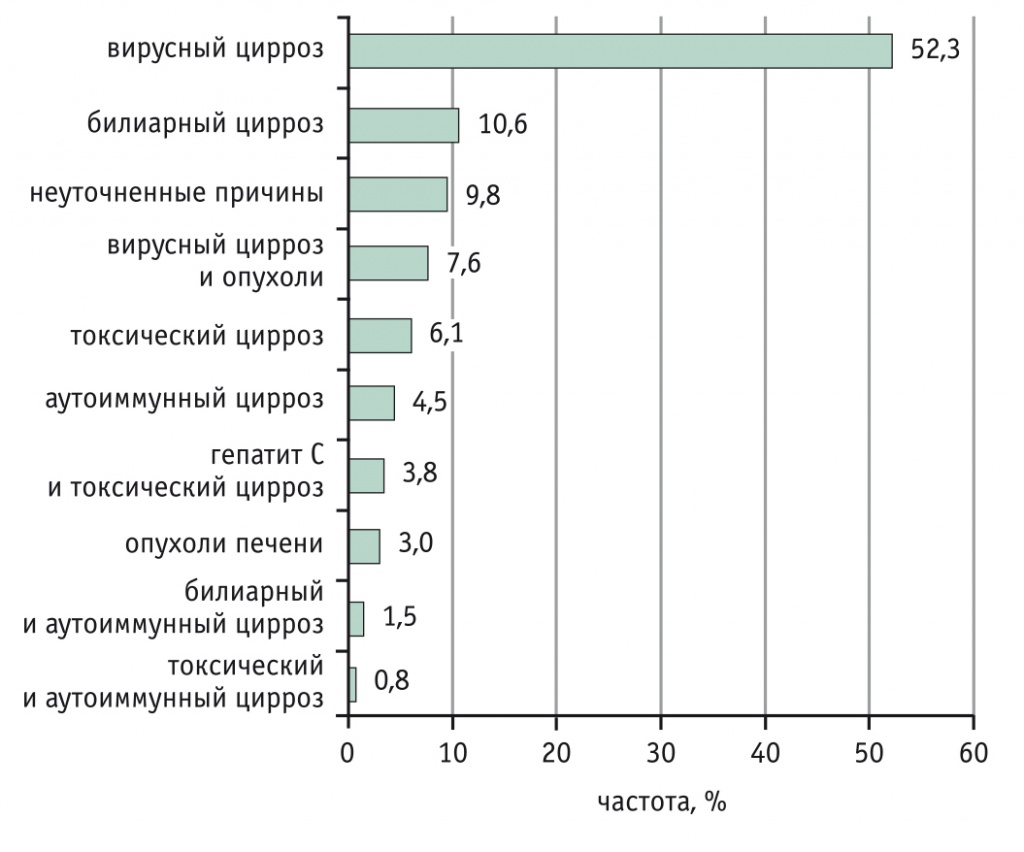
В большинстве наблюдений показанием к пересадке печени был цирроз печени вирусной этиологии (рис. 1).
Рис. 1. Основные причины недостаточности функции печени, приведшие к трансплантации (n = 132), %
До трансплантации печени диагнозы ИБС и ХСН имели соответственно 13 и 24 пациента. После трансплантации в течение 4 лет доля лиц с ИБС увеличилась на 28,0%, с ХСН — на 21,2% (рис. 2).
Рис. 2. Частота сердечно-сосудистых и гастроинтестинальных заболеваний до и через 4 года после трансплантации печени (n = 132), %
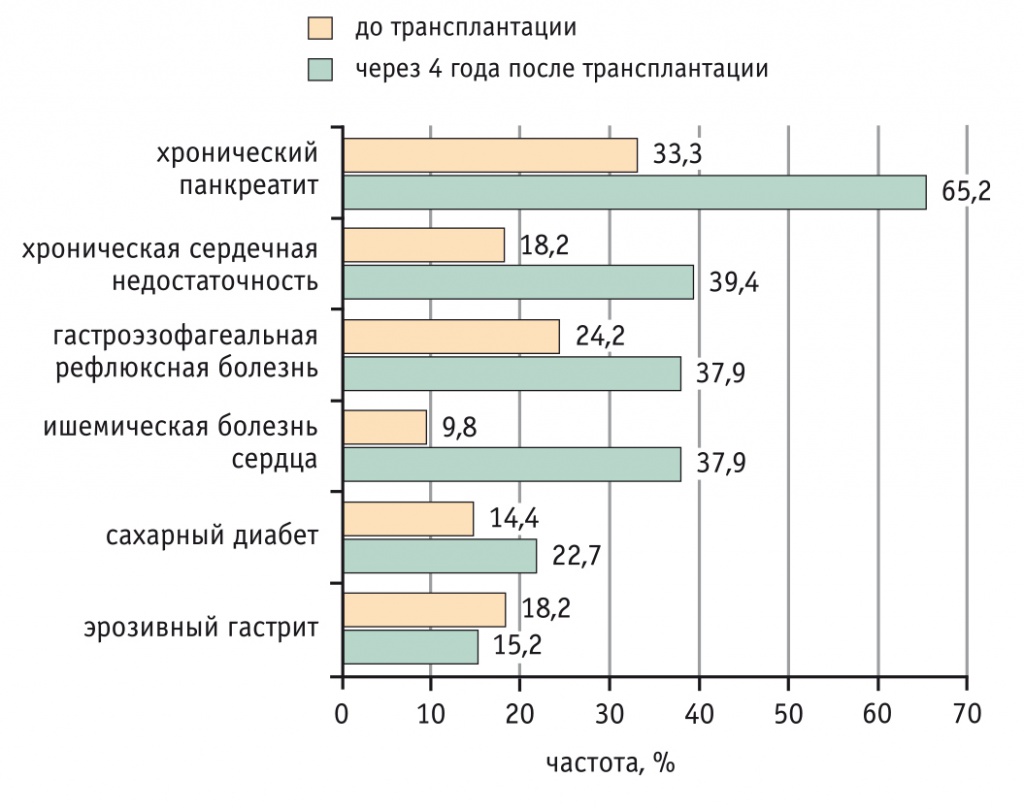
У реципиентов печени изменилась частота гастроэнтерологической патологии (см. рис. 2). Так, до трансплантации хронический панкреатит имели в анамнезе 33,3% пациентов, после трансплантации он диагностирован уже у 65,2%. Частота эрозивного гастрита уменьшилась на 3% (с 18,2% до 15,2%), а гастроэзофагеальной рефлюксной болезни (ГЭРБ) — увеличилась на 13,7% (с 24,2% до 37,9%).
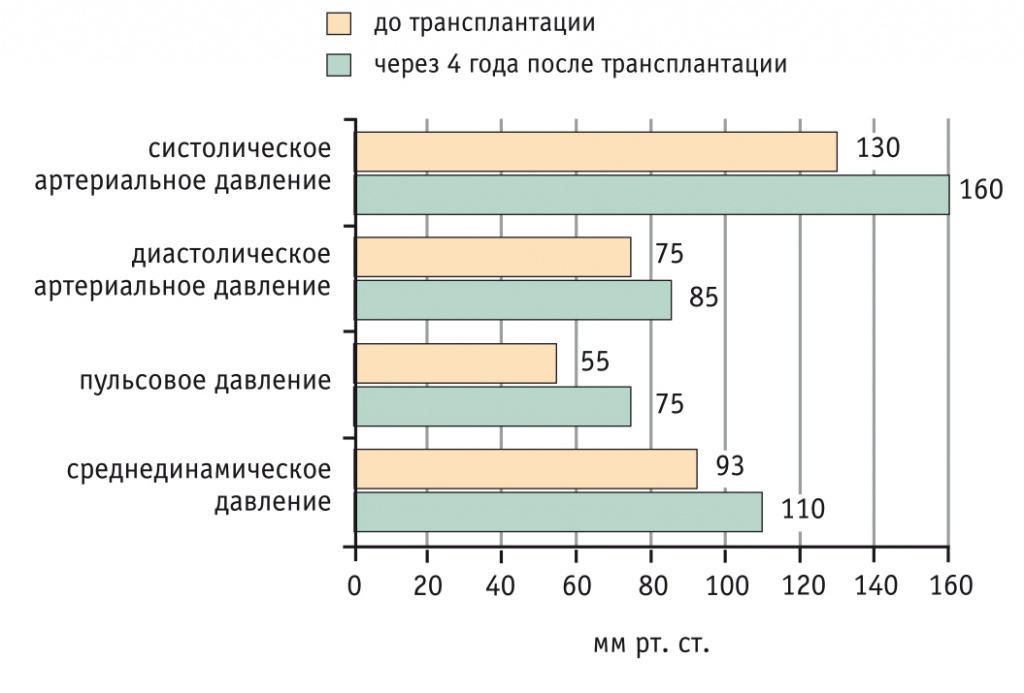
Общеизвестна важная роль артериальной гипертензии (АГ) в патогенезе ИБС и ХСН. Мы проанализировали показатели гемодинамики с расчетом пульсового и среднего АД у тех пациентов, медицинская документация которых содержала полную информацию о динамике АД (n = 45) (рис. 3). Уровень систолического АД составил 140 мм рт. ст. и выше до трансплантации у 17 (37,8%) пациентов, после трансплантации — у 28 (62,2%).
Рис. 3. Средние показатели гемодинамики до и через 4 года после трансплантации печени (n = 45), мм рт. ст.
Примечание. Различия между значениями до и после статистически значимы: р < 0,05
При сравнении показателей мужчин и женщин выявлена однонаправленность динамики частоты всех нозологий, за исключением эрозивного гастрита: число мужчин с эрозивным гастритом сократилось на 3,0%, а среди женщин его частота не изменилась. Число женщин с АГ после трансплантации возросло на 21,7%, мужчин — на 27,3%. Резко увеличилась после трансплантации частота СД как среди женщин, так и среди мужчин — на 50,0% и 80,0% соответственно. Более чем в 2 раза возросло число женщин и мужчин с ИБС — на 24 и 13 пациентов соответственно. ХСН до трансплантации диагностирована у 10 женщин и у 14 мужчин с увеличением за период наблюдения до 22 и 30 пациентов соответственно. Доля женщин и мужчин с ГЭРБ увеличилась на 6,8% и 6,8% соответственно. Прирост числа женщин с хроническим панкреатитом составил 84%, мужчин — 104%.
ОБСУЖДЕНИЕ
Мы представили результаты анализа данных о частоте основных заболеваний сердечно-сосудистой системы и ЖКТ, которые получены из ретроспективного регистра реципиентов печени Краснодарского края.
В целом динамика частоты заболеваний в нашем исследовании сопоставима с данными зарубежной научной литературы. Так, АГ нехарактерна для пациентов с хроническими заболеваниями печени до трансплантации, но после трансплантации возникает у 60–70% пациентов [10, 11]. Учащение развития и усугубление течения АГ, ИБС, ХСН, хронической болезни почек трактуются в настоящее время как достаточно предсказуемые процессы, связанные с увеличением массы тела пациента после операции, побочными эффектами глюкокортикоидов, ингибиторов кальциневрина.
Кроме того, фактором риска развития ССЗ и смерти от них является дислипидемия. Известно, что дислипидемия редко встречается у пациентов с циррозом, поскольку уровень холестерина снижается вследствие угнетения его синтеза в печени. Но после трансплантации дислипидемия развивается у 45–60% пациентов[12, 13] и рассматривается как важный фактор риска возникновения ИБС, АГ, ХСН у реципиентов.
Увеличение доли пациентов с СД и хроническим панкреатитом может быть аналогично объяснено нарушением углеводного обмена и панкреотоксическим действием циклоспорина и такролимуса, которое указано в инструкции к этим препаратам[14]. Сходные факторы вызывают рост заболеваемости СД 2 типа: по данным литературы, с 15% до трансплантации печени до 30–40% после трансплантации[10, 12, 15].
Ранее нами были описаны повышение уровня креатинина в крови и снижение скорости клубочковой фильтрации в отдаленном послеоперационном периоде у реципиентов печени в сравнении с показателями до трансплантации[16]. Через 36 месяцев после трансплантации уровень креатинина возрос на 26,0% (р = 0,0005), а скорость клубочковой фильтрации снизилась на 22,6% (р = 0,00006). Подобная динамика этих показателей зарегистрирована и в других трансплантационных центрах. Так, A.O. Ojo и соавт. верифицировали ухудшение функции почек, перешедшее в хроническую болезнь почек IV стадии с уровнем гломерулярной фильтрации 15–29 мл/мин на 1,73 м2, в 8% случаев через 1 год после трансплантации печени, в 18% — через 5 лет, в 25% — через 10 лет[17].
Из перечисленных в статье нозологий в отдаленном посттрансплантационном периоде снизилась частота только эрозивного гастрита, что, вероятно, обусловлено улучшением кровоснабжения слизистой оболочки ЖКТ в условиях исчезновения портальной гипертензии, нормализации гемоглобина, уровня альбуминов, а соответственно, активацией репаративных процессов в органах и тканях.
Мы не нашли в доступной литературе данных об увеличении частоты ГЭРБ после трансплантации. Однако в Государственном реестре лекарственных средств такой эффект упоминается в инструкции к наиболее часто назначаемому иммуносупрессору — ингибитору кальциневрина такролимусу[14].
Полученные нами данные об увеличении частоты ХНИЗ у реципиентов печени, в том числе нозологий, определяющих сердечно-сосудистую смертность (АГ, ИБС, ХСН, хронической болезни почек), свидетельствуют о том, что практическим врачам следует прилагать усилия к выявлению не только традиционных факторов риска острого отторжения трансплантата, но и факторов риска развития ХНИЗ для своевременной их коррекции.
В научной литературе описаны особенности диагностики и лечения ряда ХНИЗ у реципиентов печени. Например, верификация посттрансплантационного СД проводится прежде всего по результатам перорального глюкозотолерантного теста. Определение уровня гликированного гемоглобина неинформативно в первые месяцы после трансплантации[18]. Фармакотерапия АГ, дислипидемии у реципиентов печени должна проводиться с учетом неблагоприятного взаимодействия назначаемых почти всем пациентам иммуносупрессоров из группы ингибиторов кальциневрина с недигидропиридиновыми антагонистами кальция (дилтиаземом, верапамилом), так как они повышают уровень и циклоспорина, и такролимуса[19].
В метаболизме большинства статинов участвует тот же фермент, что и в метаболизме ингибиторов кальциневрина, а именно CYP3A4; это повышает риск развития ассоциированной со статинами миопатии и других токсических эффектов, ввиду чего необходимо тщательное клиническое и лабораторное наблюдение. Правастатин и флувастатин не метаболизируются ферментом CYP3A4, поэтому во многих трансплантационных центрах им отдается предпочтение[20].
Эти и ряд других особенностей детально описаны нами ранее в обзорах литературы (преимущественно зарубежной), в которой приводятся результаты ретроспективных и проспективных исследований о соматической патологии реципиентов печени[21–24].
Известные в настоящее время закономерности патогенеза и течения ХНИЗ у реципиентов печени важно принимать во внимание при разработке индивидуальных профилактических программ по снижению риска развития неинфекционных заболеваний, как алиментарных и вызванных побочными эффектами лекарств (первичная профилактика), так и являющихся осложнениями уже имеющихся нозологий, частота которых растет по мере увеличения срока после трансплантации и возраста реципиентов (вторичная профилактика).
Число центров трансплантации печени в России за период с 2006 по 2017 г. увеличилось на 19 (в 3,8 раза), в основном за счет региональных центров (13) и центров Федерального медико-биологического агентства (4)[1]. Возможность обращения к лечащему врачу трансплантационного центра при любом ухудшении состояния — общепринятое условие наблюдения реципиентов в отдаленном послеоперационном периоде.
С другой стороны, реальная клиническая практика показала, что реципиенты, особенно из районов, удаленных от краевого центра, по-прежнему достаточно часто посещают поликлинику по месту жительства не только с целью получения рецепта на иммуносупрессивные препараты, но и по поводу симптомов различных заболеваний (проявлений острых респираторных инфекций, повышения АД, болевого синдрома различного генеза и т. д.). В то же время в изученной нами первичной документации ряда регионов, несмотря на активное посещение многими пациентами участкового врача, крайне редко указаны данные об ИМТ пациента, динамике АД и скорости клубочковой фильтрации, окружности талии, курении, липидном профиле, не всегда адекватно верифицировано ХНИЗ, нередко отсутствовали развернутые формулировки диагнозов.
В рамках ретроспективного исследования можно предположить, что, помимо увеличения количества факторов риска ХНИЗ, причиной существенного прироста частоты ИБС и ХСН является гиподиагностика сердечно-сосудистых ХНИЗ у пациентов с тяжелыми поражениями печени до трансплантации. Вероятно, основные общие симптомы, например, ХСН, такие как слабость, снижение физической активности, отеки, пересекаясь с основными клиническими симптомами терминальной печеночной недостаточности, не позволили сделать вывод о необходимости инструментальной верификации ХСН. Крайнее ограничение физической активности пациентов до трансплантации маскирует как симптоматику ХСН, так и клинические проявления сниженного коронарного резерва даже в условиях атеросклеротического поражения коронарных сосудов.
Помимо этого обращает на себя внимание практически полное неиспользование методов верификации ИБС и ХСН, хронического панкреатита, что делает актуальным и с научной, и с практической точки зрения планирование проспективного регистрового исследования распространенности ХНИЗ с введением «дорожной карты» скринингового и углубленного обследования.
В связи с вышеизложенным представляется целесообразным акцентировать внимание интернистов на целенаправленном выявлении факторов риска ХНИЗ у пациентов после трансплантации. Учитывая, что основную долю больных ССЗ составляют лица с АГ (62,2%), особое внимание в повседневной практике следует обратить именно на эту — наиболее многочисленную — категорию пациентов.
ЗАКЛЮЧЕНИЕ
Опираясь на данные о ряде отличий в частоте факторов риска, об особенностях верификации и лечения хронических неинфекционных заболеваний (ХНИЗ) у реципиентов печени в сравнении с общей популяцией[25], полагаем, что в трансплантационных центрах необходима разработка специализированного алгоритма диспансерного наблюдения реципиентов (чек-листа) для адекватной профилактики ХНИЗ.
Глобальный план действий Всемирной организации здравоохранения по профилактике неинфекционных заболеваний и борьбе с ними на 2013–2020 гг. предполагает, что «…переориентированная и усиленная система здравоохранения должна преследовать цель раннего выявления пациентов с сердечно-сосудистой патологией, онкологическими заболеваниями, хроническими заболеваниями органов дыхания, сахарным диабетом и другими неинфекционными заболеваниями, а также лиц, подвергающихся повышенному риску; заниматься профилактикой осложнений, снижением потребности в госпитализации и оказании дорогостоящей высокотехнологичной медицинской помощи и предотвращением преждевременной смертности…»[26]. Именно эту цель с учетом существенного снижения рисков отторжения и улучшения выживаемости пациентов после пересадки донорских органов должны ставить перед собой врачи, наблюдающие реципиентов.








