Ожирение — актуальное, социально значимое явление, фактор риска развития «болезней цивилизации». За период 2010–2016 гг. заболеваемость первичным ожирением (E66–E67 по МКБ-10) в России выросла на 53%: с 813,2 до 1244,5 случая на 100 тысяч населения, — а с установлением диагноза впервые в жизни — на 98%[1, 2].
Однако метаанализ, проведенный группой ученых из Канады и США в 2018 г., с обработкой информации о 54 000 участников выявил 6% пациентов с ожирением, но без нарушений обмена веществ[3]. Такой феномен получил признание как «метаболически здоровое ожирение» (в оригинальном тексте: metabolically healthy obese[4]): согласно физиологическим исследованиям, у части пациентов с ожирением сохраняется относительная чувствительность к инсулину, а эпидемиологические данные указывают на низкий риск развития метаболического синдрома, диабета и ССЗ. Эти наблюдения отражают разные плацдармы метаболической адаптации при «здоровом» и патологическом ожирении, в частности различные структурно-функциональные изменения печени в генезе заболевания.
Актуальность проблемы подчеркивают, например, авторы Общих принципов клинической практики по оказанию медицинской помощи больным ожирением Американской ассоциации клинических эндокринологов и Американской коллегии эндокринологов (англ. AACE/ACE Comprehensive Clinical Practice Guidelines for Medical Care of Patients with Obesity, 2016)[4], а также авторы Клинических рекомендаций по диагностике и лечению неалкогольной жировой болезни печени (НАЖБП) (англ. Clinical Practice Guidelines for the Management of Non-Alcoholic Fatty Liver Disease), опубликованных в 2016 г.[5]. Согласно мнению специалистов европейских ассоциаций по изучению болезней печени (англ. European Association for the Study of the Liver, EASL), диабета (англ. European Association for the Study of Diabetes, EASD) и ожирения (англ. European Association for the Study of Obesity, EASO), у пациентов с инсулинорезистентностью
и/или наличием метаболических факторов риска необходимо проводить диагностику НАЖБП (степень А1) и определять стадию жировой дегенерации печени, так же как у всех лиц со стеатозом надо исключать компоненты метаболического синдрома (степень А1)[4, 5].
Известно о широкой распространенности как заболеваний печени, так и избыточной массы тела среди россиян. По данным эпидемиологического проекта DIREG 2, состояние избыточного питания в Российской Федерации диагностировали у 67% амбулаторных пациентов из 50 000 обследованных, а распространенность жировой дегенерации печени в виде неалкогольного стеатоза печени (СП) составляет 28%[6].
Разработка и использование критериев клинической лабораторной диагностики в целях профилактики и диагностики поражения отдельных органов представляются крайне актуальными и корреспондируют с Программой профилактики неинфекционных заболеваний — одного из основных направлений развития российского здравоохранения на ближайшие годы согласно Стратегии развития здравоохранения в России до 2025 года[7]. На ранних этапах ожирения с повышенной функциональной нагрузкой на печень изменение образа жизни, контроль над факторами риска и терапевтические методы позволяют воздействовать на метаболические нарушения, устраняя их.
Цель исследования: определить информативность лабораторных показателей как предикторов метаболических нарушений функции печени при ранних отклонениях в состоянии здоровья пациентов с абдоминальным ожирением (АО).
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проведено с соблюдением правил Международного стандарта GCP (англ. Good Clinical Practice — «Надлежащая клиническая практика») и Хельсинкской декларации Всемирной медицинской ассоциации «Этические принципы проведения медицинских исследований с участием человека в качестве субъекта», одобрено комитетом по этике Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова Минздрава России.
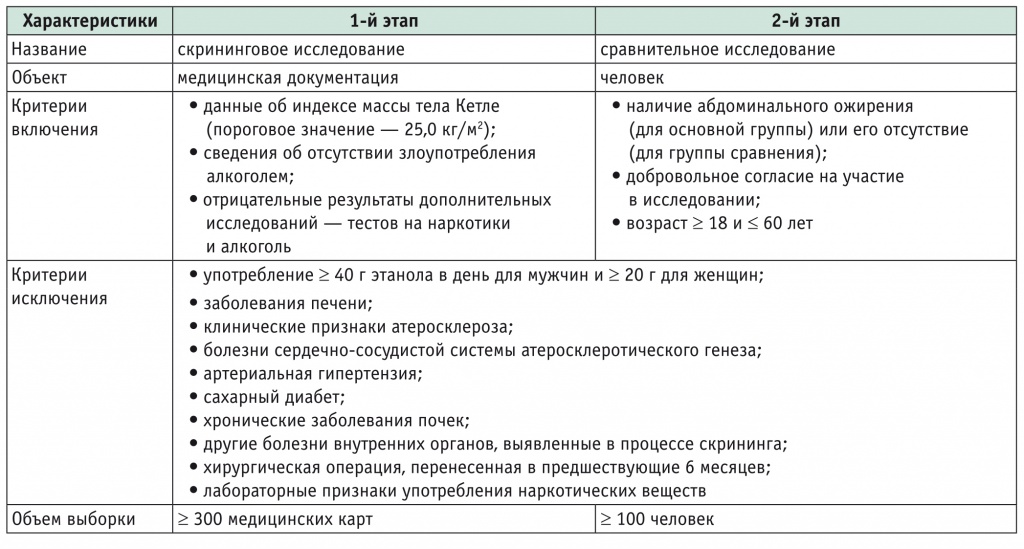
Работа состояла из двух этапов: скрининга и сравнительного исследования. Критерии включения и исключения из каждого этапа и другие основные характеристики дизайна исследования приведены в таблице 1.
Таблица 1
Дизайн исследования
Состояние здоровья участников оценивалось в процессе периодических профилактических медицинских осмотров[8] в специализированном отделении Клиники высоких медицинских технологий им. Н.И. Пирогова Санкт-Петербургского государственного университета и в Северо-Западном центре доказательной медицины (АО «СЗЦДМ», г. Санкт-Петербург).
В ходе скрининга были проанализированы данные профилактических медицинских осмотров 262 человек с ожирением или избыточным весом и 100 — с нормальным весом.
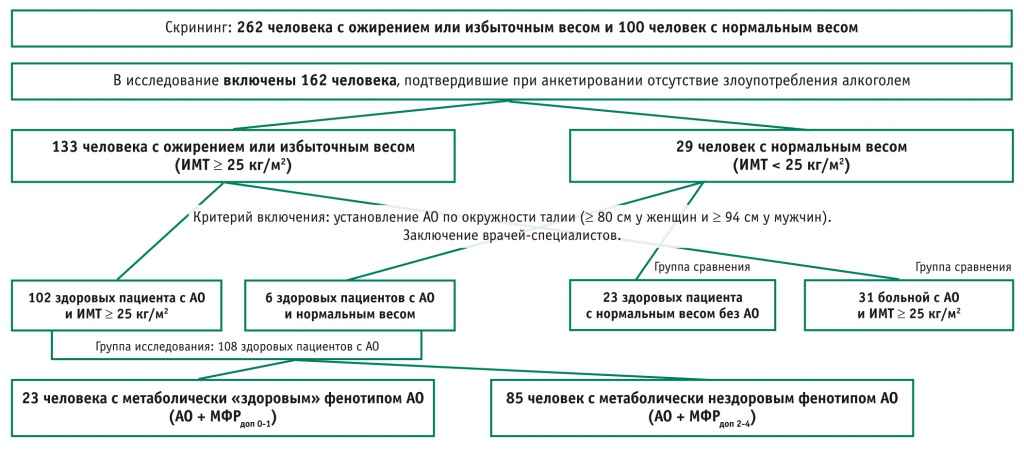
В сравнительное исследование были включены 162 человека, при анкетировании подтвердивших отсутствие злоупотребления алкоголем (с учетом норм, рекомендованных ВОЗ: < 40 г этанола в день для мужчин и < 20 г для женщин) и давших письменное согласие на участие в исследовании. Среди них было 133 человека с ожирением или избыточным весом и 29 — с нормальным весом. Блок-схема исследования, обследования и распределения лиц с АО по группам представлена на рисунке.
Рис. Блок-схема исследования.
Примечание. АО — абдоминальное ожирение; ИМТ — индекс массы тела; МФРдоп — дополнительный метаболический фактор риска
В рамках обследования проводились оценка жалоб и анамнеза, физикальные исследования: определение антропометрических параметров (окружности талии (ОТ), массы тела, роста, ИМТ), аускультация и измерение АД, — а также анкетирование, ЭКГ. Все участники обследования были осмотрены врачами-специалистами: терапевтом, неврологом, психиатром-наркологом, офтальмологом, хирургом, стоматологом, оториноларингологом, дерматологом.
Всем включенным в обследование были выполнены лабораторные тесты: определение уровней АЛТ, АСТ γ-глутамилтрансферазы, общего билирубина, глюкозы крови натощак (ГКН), триглицеридов, общего холестерина, холестерина липопротеинов высокой плотности (ХсЛПВП) и низкой плотности (ХсЛПНП), клинический анализ крови. Лабораторные исследования проводились на базе лаборатории АО «СЗЦДМ».
АО устанавливали при ОТ ≥ 80 см у женщин и ≥ 94 см у мужчин (EASL/EASD/EASO, 2016[5]). На основании полученных результатов из 162 обследованных сформировали группы:
- здоровых лиц с АО (n = 108);
- ССЗ с АО (n = 31);
- здоровых лиц без АО (n = 23) (см. рис.).
Учитывая необходимость выявления метаболических нарушений у лиц с АО, у участников обследования определяли наличие лабораторных критериев метаболического синдрома, точки отсечения компонентов которого выбирали в соответствии с требованиями нескольких документов [5, 9, 10]. Дополнительные метаболические факторы риска (МФРдоп) учитывали согласно критериям Национальных клинических рекомендаций по ведению больных с метаболическим синдромом (2013)[9]: триглицериды ≥ 1,7 ммоль/л; ХсЛПВП < 1 ммоль/л у мужчин и < 1,2 ммоль/л у женщин; ХсЛПНП > 3,0 ммоль/л; ГКН ≥ 6,1 ммоль/л. АД ≥ 140/90 мм рт. ст. и прием антигипертензивных средств являлись критериями исключения из исследования. Обследованные без МФРдоп и с одним МФРдоп считались метаболически «здоровыми», с двумя МФРдоп и более — метаболически нездоровыми.
При разделении здоровых лиц с АО (n = 108) на группы метаболически «здорового» и метаболически нездорового фенотипа абдоминального ожирения (МЗФАО и МНЗФАО соответственно) выбранные для работы рекомендации[9] позволили включить в подгруппу метаболически «здоровых» наименьшее количество участников: 23 человека вместо 31 (табл. 2, 3). В результате были сформированы две группы исследования: МЗФАО (n = 23) и МНЗФАО (n = 85) (см. рис.).
Таблица 2
Критерии метаболического синдрома
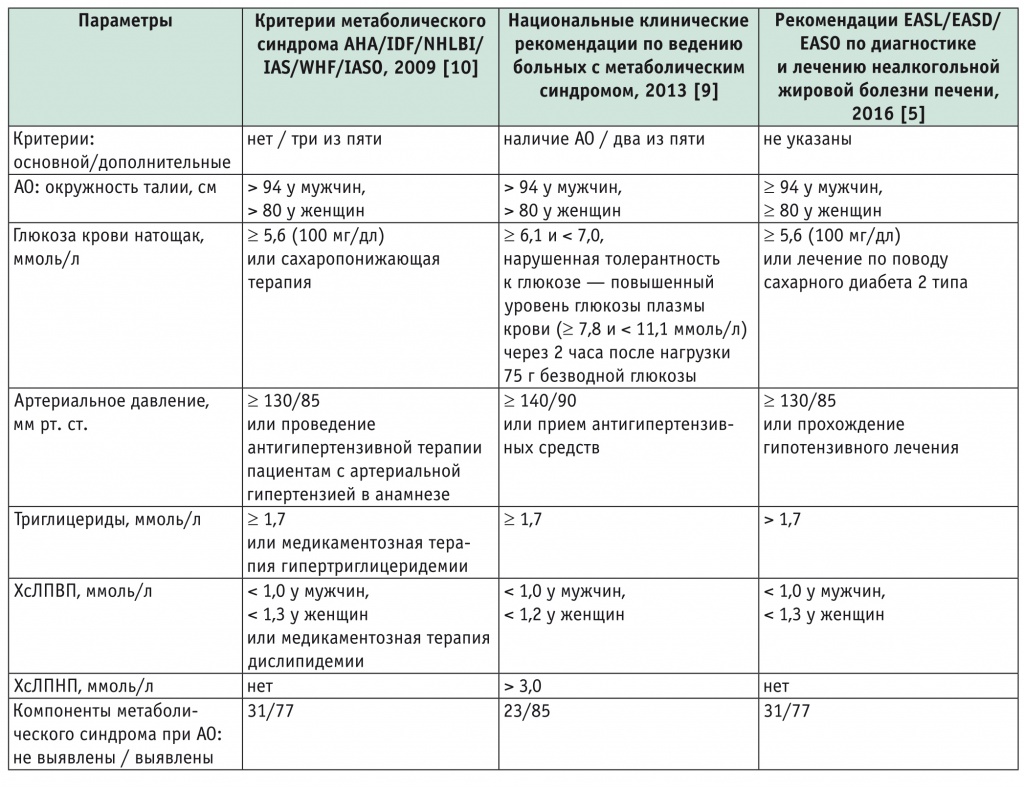
Примечание. Здесь и в последующих таблицах: АО — абдоминальное ожирение; ХсЛПВП и ХсЛПНП — холестерин липопротеинов высокой и низкой плотности соответственно; AHA — Американская кардиологическая ассоциация; EASD — Европейская ассоциация по изучению диабета; EASL — Европейская ассоциация по изучению болезней печени; EASO — Европейская ассоциации по изучению ожирения; IAS — Международное общество по изучению атеросклероза; IASO — Международная ассоциация по изучению ожирения; IDF — Международная федерация диабета; NHLBI — Национальный институт сердца, легких и крови (США); WHF — Всемирная кардиологическая федерация.
Таблица 3
Характеристика биохимических показателей метаболически «здоровых» лиц
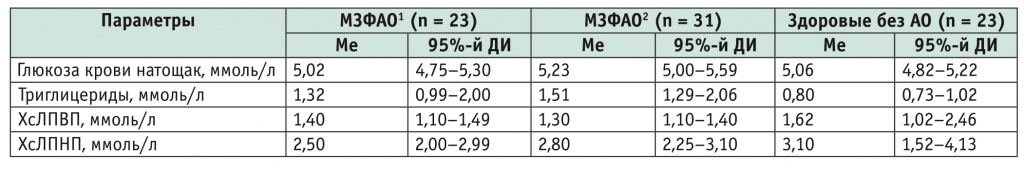
1 Национальные клинические рекомендации по ведению больных с метаболическим синдромом, 2013[9].
2 Клинические рекомендации AHA/IDF/NHLBI/IAS/WHF/IASO, 2009[10]; EASL/EASD/EASO, 2016[5].
Примечание. Здесь и в последующих таблицах МЗФАО — метаболически «здоровый» фенотип абдоминального ожирения.
Группы сравнения сформировали участники, отнесенные к патологии (больные ССЗ с АО, n = 31) и к норме (здоровые лица без АО, n = 23).
Оценка распределения пациентов указывает на однородность групп исследования по возрасту и степени ожирения (по весу, ИМТ и ОТ) (табл. 4).
Таблица 4
Характеристика сформированных групп
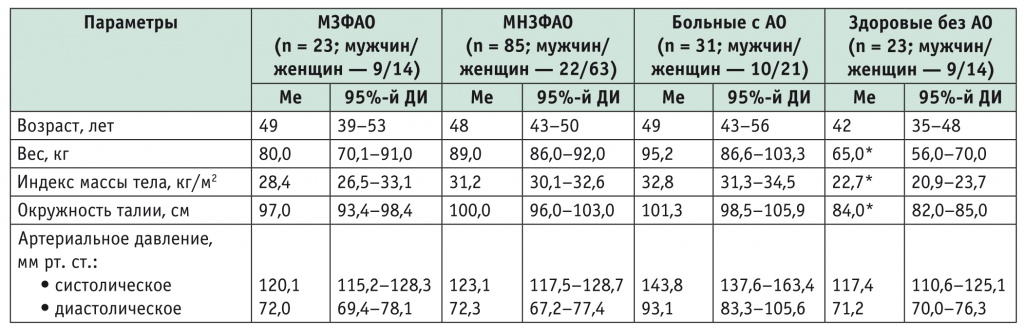
Примечания.
- Здесь и в последующих таблицах МНЗФАО — метаболически нездоровый фенотип абдоминального ожирения.
- Знаком (*) отмечены статистически значимые различия с группой МЗФАО: p < 0,05.
Для определения стадии поражения печени, учета стадии жировой дегенерациии печени (ЖДП), исключения фиброза всем обследованным выполняли расчеты по алгоритму FibroMax и/или SteatoScreen (патент RU 2 403 576 C2 компании BioPredictive, Франция). Эти результаты оценивали в совокупности с данными УЗИ печени, желчного пузыря, поджелудочной железы, селезенки и почек. Исследовали концентрации аполипопротеина A1, аполипопротеина B, высокочувствительного С-реактивного белка (hsСРБ), гомоцистеина, инсулина натощак, α2-макроглобулина и гаптоглобина, кишечную микробиоту. С целью оценки изменений в сосудистой стенке проводили дуплексное сканирование каротидных артерий.
В ходе исследований рассчитывали индекс инсулинорезистентности HOMA-IR по формуле D.R. Matthews (1985):глюкоза натощак (ммоль/л) × инсулин натощак (Ед/л)/22,5, а также индекс висцерального ожирения (англ. Visceral Adiposity Index, VAI) для мужчин и женщин по формулам M.C. Amato и соавт. (2010)[11] и коэффициент накопления продуктов липидов (англ. Lipid Accumulation Product, LAP) по формулам H. Kahn и соавт. (2005)[12].
Результаты исследования представлены абсолютными числами и процентами, значениями медианы (Me) и 95%-го,
99%-го доверительного интервала (ДИ). Статистический анализ проведен с использованием статистических пакетов Portable Statistica 8 (StatSoft, США), MedCalc (MedCalc Software, Бельгия) и программы Microsoft Excel (Microsoft, США). Для нормального распределения данных применяли параметрические методы анализа (дисперсионный анализ, t-критерий Стьюдента), в остальных случаях — непараметрические методы (критерии Вилкоксона, Манна — Уитни). Взаимосвязь признаков оценивали с использованием метода корреляции Пирсона (для параметрического семейства) или Спирмена; операционные параметры тестов, такие как диагностическая чувствительность и диагностическая специфичность, — по четырехпольным таблицам сопряженности; диагностическую точность — по характеристическим ROC-кривым (англ. Area Under the Curve, AUC) и индексу Юдена (J). Различия показателей считали статистически значимыми при p < 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Описываемое исследование для определения эффективных предикторов и биомаркеров ЖДП и сопутствующей патологии сердечно-сосудистой системы основано на оценке состояния клинически «здоровых» пациентов с АО.
В число лиц со «здоровым» ожирением, то есть c АО без МФРдоп и с одним МФРдоп, вошли 7 человек (30,4% от группы МЗФАО), что составило 6,5% от общего количества здоровых пациентов с АО. Это сопоставимо с результатами других исследователей, указывающих на 6–10% пациентов с ожирением без нарушения обмена веществ[3, 13].
Нами выявлено, что даже для этих пациентов характерен умеренный (6–32%) СП (табл. 5), который указывает на наличие метаболических нарушений функции печени.
Таблица 5
Распределение пациентов по стадиям жировой дегенерации печени
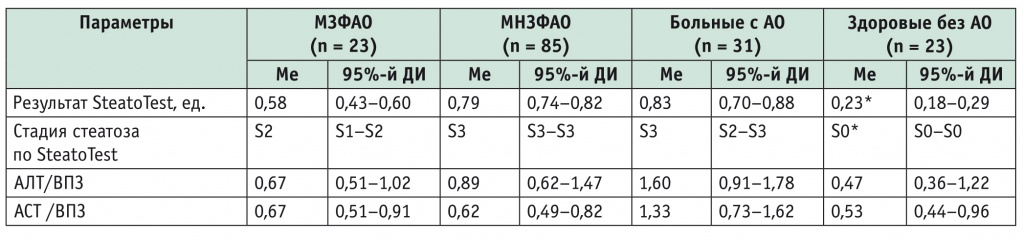
Примечания.
- АЛТ — аланинаминотрансфераза; АСТ — аспартатаминотрансфераза; ВПЗ — верхнее пороговое значение референтного интервала.
- Стадии стеатоза по SteatoTest: S0/S0–S1– нет стеатоза (< 1%); S1/S1–S2 – минимальный стеатоз (1–5%); S2/S2–S3 — умеренный стеатоз (6–32%); S3 — выраженный стеатоз (> 32%).
- Знаком (*) отмечены статистически значимые различия с группой МЗФАО: p < 0,05.
Статистически значимых различий между группами метаболически «здорового» ожирения и здоровых без АО по уровням лабораторных биомаркеров, характеризующих биохимические изменения функции печени, не выявлено, медианы показателей не превышали пороговых значений, АСТ ≤ АЛТ:
- повышение медианы АЛТ у лиц с метаболически «здоровым» ожирением по сравнению с обследованными с нормальным весом (30,0 МЕ/л, 95%-й ДИ [23,0–52,9] vs 21,5 МЕ/л, 95%-й ДИ [16,4–55,4]; p > 0,05) без превышения верхнего значения референтного интервала;
- повышение медианы АСТ у лиц с метаболически «здоровым» ожирением по сравнению с обследованными с нормальным весом (31,0 МЕ/л, 95%-й ДИ [22,0–49,9] vs 24,7 МЕ/л, 95%-й ДИ [20,4–43,0]; p > 0,05) без превышения верхнего значения референтного интервала.
Отмечено повышение медианы уровня γ-глутамилтрансферазы у лиц с метаболически «здоровым» ожирением по сравнению с группой с нормальным весом (42,1 МЕ/л, 95%-й ДИ [33,0–61,9] vs 24,6 МЕ/л, 95%-й ДИ [15,7–30,0]; p < 0,05) без превышения верхнего значения референтного интервала. Возможно, это отражает начальные изменения в кишечной микробиоте и связанное с этим увеличение продукции эндогенного алкоголя[14], а также изменения глутатионового цикла вследствие активации процессов перекисного окисления липидов.
По нашему мнению, в связи с этим в отношении пациентов с неполным набором критериев метаболического синдрома более корректно вместо «метаболически здорового ожирения» (англ. "metabolically healthy obese", "metabolically healthy" obese[4, 5]) применять выражения «ожирение без метаболического синдрома» или «ожирение с сопутствующими метаболическими нарушениями (одним или несколькими)».
Оценка основных лабораторных параметров указывает на статистически значимые различия между обследованными с разными метаболическими фенотипами АО (табл. 6). Такие различия между группами МЗФАО и МНЗФАО выявлены для мужчин и женщин по показателям липидного обмена (p < 0,005, p < 0,001), величине VAI (p < 0,001), значениям гомоцистеина (p < 0,01), а также для мужчин по уровням hsСРБ (p < 0,01) и инсулина (p < 0,001).
Таблица 6
Лабораторная характеристика пациентов
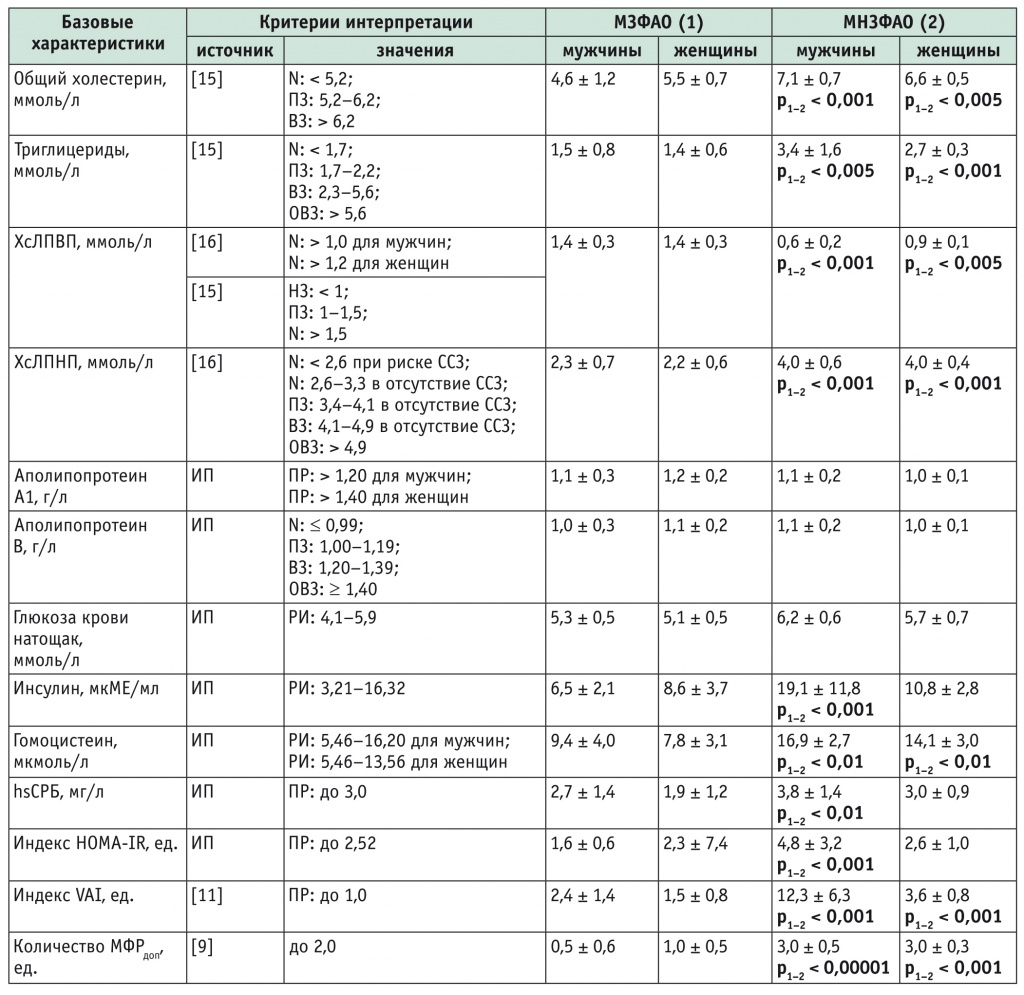
Примечания.
- Данные представлены как медиана и 99%-й доверительный интервал.
- ВЗ — высокие значения; ИП — инструкция производителя тест-системы; МФРдоп — дополнительные метаболические факторы риска; НЗ — низкие значения; ОВЗ — очень высокие значения; ПЗ — пограничные значения; ПР — предел решения; РИ — референтный интервал; ССЗ — сердечно-сосудистые заболевания; hsСРБ — высокочувствительный С-реактивный белок; N — норма.
На доклиническом этапе развития ассоциированной с АО патологии для пациентов нехарактерна толерантность к глюкозе. Только индекс инсулинорезистентности HOMA-IR подтверждает измененную чувствительность к инсулину, что находит отражение в усилении формирования эндогенных триглицеридов в гепатоцитах[17].
Изученные лабораторные биомаркеры в сравниваемых группах имеют статистически значимые различия и при МНЗФАО на 20–30% отличаются от пограничных значений (пределов клинического решения, референтных интервалов). Они могут использоваться в доклинической диагностике с разной точностью, зависящей от выбора точек отсечения. Вместе с тем ни один лабораторный маркер не может быть предложен в качестве лабораторного предиктора при оценке ранних функциональных отклонений в состоянии здоровья пациентов. Таким предиктором предположительно может стать интегральный параметр, представляющий собой совокупность нескольких показателей (лабораторных и антропометрических).
Результаты исследования логистической модели метаболически нездорового ожирения подтвердили правильность этой гипотезы и продемонстрировали, что именно патологические изменения в печени и висцеральная жировая дисфункция формируют метаболический синдром (р < 0,0001; AUC = 0,965). Статистическую значимость имеют изменения показателей дисфункции висцеральной жировой ткани: VAI (р = 0,009) и показатель ЖДП, для определения которого применяется SteatoTest (р = 0,002). На этом этапе оценка инсулинорезистентности не имеет статистической значимости (рHOMA-IR = 0,25; отношение шансов (OR) = 0,79; 95%-й ДИ [0,53–1,18]). Необходимо обратить внимание, что у метаболически «здоровых» пациентов с АО поражение печени характеризуется умеренным неалкогольным жировым гепатозом с поражением менее 32% гепатоцитов.
Лучшей моделью множественной линейной регрессии для оценки ЖДП с поражением более 32% гепатоцитов, изученной в ходе данного исследования, стало использование четырех независимых переменных: коэффициента LAP (p = 0,0096), уровней АЛТ (p = 0,0024), ГКН (p = 0,0104) и ХсЛПВП (p = 0,0463), — совокупный вклад которых в оценку ЖДП составил 40% (p < 0,0001).
Модель прогнозирования выраженной ЖДП для ранней диагностики на основе расчетного индекса «предиктор СП32» (далее — предиктор СП32[18]) демонстрирует статистически значимые различия между значениями медиан в контрольной и исследуемой группах: 0,65 ед., 95%-й ДИ [0,61–0,69] vs 0,75 ед., 95%-й ДИ [0,72–0,79]; p < 0,0001). Статистически значимых различий по полу не выявлено (p = 0,12). Предложенный предиктор СП32 проявляет достоверные корреляции разной степени выраженности с маркерами липидного обмена, инсулинорезистентности.
Достоверность выбранного маркера подтверждена в группе проверки диагностической работоспособности тестов (n = 135) с соотношением здоровых лиц без ожирения и лиц с АО и клинически манифестировавшими заболеваниями, ассоциированными с АО, 17/83% (AUCСП32 = 0,910). Оптимальная точка отсечения не имела гендерных различий, при значениях более 0,69 ед. обладала высокой диагностической чувствительностью и специфичностью (81% и 88% соответственно), что сравнимо с результатами инструментально-диагностических методов первой линии диагностики (для УЗИ печени при дифференциальной диагностике умеренного/выраженного стеатоза чувствительность составляет 85,7% и специфичность — 85,2%)[19].
Сравнение двух логистических моделей оценки метаболических нарушений при АО, одна из которых базируется на критериях национальных клинических рекомендаций (2013)[9], а в другой используется только предиктор СП32, продемонстрировало следующие результаты:
– сочетание традиционно учитываемых факторов, состоящих из оценки ОТ, уровней триглицеридов, ГКН, ХсЛПНП и ХсЛПВП (АД ≥ 140/90 мм рт. ст. или прием антигипертензивных средств — критерий исключения из научного исследования), позволяет корректно классифицировать 89% пациентов; оценка площади под ROC-кривой свидетельствует о высокой дискриминационной характеристике модели (р < 0,0001; AUC = 0,957; 95%-й ДИ [0,898–0,987]). Только уровни триглицеридов (р < 0,001; OR = 9,9; 95%-й ДИ [2,5–39,6]) и ГКН (р < 0,02; OR = 6,3; 95%-й ДИ [1,4–29,7]) статистически значимо влияют на оценку метаболических нарушений;
– предиктор СП32 достоверно выявляет метаболические нарушения (р < 0,0001), позволяет корректно классифицировать 88% пациентов; оценка площади под ROC-кривой также свидетельствует о высокой дискриминационной характеристике модели (р < 0,0001; AUC = 0,922; 95%-й ДИ [0,852–0,966]).
Сильная корреляция выявлена между индикатором раннего атеросклероза — увеличением толщины комплекса интима-медиа общей сонной артерии (ТКИМОСА) — и прогностическим параметром для ЖДП — предиктором СП32 (r = 0,48; p < 0,0001).
Использование предиктора СП32 (р = 0,0011) и концентрации гомоцистеина (р = 0,012) является подходящей моделью для выявления признаков раннего атеросклеротического поражения сосудистой стенки брахиоцефальных артерий у пациентов (ТКИМОСА ≥ 1 мм).
Это демонстрирует дополнительные возможности разработанного показателя — предиктора СП32 — при оценке метаболически нездорового ожирения.
Таким образом, СП32 следует считать оптимальным предиктором для выявления метаболических нарушений при ожирении и поражении печени.
Использование валидированных лабораторных методов позволяет оценить стадии ЖДП. В силу недоступности данных тестов, а также методов инструментальной диагностики (КТ, МРТ, 1Н-магнитно-резонансная спектроскопия, пункционная биопсия с гистологическим исследованием) эти возможности часто игнорируются в клинике. Клиницисты концентрируются на клинически выраженных проявлениях неалкогольного стеатогепатита и фиброза печени и не используют лабораторные маркеры при ранних изменениях функций органов, когда формирование программы динамического мониторинга и терапевтической коррекции состояния может принести максимальный результат. Представленное исследование позволило проанализировать наличие синхронных взаимосвязей уровней лабораторных маркеров со стадиями СП при отсутствии патологических изменений в лабораторных показателях и предложить доступный тест для ранней диагностики метаболических нарушений при ожирении.
ЗАКЛЮЧЕНИЕ
Изучение состояния предболезни, определенного по совокупности лабораторно-инструментальных признаков, у здоровых пациентов различного возраста и разных категорий риска, объединенных по критерию «абдоминальное ожирение», позволило расширить представления о последовательности биохимических изменений, доступных для измерения лабораторными методами. Результаты исследования демонстрируют, что именно патологические изменения в печени и висцеральная жировая дисфункция формируют метаболически нездоровый фенотип абдоминального ожирения.
Полученные нами результаты подтверждают данные литературы о нескольких патогенетических путях развития метаболического синдрома — через висцеральную дисфункцию жировой ткани и инсулинорезистентность[20], — а также отражают тот факт, что на доклиническом этапе формирование метаболического синдрома менее точно диагностируется с помощью регламентированных показателей окружности талии, уровня глюкозы крови натощак и инсулинорезистентности.
Клинические исследования «случай — контроль» с формированием групп из здоровых и больных лиц, направленные на выбор точек разделения пороговых значений, оценку диагностической значимости и эффективности диагностических тестов, не позволяют определить оптимальные точки отсечения для доклинической диагностики. Поэтому актуализация данных о чувствительности и специфичности лабораторных методов исследования, используемых для различных состояний, в том числе доклинических, является важной задачей медицинских лабораторий. Полученные результаты, характеризующие абдоминальное ожирение без метаболических нарушений, подтверждают диагностическую недостаточность оценки только антропометрических показателей ожирения и свидетельствуют о необходимости стандартизации критериев для определения метаболически «здорового» ожирения[21, 22].








